Th1细胞与IL-2在大鼠肝纤维化形成与逆转中的动态变化及意义
2019-02-11徐智芳门九章
李 霞,徐智芳,麻 莉,门九章*
(1山西中医药大学第四临床学院内科教研室,晋中 030619;2山西医科大学第二医院血液病分子诊疗山西省重点实验室;*通讯作者,E-mail:zydrmjz2005@163.com)
肝纤维化是各种慢性肝病向肝硬化发展的病理阶段,也是机体对肝实质损伤的一种修复反应。肝纤维化的发生发展与机体免疫功能异常密切相关,CD4+T淋巴细胞作为重要的免疫细胞在肝纤维化进展中起重要作用[1]。其中,Th1细胞主要通过分泌干扰素-γ(interferon-γ,IFN-γ)和白细胞介素-2(interleukin-2,IL-2)等细胞因子发挥免疫调节作用[2]。肝星状细胞(hepatic stellate cells,HSC)活化是肝纤维化的中心环节,抑制HSC活化是防治肝纤维化的重要途径[3]。α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)是HSC活化的标志。研究表明,IFN-γ通过抑制HSC增殖并下调HSC中α-SMA的表达,发挥抗纤维化作用[4]。而IL-2在肝纤维化形成与逆转中的作用尚未阐明,Th1细胞的作用仍存在争议[5,6]。因此,本文旨在研究Th1细胞及其细胞因子IL-2在四氯化碳(carbon tetrachloride,CCl4)诱导大鼠肝纤维化进展期与恢复期中的动态变化,以及其与HSC活化的关系,探讨Th1细胞及IL-2在肝纤维化发生发展及自发逆转过程中的作用机制,为阐明肝纤维化的免疫机制提供理论依据。
1 材料与方法
1.1 试剂与仪器
二甲基亚硝胺(DMN,批号:14703781,上海惠城生物科技有限责任公司);大鼠白细胞介素-2(IL-2)ELISA检测试剂盒(上海瓦兰生物科技有限公司);兔抗鼠α-平滑肌肌动蛋白(α-SMA)抗体(英国Abcam公司);辣根过氧化物酶标记的山羊抗小鼠免疫组化检测试剂盒(上海瓦兰生物科技有限公司);PE/Cy7标记的CD4单克隆抗体、FITC标记的IFN-γ单克隆抗体(美国Biolegend公司);红细胞裂解液、细胞刺激剂和蛋白质转运抑制剂复合物(美国eBioscience公司);Ficoll-Paque淋巴细胞分离液(美国GE公司);含HEPES的RPMI 1640培养基(美国Gibco公司);PBS(美国Sigma公司);Tanon 5200全自动化学发光成像分析系统(上海天能科技有限公司);iCEN-24R高速冷冻离心机(杭州奥盛仪器有限公司);RT-6100酶标分析仪(美国雷杜公司);HI1210水浴锅(德国leica公司);ROS-S26型UPW实验室超纯水系统(武汉吉百瑞科技有限公司)。
1.2 肝纤维化模型建立与分组
SD大鼠80只,雄性,SPF级,体质量(200±20)g,购自中国食品药品检定研究院,合格证编号为SCXK(京)2014-0013,常规饲养1周后开始实验。80只SD大鼠随机分成正常组40只和模型组40只,各组再分为4,8,12,16周4个亚组,每组10只。模型组大鼠均使用CCl4腹腔注射制备肝纤维化模型,腹腔注射50% CCl4橄榄油溶液(1 ml/kg),每周2次。正常组大鼠腹腔注射等量橄榄油。分别于注射CCl4的第4,8,12周末和停止注射CCl4后4周末(即注射CCl4第16周末)处死各组大鼠,收集血清和肝脏标本待检测。
1.3 指标检测及方法
1.3.1 肝组织病理学观察 各组大鼠肝组织均以10%的甲醛固定,常规HE染色,观察肝组织病理学改变。
1.3.2 血清IL-2水平检测 采用ELISA法检测大鼠血清IL-2水平,按试剂盒说明书进行,在450 nm处测吸光度值,绘制标准曲线,计算各待测血清IL-2水平。
1.3.3 免疫组化法检测肝组织α-SMA蛋白表达 将石蜡切片用二甲苯脱蜡,梯度乙醇水化,浸入0.01 mol/L枸橼酸钠缓冲液(pH6.0)中高压修复15 min,自然冷却,0.02 mol/L PBS冲洗3次,每次3 min,置于3%H2O2中,湿盒孵育10 min,以消除内源性过氧化物酶的活性。滴加一抗兔抗小鼠α-SMA抗体(1 ∶200),湿盒孵育,4 ℃孵育过夜。滴加二抗,湿盒孵育,室温下放置30 min。DAB显色,苏木素复染3 min,置于二甲苯中透明2次,每次3 min,中性树胶封片。每张肝组织切片随机选取5个不连续视野拍照,使用Image-Pro Plus7.0图像分析软件对α-SMA的表达进行半定量测定,计算平均光密度值。
1.3.4 流式细胞仪检测脾脏Th1细胞比例 大鼠处死后无菌条件下取出脾脏,PBS清洗,在70 μm细胞滤网上研磨过滤,过滤后细胞与1.5 ml PBS混匀。在离心管中加入1.5 ml Ficoll-Paque淋巴细胞分离液,再加入PBS组织混合液,2 000 r/min离心20 min,离心后混合液分为四层,吸出第二层云雾层,PBS洗涤两次后得到沉淀为淋巴细胞。取脾脏淋巴细胞悬液,加入红细胞裂解液裂解红细胞。用含HEPES的RPMI1640调整细胞浓度至1×106/ml,然后接种于24孔板,同时加入细胞刺激剂(PMA和离子霉素)和蛋白质转运抑制剂(BFA和莫能菌素)复合物,置于37 ℃、5%CO2孵箱中刺激培养48 h。取出至流式试管中,加入2.5 μl PE/Cy7标记的CD4抗体表面染色,4 ℃避光孵育30 min;加入2 ml PBS,1 500 r/min离心5 min,弃去上清液;漩涡振荡重悬细胞后,加入0.5 ml固定/破膜工作液,漩涡振荡后4 ℃避光孵育30 min;再加入1.5 ml破膜缓冲液(稀释比例1 ∶9),孵育15 min后1 500 r/min离心5 min,弃去上清液;加入FITC标记的IFN-γ抗体细胞内染色,室温避光孵育30 min,加入2 ml PBS 1 500 r/min离心5 min,弃去上清液;加入0.5 ml PBS重悬细胞后,将CD4+IFN-γ+细胞界定为Th1细胞,采用流式细胞仪检测Th1细胞比例,结果采用FlowJo软件进行分析。
1.4 统计学处理
应用SPSS 19.0软件进行统计分析,计量资料数据均采用均数±标准差表示,组间比较选用成组设计的t检验,多组间均数比较采用单因素方差分析,相关性检验采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝组织病理学观察结果
造模期间,模型组大鼠腹腔注射CCl4后死亡3只。正常组大鼠腹腔注射橄榄油第4,8,12周肝小叶结构完整,可见清晰的中央静脉、汇管区和肝索的结构,未见肝细胞水肿,未见纤维条索形成;第16周,即停止腹腔注射橄榄油第4周时肝索结构正常,出现肝细胞水肿,但未发生气球样变。CCl4腹腔注射4周的模型组大鼠出现显著的肝脏炎症反应,肝细胞气球样变性,肝细胞坏死;8周的模型组大鼠正常肝小叶破坏,弥漫的肝细胞脂肪变性,桥接纤维化,炎细胞浸润;12周的模型组大鼠纤维结缔组织增生,假小叶形成;16周的模型组大鼠经4周的恢复,肝纤维化程度改善,纤维结缔组织增生减少,纤维间隔变窄(见图1)。
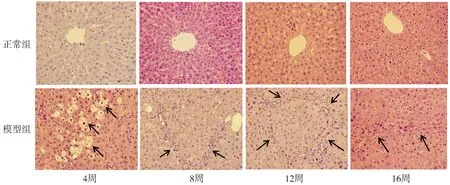
图1 各组大鼠肝组织HE染色 (×400)Figure 1 HE staining of liver tissues of rats in each group (×400)
2.2 各组大鼠血清IL-2测定结果
与正常组同期比较,CCl4腹腔注射第4,8,12和16周模型组大鼠血清IL-2水平均显著降低(P<0.01);模型组大鼠血清IL-2水平从第4周开始降低,之后随造模时间延长逐渐下降,至第12周造模成功时血清IL-2水平最低,与第4周和8周比较差异有统计学意义(P<0.001或=0.021),造模结束后第16周IL-2水平较第12周升高(P=0.045,见表1,图2)。
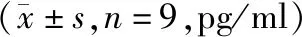
表1 各组大鼠IL-2水平比较Table 1 Comparison of serum IL-2 level of rats at different time points between two
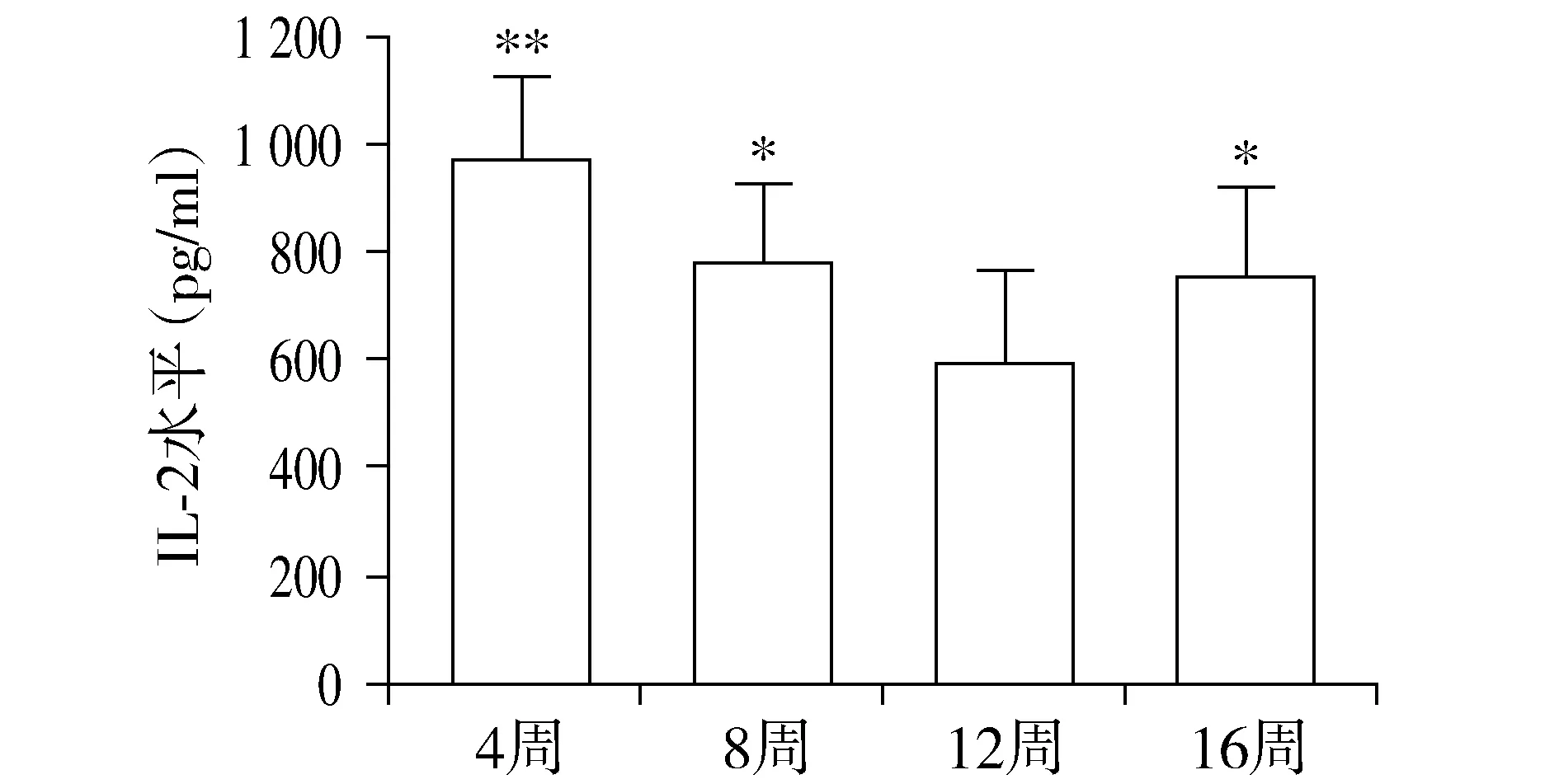
不同时间比较,F=8.338,P<0.001;与模型组12周比较,*P<0.05,**P<0.01图2 模型组不同时间点大鼠血清IL-2水平Figure 2 Serum IL-2 of rats in model group at different time points
2.3 各组大鼠肝组织α-SMA蛋白表达结果
α-SMA免疫组化染色及平均光密度分析显示,第4,8,12和16周正常组大鼠仅于小动脉和小静脉有少量α-SMA表达(见图3)。与正常组同期比较,第4,8,12和16周模型组大鼠肝组织α-SMA表达量均显著升高(P<0.01),4周模型组大鼠气球样变性的肝细胞可见α-SMA表达;8周模型组大鼠在汇管区和纤维间隔处α-SMA呈阳性表达;12周模型组大鼠在汇管区和纤维间隔可见大量α-SMA强阳性表达,并扩散到门静脉区域,其表达量较第4周和第8周均明显升高(均P<0.001);16周的模型组大鼠经4周的恢复,α-SMA表达量较第12周减少(P<0.001,见表2,图4)。
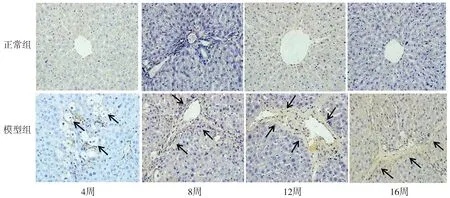
图3 免疫组化法检测肝组织α-SMA蛋白表达 (×400)Figure 3 The expression of α-SMA protein in liver tissues by immunohistochemistry (×400)
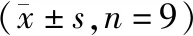
表2 各组大鼠肝组织α-SMA蛋白的表达Table 2 Expression of α-SMA in liver tissue of rats in each
2.4 各组大鼠脾脏Th1细胞比例测定结果
与正常组同期比较,CCl4腹腔注射第4,8,12和16周模型组大鼠脾脏Th1细胞比例均显著降低(P<0.01);模型组大鼠脾脏Th1细胞比例从第4周开始降低,之后随造模时间延长逐渐下降,至第12周造模成功时脾脏Th1细胞比例最低,与第4周和8周比较差异有统计学意义(P=0.001,0.017),造模结束后第16周脾脏Th1细胞比例较第12周升高(P=0.046,见表3,图5,6)。
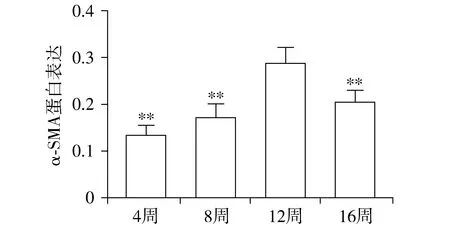
不同时间比较,F=44.794,P<0.001;与模型组12周比较,**P<0.01图4 模型组不同时间点大鼠肝组织α-SMA表达结果Figure 4 Expression of α-SMA in liver tissue of rats in model group at different time points
表3 各组大鼠脾脏Th1细胞比例测定结果Table 3 Results of Th1 cell ratios of spleen of rats in each
2.5 各组大鼠肝组织α-SMA蛋白与Th1细胞及IL-2的相关性
本实验结果显示,模型组大鼠肝脏α-SMA蛋白与脾脏Th1细胞比例呈显著负相关(r=-0.575,P<0.01),α-SMA蛋白与外周血IL-2水平呈显著负相关(r=-0.608,P<0.01)。
不同时间比较,F=4.543,P<0.05;与模型组12周比较,*P<0.05,**P<0.01图5 模型组不同时间大鼠脾脏Th1细胞比例Figure 5 The ratio of Th1 cells of spleen of rats in each model group
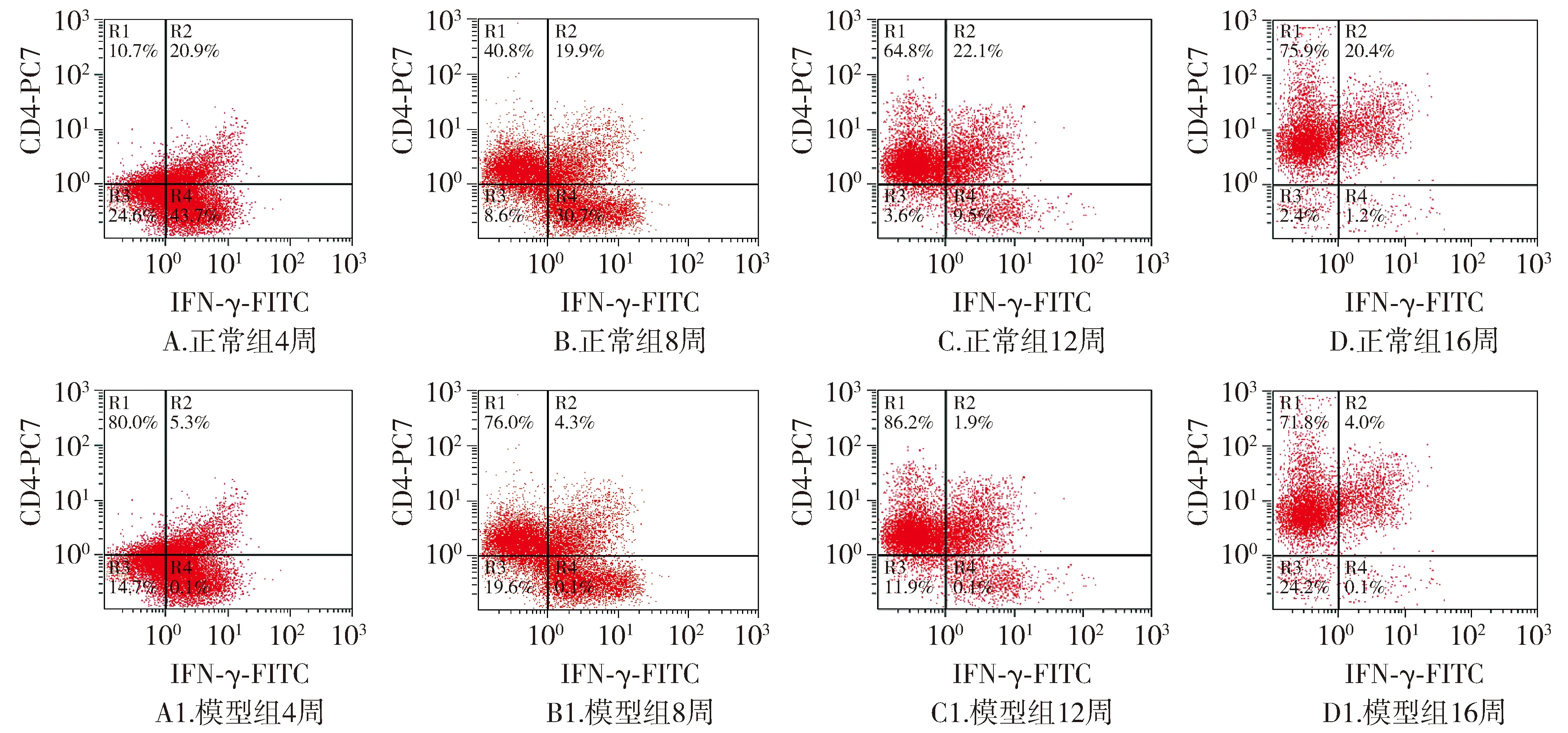
图6 各组大鼠脾脏Th1细胞比例流式图Figure 6 Th1 cell ratio in spleens of rats in each group by flow cytometry
3 讨论
CCl4诱导肝纤维化模型是一种经典的造模方法,其致病机制是CCl4被肝细胞摄取后,促进大量自由基产生和脂质过氧化损伤,导致肝细胞变性、坏死,肝功能破坏[7]。CCl4造模法能模拟人类肝纤维化的病理变化,而且停药后有自愈倾向[8]。CCl4腹腔注射给药可以制备不同分期肝纤维化模型[9],因此,本实验采用CCl4腹腔注射方法制备肝纤维化模型,并观察其停止注射后4周的病理变化。结果表明,50%CCl4橄榄油溶液注射4周后,模型组大鼠出现显著的肝脏炎症反应,属于肝损伤早期;8周后,形成桥接纤维化;12周后,形成了典型的肝纤维化病理改变。而停止CCl4腹腔注射后经过4周的自然恢复,模型组大鼠肝纤维化程度改善,纤维结缔组织增生减少,属于肝纤维化恢复期。
肝纤维化是一个涉及细胞、细胞因子、细胞外基质(extracellular matrix,ECM)等多个复杂因素的病理生理过程[10]。肝星状细胞(hepatic stellate cells,HSC)是产生ECM的主要细胞,HSC转化为肌成纤维细胞后合成与分泌Ⅰ型胶原等ECM成分,从而导致肝纤维化形成[11]。目前认为,早期肝纤维化是可以逆转的。实验性肝纤维化中去除肝损伤因素后,肝纤维化可逐渐逆转[12],而肝纤维化恢复期的主要机制以HSC凋亡为主[13]。Th1细胞是CD4+T淋巴细胞中的一类亚群,主要分泌IFN-γ、IL-2等细胞因子。研究表明,IFN-γ可以通过下调热休克蛋白70对HSC产生促凋亡作用,从而发挥抗纤维化作用[14]。目前已知外源性IL-2可以通过促进肝脏调节性T细胞反应而抑制肝纤维化[15],内源性IL-2在肝纤维化形成与逆转中的作用尚未阐明。而Th1细胞在肝纤维化形成中的作用仍然存在争议。Gu等[16]采用腹膜内注射20%CCl4橄榄油溶液制备小鼠肝纤维化模型,结果显示肝纤维化小鼠脾脏Th1细胞比例较正常组明显升高,提示Th1细胞在肝纤维化形成中起促进作用。而Shi等[17]采用皮下注射50%CCl4橄榄油溶液制备大鼠肝纤维化模型,结果显示肝纤维化大鼠Th1细胞比例较正常组明显下降。这种差异可能与实验动物及造模方法不同有关。因此,肝纤维化机制研究需要采用不同的实验模型和方法,以排除模型特异性的影响。本研究采用50%CCl4橄榄油溶液腹腔注射制备肝纤维化大鼠模型,结果显示模型组大鼠脾脏Th1细胞比例与血清IL-2水平在CCl4注射后肝损伤早期即开始明显下降,之后随着CCl4注射时间的延长以及肝纤维化程度逐渐加重,Th1细胞比例与血清中IL-2水平持续下降,直至第12周末肝纤维化形成时降至最低。而模型组大鼠肝组织α-SMA蛋白表达从第4周开始持续升高,第12周最高。因为α-SMA蛋白与脾脏Th1细胞比例及外周血IL-2水平呈显著负相关,提示在CCl4诱导大鼠肝纤维化进展期,脾脏Th1细胞比例与外周血IL-2水平持续下降,对HSC活化的抑制作用减弱,从而导致肝纤维化的发生发展。本研究结果与Shi等[17]的结果一致,可能与实验动物种类及实验试剂浓度相同有关。此外,本实验结果显示,大鼠肝纤维化恢复期α-SMA表达量较第12周明显减少,而脾脏Th1细胞比例和血清IL-2水平明显升高,肝纤维化程度明显减轻,提示肝纤维化恢复期Th1细胞及其细胞因子IL-2升高,使活化的HSC减少,促进肝纤维化逆转。而IL-2是否可以促进HSC凋亡,则需要体外实验进一步验证。
综上所述,本实验采用CCl4诱导大鼠肝纤维化,结果表明在肝纤维化进展期与恢复期,Th1细胞、IL-2均与HSC活化密切相关,通过对HSC活化的影响参与肝纤维化的发生发展及自发逆转过程,为阐明肝纤维化的免疫机制奠定了基础。
