长链非编码RNA AC005154.6抑制前列腺癌PC-3细胞增殖和迁移的机制
2019-02-11李建新邓全红
张 磊,朱 文,李建新,王 广,邓全红
(荆门市第二人民医院泌尿外科,荆门 448000;*通讯作者,E-mail:qhdengjm@163.com)
前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤之一,治疗主要采用手术切除、放疗、内分泌等方法,但前列腺癌患者的预后仍不理想[1]。前列腺癌的发生、发展涉及遗传学、表观遗传学等多层面的病理过程,尽管近年来的研究取得了一定进展,然而前列腺癌的发生机制仍不明确[2]。长链非编码RNA(long-chain non-coding RNA,lncRNA)是非编码RNA的重要组成部分,是一类转录本长度大于200个核苷酸的RNA[3]。虽然lncRNA自身不能编码蛋白,但lncRNA可通过调控下游基因的表达,影响多种细胞功能[4]。越来越多的证据表明,lncRNA在多种肿瘤组织中异常表达,lncRNA可能具有抑制或促进肿瘤发生的作用[5]。有文献报道,lncRNA的异常表达在前列腺癌的发生、发展中可能发挥分子标志物作用[6]。AC005154.6是一种新发现的lncRNA,其在前列腺癌中的表达情况及分子作用机制并不清楚。本研究通过临床标本和多种细胞系验证AC005154.6在前列腺癌组织和细胞系中的表达,观察AC005154.6对前列腺癌细胞增殖和迁移能力的影响及可能的分子机制。
1 材料与方法
1.1 组织标本
收集2016-08~2018-05荆门市第二人民医院(荆楚理工学院附属中心医院)泌尿外科前列腺癌根治性切除手术标本61例。所有患者均未行术前化疗、放疗。距离肿瘤边缘大于2 cm的组织为癌旁组织,所有标本组织学特征均经两名以上病理科医生确定。本研究经本院伦理委员会批准,患者或其家属均签署知情同意书。
1.2 细胞系和主要试剂
前列腺癌细胞系(PC-3、LNCap、C4-2B、DU-145)和正常前列腺上皮细胞(RWPE-1)购自上海生命科学院细胞所。RPMI 1640培养基、胎牛血清、KSFM培养基购自加拿大Wisent公司。携带无意义序列的重组慢病毒、携带AC005154.6序列的重组慢病毒购自上海吉玛制药有限公司。RT-qPCR试剂盒购自美国Roche公司。CCK-8试剂盒购自上海碧云天生物技术有限公司。GAPDH、c-myc、u-PA、Ephrin-A1、VEGF、TNFAIP3蛋白抗体购自美国BD公司。
1.3 细胞培养和上调
前列腺癌细胞系(PC-3、LNCap、C4-2B、DU-145)用RPMI 1640培养基(含10%胎牛血清)培养,正常前列腺上皮细胞(RWPE-1)用KSFM培养基(含10%胎牛血清)培养,常规培养在37 ℃、5% CO2培养箱中,隔天传代。取对数生长期的PC-3细胞进行感染,根据MOI=40加入病毒,感染携带无意义序列的重组慢病毒为对照组,感染携带AC005154.6序列的重组慢病毒为实验组。感染24 h后更换新鲜培养基。
1.4 实时荧光定量PCR(RT-qPCR)检测组织或细胞中AC005154.6和TNFAIP3 mRNA的表达
采用TRIzol一步法提取组织、细胞的总RNA,采用NanoDrop DN1000分析仪检测RNA的浓度和纯度,取0.5 μg RNA反转录为cDNA。选择GAPDH为内参,采用RT-qPCR试剂盒分析,RT-qPCR循环参数为95 ℃ 3 min、95 ℃ 10 s、62 ℃ 30 s、72 ℃ 30 s,40个循环,RT-qPCR引物见表1。采用2-ΔΔCt方法分析AC005154.6和TNFAIP3 mRNA的表达情况。
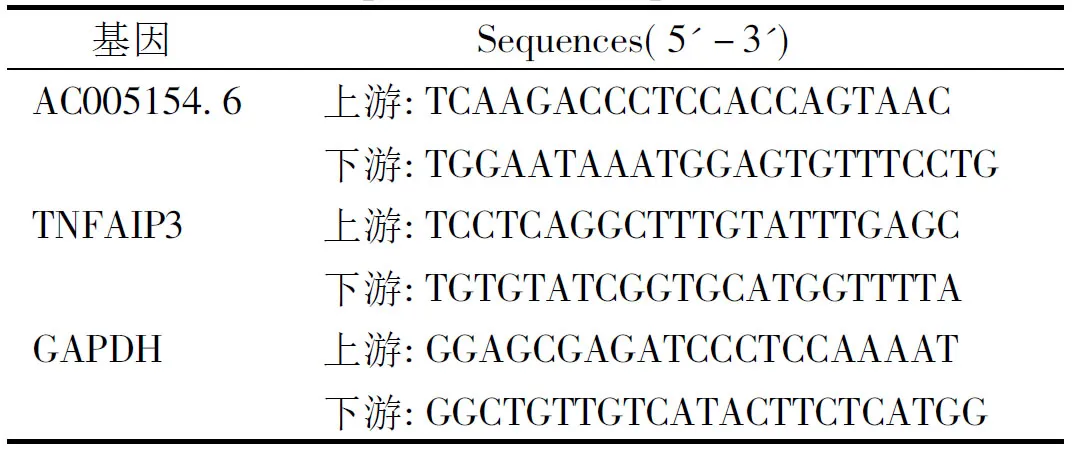
表1 RT-qPCR引物序列Table 1 Primer sequences for RT-qPCR
1.5 CCK-8法检测PC-3细胞增殖
消化、收集对数生长期的两组PC-3细胞,制成单细胞悬液后,以5×103个/孔接种96孔板,每组3个复孔,隔天换液。每24 h以CCK-8法检测细胞增殖能力,具体操作:加入20 μl/孔CCK-8稀释液,避光培养3 h,酶标仪于460 nm检测每孔的吸光度。连续检测5次,绘制细胞生长曲线。
1.6 细胞划痕实验检测PC-3细胞迁移
消化、收集对数生长期的两组PC-3细胞,制成单细胞悬液后,以7×106个/孔接种6孔板,每组4个复孔。待细胞融合度达到95%作用,采用200 μl枪头在6孔板底部进行划痕,采用磷酸盐溶液洗涤后加入无血清培养基,培养箱继续培养。分别在0 h和24 h,每孔选4个低倍视野,分析两组PC-3细胞迁移率。
1.7 Western blot检测细胞TNFAIP3及NF-κB信号通路蛋白表达
消化、收集对数生长期的两组PC-3细胞,裂解并提取总蛋白。采用12%聚丙烯酰胺凝胶电泳分离蛋白,采用PVDF膜转膜。在5%脱脂奶粉封闭中封闭1 h,采用一抗c-myc(1 ∶2 000)、GAPDH(1 ∶3 000)、u-PA(1 ∶2 000)、TNFAIP3(1 ∶2 000)、Ephrin-A1(1 ∶3 000)、VEGF(1 ∶3 000)孵育,在4 ℃下过夜。采用二抗(1 ∶5 000)在室温下孵育1 h,采用ECL发光试剂充分浸润PVDF膜,采用凝胶成像系统拍照分析。实验重复3次。
1.8 统计学分析
采用SPSS17.0统计软件处理数据,计量数据均以均数±标准差表示,组间计量数据比较均采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 AC005154.6在前列腺癌组织和癌旁组织中的表达
前列腺癌组织和癌旁组织中的表达分别为0.99±0.33和3.86±0.58,与癌旁组织比较,AC005154.6在前列腺癌组织中表达下调(t=24.31,P<0.01,见图1)。
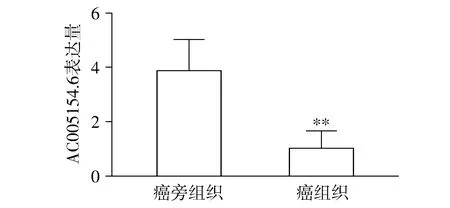
与癌旁组织比较,**P<0.01图1 AC005154.6在前列腺癌组织和癌旁组织中的表达Figure 1 Expression level of AC005154.6 in prostate cancer tissues and adjacent tissues
2.2 AC005154.6在前列腺癌细胞系和正常前列腺上皮细胞的表达
与正常前列腺上皮细胞(RWPE-1)比较,前列腺癌细胞系(Huh7、PC-3、MHCC-97H和BEL-7404)中AC005154.6均表达下调(P<0.05),PC-3细胞中AC005154.6的表达量最低(P<0.01,见图2)。
2.3 检测慢病毒的感染效率
对照组和实验组PC-3细胞中AC005154.6相对表达量分别为1.00±0.05和8.19±0.32(t=22.27,P<0.01),提示携带AC005154.6序列的重组慢病毒感染成功。
2.4 上调AC005154.6对PC-3细胞增殖能力的影响
CCK-8检测结果显示,与对照组比较,实验组的PC-3细胞从第3天开始,增殖能力显著降低(P<0.05,见图3)。
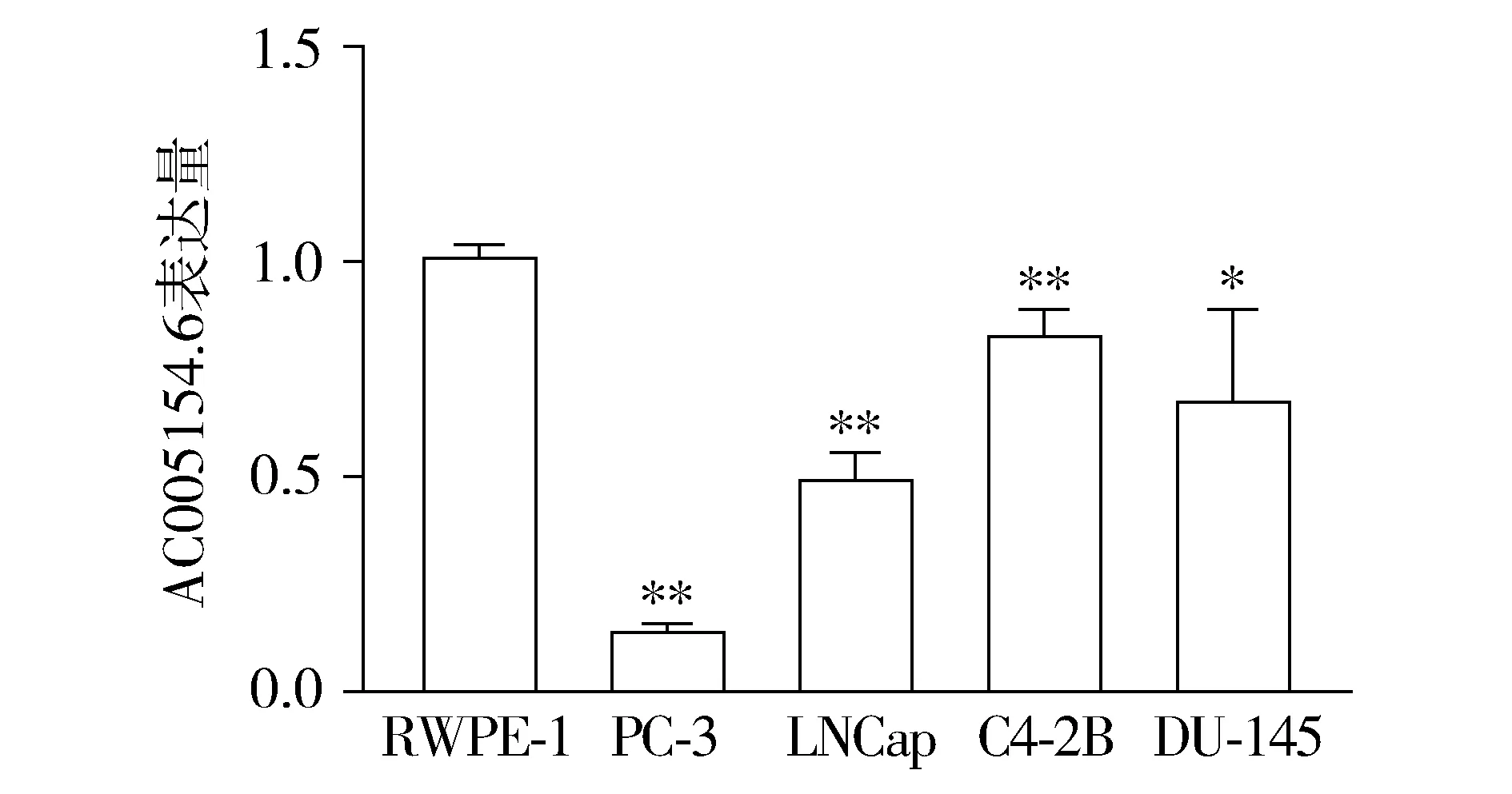
与RWPE-1细胞比较,*P<0.05,**P<0.01图2 AC005154.6在前列腺癌细胞系和正常前列腺上皮细胞中的表达Figure 2 Expression level of AC005154.6 in normal prostatic epithelium cells and prostate cancer cell lines
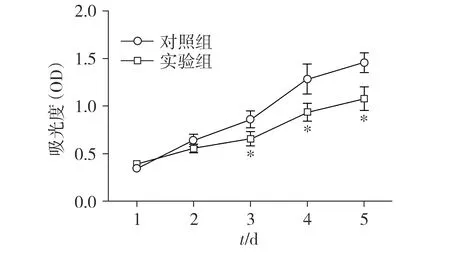
与对照组比较,*P<0.05图3 AC005154.6对前列腺癌细胞PC-3增殖的影响Figure 3 Effect of AC005154.6 on proliferation of prostate cancer cells PC-3
2.5 上调AC005154.6对PC-3细胞迁移能力的影响
对照组和实验组PC-3细胞的迁移率分别为(65.57±3.83)%和(22.49±5.56)%(t=6.38,P<0.01)。与对照组比较,上调AC005154.6后的前列腺癌细胞迁移能力被显著抑制(见图4)。

图4 AC005154.6对前列腺癌细胞PC-3迁移的影响Figure 4 Effect of AC005154.6 on migration of prostate cancer cells PC-3
2.6 上调AC005154.6对PC-3细胞中TNFAIP3 mRNA表达的影响
对照组和实验组PC-3细胞中TNFAIP3 mRNA相对表达量分别为1.00±0.04和4.70±0.28(t=13.10,P<0.01)。与对照组比较,AC005154.6可促进PC-3细胞中TNFAIP3 mRNA的表达。
2.7 上调AC005154.6对TNFAIP3蛋白及NF-κB信号通路蛋白表达的影响
Western blot结果显示,与对照组比较,上调AC005154.6后,PC-3细胞中TNFAIP3蛋白表达显著增加,NF-κB信号通路蛋白如c-myc、u-PA、Eph-rin-A1、VEGF蛋白的表达显著下降,NF-κB信号通路转导被抑制(见图5)。
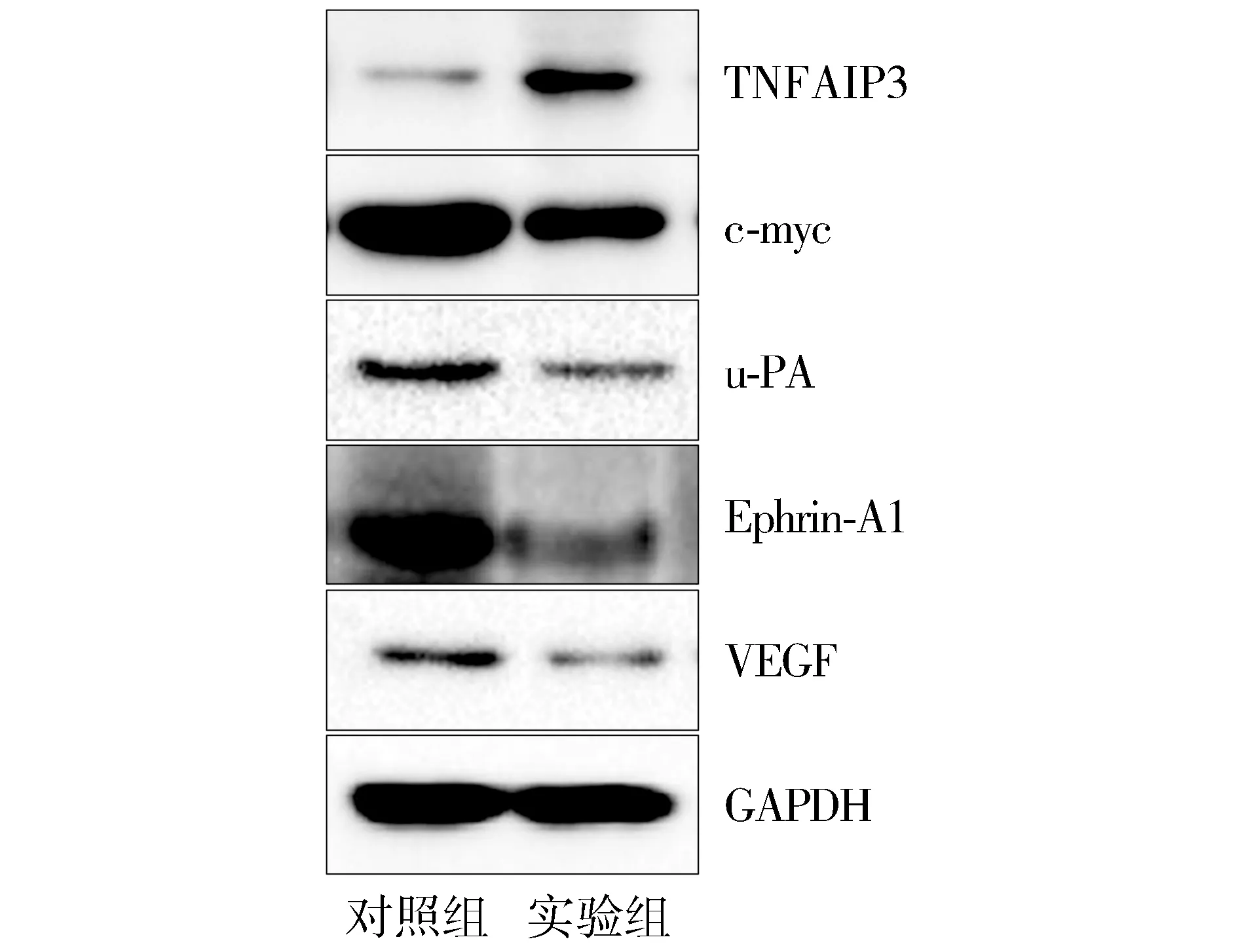
图5 Western blot检测AC005154.6对TNFAIP3及NF-κB信号通路蛋白表达的影响Figure 5 Effect of AC005154.6 on the TNFAIP3 protein and NF-κB signaling pathway protein expression by Western blot
3 讨论
长链非编码RNA(long-chain non-coding RNA,lncRNA)由于不能编码蛋白质,过去被认为是基因组转录的“噪音”[7]。近年来的研究发现,lncRNA可在转录水平、转录后水平调控基因的表达,广泛参与肿瘤的发生发展,lncRNA的异常表达可用来判断肿瘤的发展阶段、恶性程度等[8]。lncRNA已成为前列腺癌防治研究的重点。lncRNA可发挥抑癌基因或致癌基因,一些lncRNA如ANRIL、NEAT1等在前列腺癌中表达增加,可促进前列腺癌细胞的增殖和转移,其高表达提示患者预后差[9,10]。一些lncRNA如MEG3等在前列腺癌中表达降低,与前列腺癌患者的不良预后显著相关[11]。AC005154.6是一种新发现的lncRNA,其在前列腺癌中的表达情况和分子作用机制尚不明确。
本研究结果表明,AC005154.6在前列腺癌组织和细胞系中表达下调,提示AC005154.6很可能对前列腺癌的发生发展起着重要作用。通过慢病毒介导上调PC-3细胞中AC005154.6的表达,前列腺癌细胞的增殖和迁移能力明显被抑制。肿瘤坏死因子α诱导蛋白3(TNFAIP3)基因位于染色体6q23.3[12]。TNFAIP3具有抑癌基因活性,近年来被证实参与抑制肿瘤细胞的增殖、迁移、侵袭等恶性生物学行为[13-15]。本研究结果表明,上调AC005154.6后,PC-3细胞中TNFAIP3表达显著增加,表明AC005154.6可促进TNFAIP3蛋白的表达。有研究表明,TNFAIP3主要通过负调控NF-κB信号通路的转导,抑制肿瘤细胞的生长和转移[16]。Western blot结果表明,TNFAIP3表达上调后,NF-κB信号通路蛋白如c-myc、u-PA、Ephrin-A1、VEGF蛋白的表达显著降低,表明NF-κB信号通路转导被抑制,提示PC-3细胞的增殖和迁移能力可能降低。AC005154.6如何促进TNFAIP3基因并不清楚。有研究表明,lncRNA在细胞中存在如SChLAP1与miR-198之间的“竞争性结合RNA”调控作用,而miRNA具有抑制靶基因表达作用,lncRNA可通过影响miRNA的活性间接调控靶基因的表达[17,18]。AC005154.6和TNFAIP3之间是否存在一个miRNA参与调控,是我们下一步研究的方向。
总之,本研究首次发现lncRNA AC005154.6在前列腺癌组织和细胞系中表达下调,上调AC005154.6可通过促进TNFAIP3基因的表达,抑制前列腺癌细胞的增殖和迁移能力,AC005154.6为前列腺癌新型肿瘤标志物和治疗靶点的发现提供了一定可能。
