CDC6 siRNA对肝癌干细胞HepG2-CSCs增殖和迁移的影响
2019-02-11牛广旭郭晓娟杨建华刘小慧
牛广旭,郭晓娟,杨建华,刘小慧
(1邯郸市中心医院病理科,邯郸 056001;2邯郸市中心医院普外二科;*通讯作者,E-mail:Niugx-HD@163.com)
肝癌指肝脏恶性肿瘤,其中原发性肝癌是指起源于肝脏上皮或间叶组织的肝脏恶性肿瘤,是消化系统常见的恶性肿瘤[1]。肝癌的发病率和死亡率分别居第四和第三位,是我国高发且危害极大的恶性肿瘤[2]。肝癌的治疗以手术为主,放疗和化疗为辅助。肝癌患者的5年生存率很低,复发和转移是治疗失败的主要原因。原发性肝癌的病因及分子机制尚不完全清楚,严重限制了肝癌的预防和治疗[3]。
肿瘤干细胞(cancer stem cells,CSCs)又称肿瘤干样细胞或者癌干细胞,是指肿瘤组织中具有干细胞性质、能自我更新和无限增殖分化的细胞[4]。大量研究表明,实体瘤中存在罕见的干细胞亚群,对肿瘤治疗的化疗药具有耐药性,证实了肿瘤干样细胞的存在。肿瘤干细胞的高自我更新能力使其能够支持肿瘤治疗后复发和转移,是肿瘤耐药、复发和转移的根源[5]。研究显示,肝癌干细胞在肝癌的耐药和转移中具有重要作用,抑制肝癌干细胞的细胞干性能够抑制肝癌的耐药和转移能力[6]。研究和开发化疗耐药的转移性肝癌的潜在靶向药物成为肝癌治疗的热点。
细胞分裂周期蛋白6(cell division cycle 6,CDC6)是DNA复制的关键蛋白,能够调控细胞分裂周期[7]。有研究表明,CDC6在肿瘤组织中高表达,并且在肿瘤细胞的转移中有着潜在的作用,但具体机制不明[8]。本研究通过探讨siRNA干扰CDC6表达对肝癌干细胞的生物学特性的影响,有助于更深入阐明肝癌的发病机制,为肝癌的临床治疗提供实验基础。
1 材料与方法
1.1 细胞株及主要试剂
肝癌细胞株HepG2购自中国科学院细胞库。DMEM培养液(12491-015)和胎牛血清(FBS)(10099141)为美国Gibico公司产品,CDC6 siRNA转染试剂盒(SIGS0005915-4)购自广州锐博生物公司,lipofectamine 2000(11668019)购自美国Thermo公司,wnt3a兔单克隆抗体(2721T)和β-catenin兔单克隆抗体(8480T)购自美国CST公司,CDC6兔单克隆抗体(ab109315)购自美国abcam公司。
1.2 HepG2-CSCs分离培养
取复苏的HepG2细胞,加入含10% FBS的DMEM培养液,置于细胞培养箱中常规培养(37 ℃、5% CO2),正常换液和传代。免疫磁珠法分选HepG2-CSCs:取对数期的HepG2细胞,消化离心后加入100 μl缓冲液制备成细胞悬液,加入20 μl CD133免疫磁珠,孵育1 h(4 ℃),应用磁珠分选系统分选出CD133+细胞,所得CD133+HepG2即为肝癌干细胞HepG2-CSCs[9,10]。HepG2-CSCs置于含10% FBS的DMEM培养液中常规培养。
1.3 流式细胞术鉴定HepG2-CSCs
取分离的HepG2-CSCs,消化离心,然后加入100 μl缓冲液制备成细胞悬液,加入10 μl CD133-FITC抗体,4 ℃孵育1 h,离心取沉淀,PBS洗涤3次,加入300 μl PBS,上流式细胞仪检测。
1.4 细胞转染
取HepG2-CSCs细胞接种于6孔板,按照Lipofectamine 2000操作说明按比例将Lipofectamine 2000和CDC6 siRNA(对照siRNA)加入到细胞中,培养4-6 h,去除培养基,加入新鲜10% FBS的DMEM培养液,常规培养24 h,然后用于后续Western blot、CCK8和细胞凋亡检测实验。
1.5 克隆形成实验
取转染CDC6 siRNA(对照siRNA)的人肝癌干细胞HepG2-CSCs,消化离心,接种500个/孔的细胞于6孔培养板,加入含10% FBS的DMEM培养液,常规培养14 d,实时观察培养板内细胞克隆数,取细胞固定和Giesma染色,计算克隆形成率,克隆形成率=(克隆细胞数/接种细胞数)×100%。
1.6 Transwell法检测细胞迁移能力
取转染CDC6 siRNA(对照siRNA)的人肝癌干细胞HepG2-CSCs种植于Transwell小室,加入DMEM培养基(不含血清),在24孔培养板中加入含10% FBS的DMEM培养液,加Transwell小室置于培养板中培养24 h,取出小室进行细胞固定和Giesma染色,统计迁移的细胞数。
1.7 Western blot检测wnt3a和β-catenin蛋白表达
取人肝癌细胞HepG2-CSCs以及转染CDC6 siRNA和对照siRNA的HepG2-CSCs细胞,收集细胞蛋白样品,定量后取等量蛋白样品进行SDS-PAGE电泳分离、转膜,5%脱脂奶粉封闭1 h,加入1 ∶500稀释的抗体CDC6、wnt3a和β-catenin,4 ℃冰箱孵育过夜。洗涤3次,然后加入HRP标记的二抗(1 ∶5 000稀释),室温孵育1 h,洗涤后显色并拍照,进行灰度值统计分析。
1.8 统计学分析
实验数据采用SPSS19.0软件进行分析,所有实验均至少重复3次,实验数据采用平均值±标准误表示。两组间的比较采用t检验,多组间的比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 HepG2-CSCs的抗原标记表达
首先通过流式细胞术检测了分离培养的HepG2-CSCs的免疫表型。流式细胞术结果显示,CD133在HepG2和HepG2-CSCs中的表达率分别为(0.54±0.16)%和(98.82±0.95)%(见图1)。表明本研究中分离的细胞为HepG2-CSCs,可用于后续的相关实验。
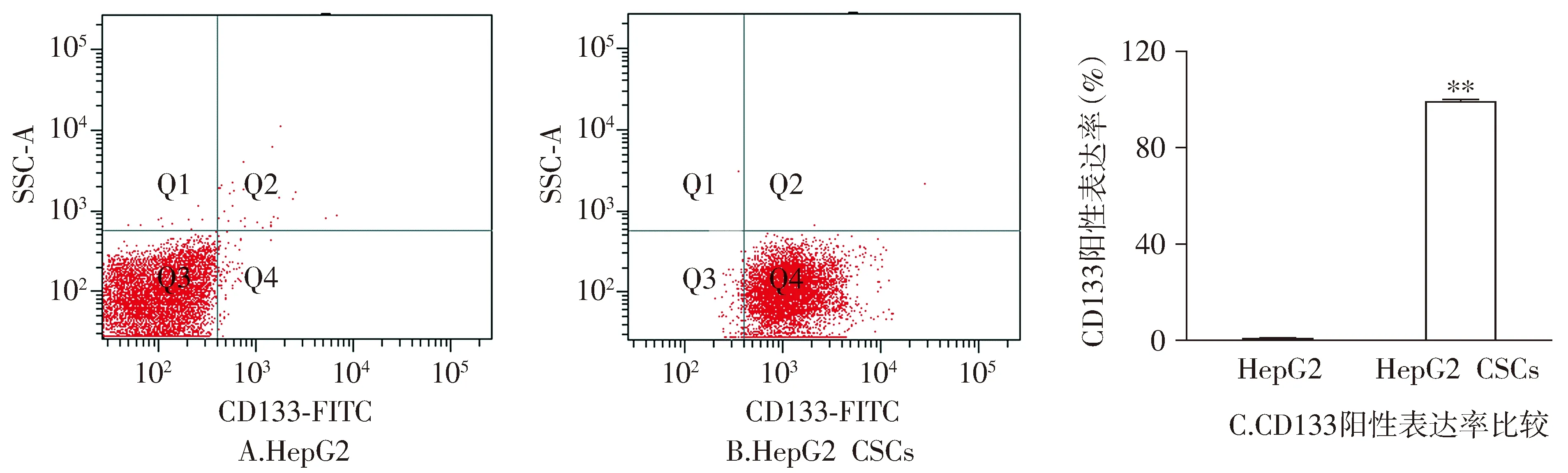
与HepG2比较,**P<0.01图1 流式细胞术检测HepG2-CSCs的免疫表型Figure 1 The cell immunotype of HepG2-CSCs by flow cytometry
2.2 CDC6在HepG2-CSCs中高表达
检测了肝癌细胞和肝癌干细胞HepG2-CSCs中CDC6蛋白表达水平,Western blot结果显示,与HepG2细胞组相比,HepG2-CSCs组CDC6蛋白表达水平显著升高(P<0.01,见图2)。
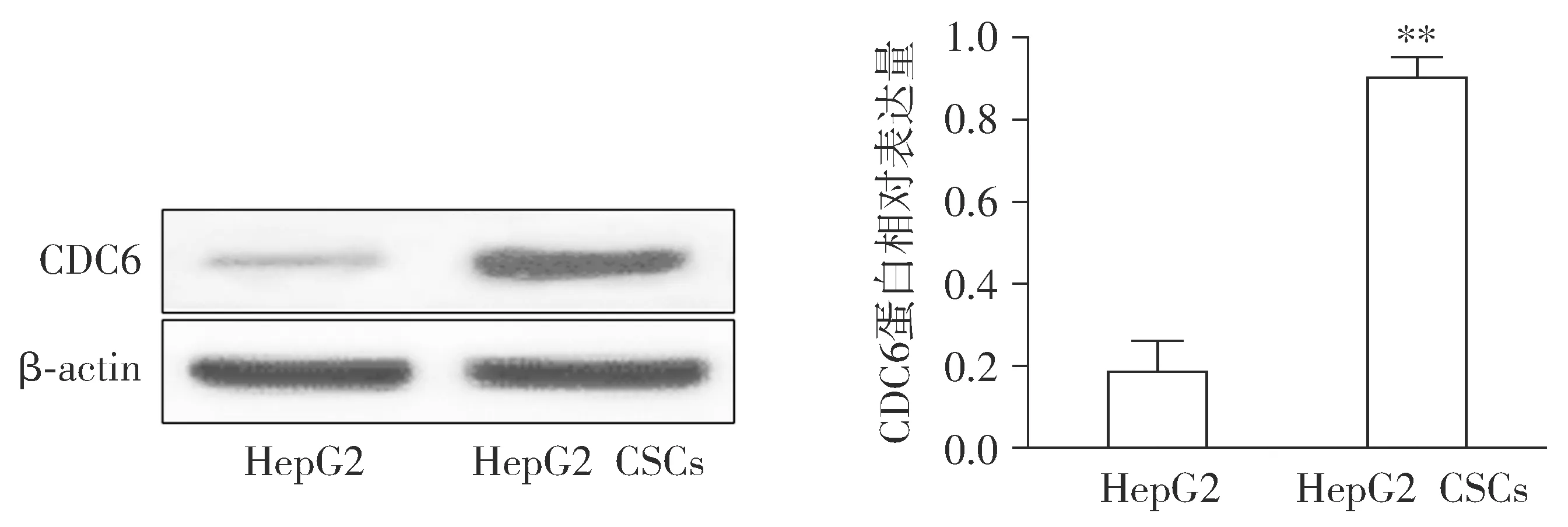
与HepG2比较,**P<0.01图2 CDC6在人肝癌干细胞HepG2-CSCs中的表达Figure 2 The expression of CDC6 in HepG2-CSCs
2.3 CDC6 siRNA抑制HepG2-CSCs克隆形成能力
CCK8检测结果显示,与对照siRNA组比较,CDC6 siRNA组HepG2-CSCs细胞克隆形成能力显著降低,差异具有统计学意义(P<0.01,见图3)。
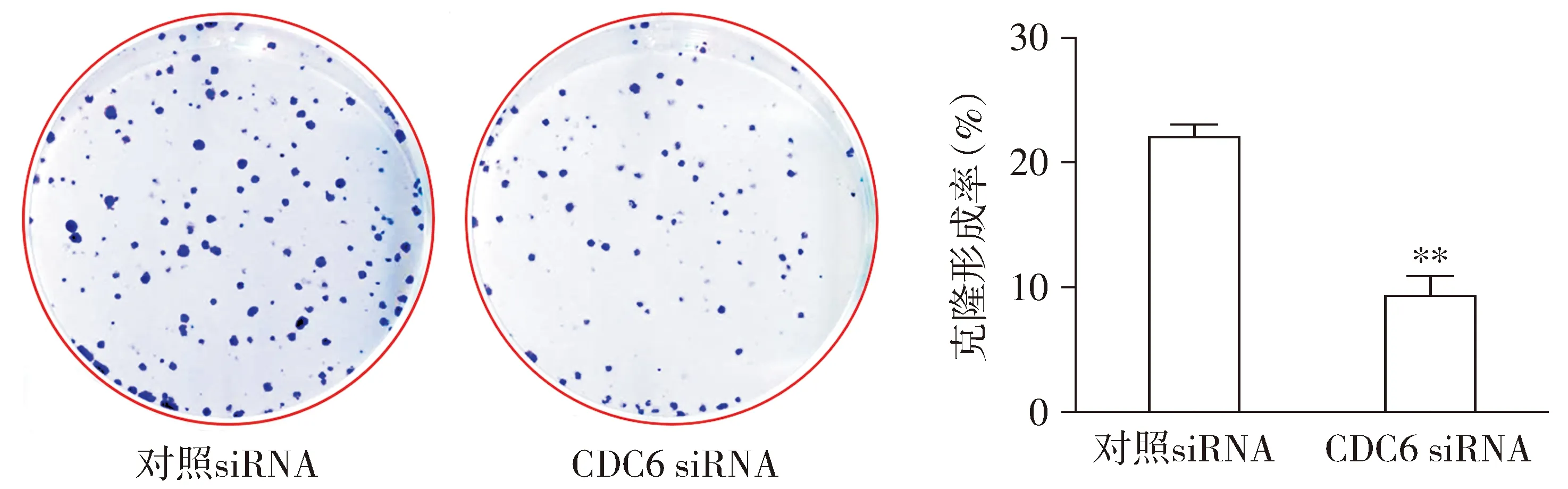
与对照siRNA比较,**P<0.01图3 CDC6 siRNA对肝癌HepG2-CSCs克隆形成能力的影响Figure 3 Effects of CDC6 siRNA on clone formation ability of HepG2-CSCs
2.4 CDC6 siRNA抑制HepG2-CSCs迁移能力
Transwell检测结果显示,与对照siRNA组比较,CDC6 siRNA组肝癌干细胞HepG2-CSCs细胞迁移数显著降低,差异具有统计学意义(P<0.01,见图4)。
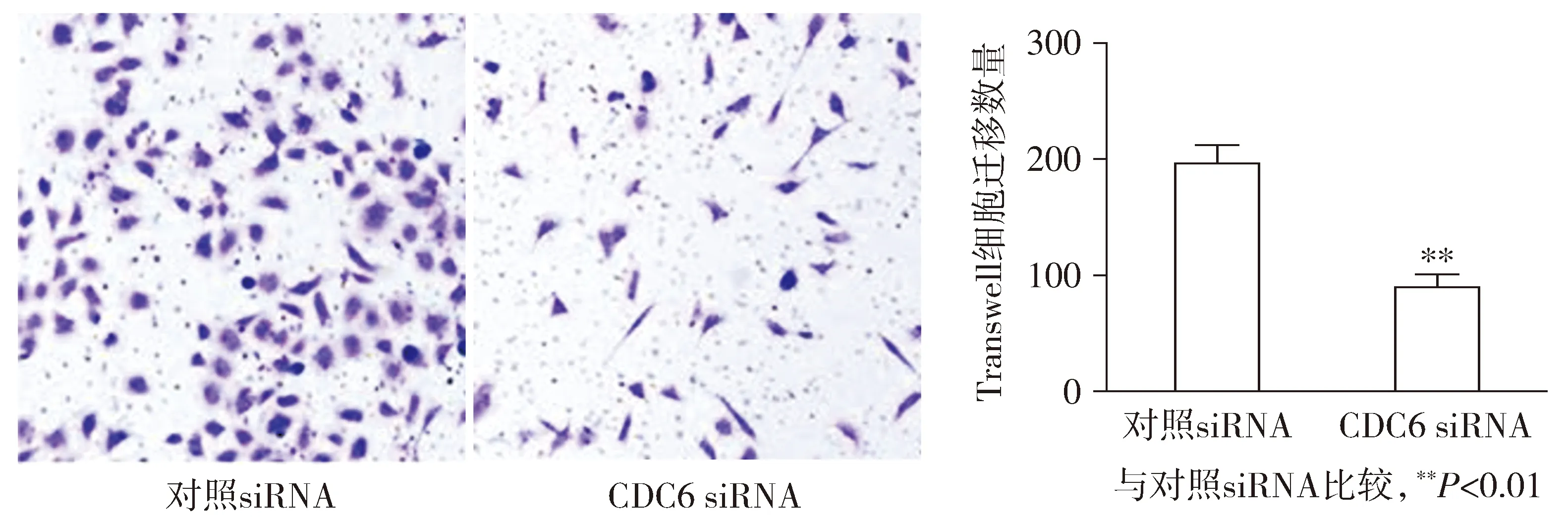
图4 CDC6 siRNA对人肝癌细胞HepG2-CSCs迁移能力的影响Figure 4 Effects of CDC6 siRNA on migration ability of HepG2-CSCs
2.5 CDC6 siRNA抑制wnt/β-catenin通路
Western blot结果显示,与对照siRNA组相比,CDC6 siRNA组细胞CDC6、wnt3a和β-catenin蛋白表达水平显著降低(P<0.01,见图5)。
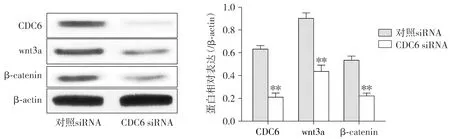
与对照siRNA比较,**P<0.01图5 CDC6 siRNA对肝癌干细胞HepG2-CSCs细胞wnt/β-catenin通路相关蛋白表达的影响Figure 5 Effects of CDC6 siRNA on the expression of wnt/β-catenin pathway-related proteins in HepG2-CSCs
3 讨论
肝胆系统恶性肿瘤(主要是肝癌和胆管癌)的全球发病率日益增加[11]。肝癌在全球所有主要恶性肿瘤中的死亡率居第三位[12]。手术切除,经皮消融和肝移植是肝癌的标准治疗方法,但这些仅适用于一小部分早期疾病患者[13]。因此,开发针对肝癌的新型治疗策略势在必行。
高复发率和异质性是肝细胞癌的两个主要特征[14]。最近的研究表明,具有自我更新和分化能力的肝癌干细胞位于肿瘤体内,是造成肝细胞癌起始、进展、抗药性和肿瘤细胞分层组织的原因[15]。此外,基于肿瘤干细胞理论,肝癌干细胞的存在可能与肝细胞癌患者的预后具有相关性。有研究显示,一些肝癌干细胞的标志物,如CD133和EpCAM的表达与肿瘤血管生成、化疗耐药以及肝癌患者总体预后差有关[16]。此外,有研究发现循环肝癌干细胞水平高的肝癌患者的复发率高于肝癌干细胞水平较低的患者[17]。因此,肝癌干细胞一些标志物的表达及其特殊性质可以作为肝癌患者潜在预后标志物和治疗靶点。
CD133是胚胎、骨髓及造血干细胞的特异性表明标记物,也是最重要的肿瘤干细胞表面标记物,已经在肺癌、肝癌和前列腺癌等肿瘤组织中得到证实[18]。有研究显示,CD133阳性表达的细胞具有强的侵袭和转移能力[19]。本研究通过免疫磁珠法从肝癌细胞株HepG2中成功分离出肝癌干细胞HepG2-CSCs,流式检测显示HepG2-CSCs表面标志物CD133的阳性表达率高达98%。研究证实了CDC6在肝癌干细胞HepG2-CSCs中高表达,CDC6 siRNA能够显著抑制HepG2-CSCs克隆形成和迁移能力,提示CDC6可能在肝癌的发生发展中发挥重要的作用。
细胞分裂周期蛋白6(cell division cycle 6,CDC6)是DNA复制的必需调节因子,并且在细胞周期中检查点机制的激活和维持中起重要作用[20]。CDC6在DNA复制的早期阶段起到调节剂的作用,它在细胞周期G1期间定位于细胞核中,组装预复制复合物以启动G1期DNA复制,在S期开始时易位至细胞质,但是相当大比例的CDC6仍然存在于细胞核中执行其他功能[21]。研究显示,CDC6与癌症的发生发展相关,CDC6可作为转录抑制因子抑制抑癌基因的转录,参与肿瘤的发生发展及预后[22]。CDC6与肝癌干细胞之间的联系还没有研究证实,基于上述研究结果和CDC6在癌症中的调控作用,我们推测CDC6可能影响肝癌干细胞的生物学特性从而影响肝癌的耐药和转移。本研究通过siRNA干扰CDC6的表达,证实CDC6 siRNA能够显著抑制肝癌干细胞HepG2-CSCs的克隆形成能力,并且能够抑制其迁移能力。证实了CDC6与肝癌干细胞克隆形成和迁移能力之间的联系。
Wnt基因最早在果蝇中被发现并作用于胚胎发育,经典Wnt信号通路又称Wnt/β-catenin信号通路,是一条在生物进化中极为保守的信号转导通路[23]。在正常的细胞中,β-catenin与E-cadherin形成蛋白复合体,在维持细胞的黏附、抑制细胞的迁移中发挥重要作用[24]。当细胞外Wnt信号分子与其受体结合,β-catenin在胞质中积累起来,积累的β-catenin转移到核内,从而激活一系列基因的表达,从而调控细胞的分化、增殖和迁移等生物过程[25]。大量研究显示,Wnt/β-catenin信号通路不但参与干细胞自我更新的调节,并能通过多种方式调控基因的表达而作用于不同分化阶段的干细胞[26-28]。本研究推测CDC6可能通过Wnt/β-catenin信号通路影响肝癌干细胞的生物学特性。本研究显示,CDC6 siRNA在抑制肝癌干细胞HepG2-CSCs克隆形成和迁移的同时,能够显著抑制细胞wnt3a和β-catenin的蛋白表达水平,进一步证实了先前的推测。但是CDC6是如何调控Wnt/β-catenin信号通路还需要进一步的实验来证实。
综上所述,本研究证实了CDC6在肝癌干细胞HepG2-CSCs中高表达,CDC6 siRNA能够抑制HepG2-CSCs克隆形成和迁移能力,并且可以显著抑制肝癌干细胞Wnt/β-catenin信号通路,其作用机制还需要进一步研究。本课题研究有助于阐明CDC6在肝癌干细胞中的作用,为肝癌的靶向治疗提供实验基础。
