移植同种异体脂肪干细胞对兔椎间盘退变早期的干预实验研究
2019-02-10白亦光杨泽龙罗栩伟肖东琴
白亦光,刘 康,杨泽龙,罗栩伟,林 涛,肖东琴,冯 刚*
(1川北医学院第二临床医学院,南充市中心医院骨科,南充 637000;2川北医学院第二临床医学院,南充市中心医院组织工程与干细胞研究所;*通讯作者,E-mail:fenggangncch@163.com)
椎间盘退行性变(intervertebral disc degeneration,IDD)是引起下腰部疼痛症状常见的原因,是中老年人的常见病、多发病。具体表现为椎间盘组织含水量逐渐缓慢减少,髓核组织内部张力进行性下降,弹性消失,椎间盘高度降低,纤维环生理结构紊乱,产生向心性小裂隙。其确切的病理生理机制到目前为止尚不十分清楚,很多学者认为是生物介导、年龄增长、椎间盘内部营养失衡等多种因素造成的结果。由于椎间盘是体内最大的无血管组织,它的细胞处于一种较为“恶劣”的微环境,髓核组织仅靠上下的软骨终板血管弥散作用获取少量的营养,而纤维环表层的外周细胞通过邻近的韧带内的血管获取营养,故而椎间盘一旦开始发生退变后较难自行恢复。随着病程的进展,终板发生钙离子沉积骨化,营养的提供(如葡萄糖、氧分等)也变得越来越受限[1],进而髓核组织内细胞外基质含量减少,髓核细胞活性降低,最终椎间盘功能丧失。
脂肪干细胞(bone marrow mesenchymal stem cells,ADSCs)是一种在组织工程领域应用非常广泛的干细胞,免疫研究表明[2],ADSC能抑制T细胞、NK细胞和B细胞的活性,同种异体移植的ADSC也未引起宿主的免疫反应,由于其本身的多向分化潜能及较低的免疫原性使之成为IDD研究中的理想种子细胞。很多实验在选择种子细胞移植均是在椎间盘退变中期进行[3],本实验将脂肪干细胞进行造模时的同期移植,以观察在椎间盘退变发生早期,脂肪干细胞在椎间盘内的生存情况以及对椎间盘退变过程的作用。
1 材料与方法
1.1 实验动物与材料、仪器
健康2周龄日本大耳白兔4只,雌雄不限,体质量0.5 kg左右。5月龄日本大耳白兔(川北医学院动物中心提供)27只,雌雄不限,体质量均约(2.5±0.25)kg。由川北医学院实验动物中心提供;CO2孵箱购于美国Theromo公司;甲苯胺蓝、番红O染液;倒置相差显微镜购于日本Nikon公司;超净工作台购于美国Airtech公司;Ⅱ型胶原免疫组化试剂盒购于美国Chondrex公司。
1.2 动物模型的建立
用21G针头在椎间盘纤维环的中点刺入纤维环5 mm,回抽针筒至3 ml维持5 s,抽取髓核组织,吸出髓核组织大约湿重5-8 mg[4]。
1.3 ADSC的分离培养与鉴定
取实验用2周龄幼兔一只,耳缘静脉空气栓塞致死;用酒精擦拭取腹股沟处(或背部),无菌条件下取腹股沟处(或背部)脂肪;酒精泡30 s,PBS洗两次,置入无菌培养皿中;在无菌操作台剪去血管等异物组织,尽量清除干净,充分剪碎脂肪(需要不断剪切组织约30 min以上),转移至50 ml离心管;加入等体积0.1% Ⅱ型胶原酶于离心管中,置于37 ℃水浴锅45 min(每5 min摇晃一次);2 000 r/min离心10 min,倾倒上层组织液,沉淀用含10%胎牛血清的DMEM培养液重新悬浮,接种于T75培养瓶;置于37 ℃、5%CO2、饱和湿度的培养箱中培养。24 h后更换培养基,以后每3 d换一次液,每日在倒置显微镜下观察细胞形态及生长情况;当贴壁细胞达到90%融合时,用0.25%的胰蛋白酶消化,1 ∶3比例传代培养;将原代ADSC按1×104个/ml接种至含盖玻片的6孔培养板中进行细胞爬片。培养至细胞基本长成单层时取出盖玻片,光镜下观察细胞大体形态。
1.4 ADSC的移植
取5月龄日本大耳白兔27只(川北医学院实验动物中心提供),雌雄不限,随机分为3组:正常对照组(NC组,n=9),ADSC移植组(ADSC组,n=9),DMEM培养基组(DMEM组,n=9)。采用NC组作为阳性对照,ADSC组作为实验组,DMEM组作为阴性对照组。
除正常组外其余两组动物采用髓核穿刺抽吸法来建立退变动物模型[3],造模完成后,将制备好的约30 μl含有ADSC 1×106的细胞悬浊液经带有29G针头的1 ml胰岛素注射器穿刺移植入ADSC组动物的椎间盘中心,使用组织黏合剂封堵穿刺孔,防止细胞流出;DMEM组注入30 μl不含细胞的DMEM培养液。缝合肌肉、皮肤组织,伤口消毒后送回动物房;术后连续3 d肌注青霉素预防感染。
1.5 检测指标
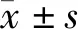
1.5.2 病理组织学染色观察 术后4,8,12周,耳缘静脉注射空气5 ml栓塞处死动物,暴露上下椎板及椎间盘,放入10%固定脱钙液中固定脱钙1周。石蜡包埋椎间盘组织,组织切片取正中矢状位,厚度5 μm。实验椎间盘组织切片进行HE染色和番红O染色。
HE组织染色步骤如下:脱蜡至水;苏木素染色15 min;自来水冲洗至组织反蓝;1%盐酸乙醇分色3 s;伊红液复染1 min;梯度酒精脱水,二甲苯透明,中性树脂封片;根据染色结果按照病理组织学分级量表进行评分(见表1),退变椎间盘的组织学分级按照4个标准评分,正常椎间盘4分,严重退变椎间盘12分,小数点后一位表示对椎间盘整体结构的评价。
番红O染色(主要用于观察髓核组织蛋白多糖)步骤如下:脱蜡至水;PBS冲洗后4%多聚甲醛室温固定30 min,PBS冲洗3次;苏木素染色10 min,水洗;0.2%亮绿染色10 min,PBS冲洗3次;0.1%番红O染色10 min,PBS冲洗3次;1%盐酸酒精分化液3 s,烘干后树脂封片后镜下观察。

表1 病理组织学分级量表Table 1 Histopathological grading scale
1.5.3 免疫组织化学染色和免疫荧光染色 collagen Ⅱ免疫组织化学染色检测参照Chondrex公司collagen Ⅱ免疫组织化学染色试剂盒说明,步骤如下:将石蜡组织切片脱蜡至水;用PBS冲洗后4%多聚甲醛室温固定30 min,行免疫组化检测;2%牛透明质酸酶封闭30 min,PBS冲洗3次;3%H2O2封闭10 min,PBS冲洗3次;Ⅱ型胶原一抗(小鼠抗兔,浓度1 ∶300)封闭4 ℃过夜,PBS冲洗3次;添加二抗(山羊抗小鼠,浓度1 ∶500)在室温下孵育1 h,PBS冲洗3次;DAB显色1 h,PBS冲洗3次,中性树脂封片,显微镜下观察。
1.5.4 real time-PCR检测 手术干细胞移植后4,8,12周后处死动物,游离出椎间盘,液氮下环境下研磨提取总RNA,逆转录为cDNA,进而开始collagen Ⅱ、蛋白聚糖(aggrecan)、GAPDH基因表达RT-PCR检测。各蛋白基因上下游引物见表2。椎间盘组织RNA提取采用Trizol试剂盒,提取组织RNA时,每50-100 mg组织用1 ml Trizol试剂对组织进行裂解;预变性94 ℃ 180 s;变性94 ℃ 10 s;退火58 ℃ 15 s;延伸72 ℃ 7 s。

表2 引物序列Table 2 Primer sequences
1.6 统计学方法
2 结果
2.1 MRI %ST2WI值检测结果
ADSC组和正常对照组%ST2WI值变化趋势类似,两者各时间点组间差异无统计学意义,提示二者均能有效地维持%ST2WI值;正常对照组、ADSC组在术后4,8,12周时%ST2WI值明显高于DMEM组(P<0.05,见图1)。提示ADSC组能有效维持髓核组织内的含水量。
2.2 大体观察
正常对照组纤维环完整有序,髓核组织为透明凝胶状态,椎体边缘未见增生骨赘;ADSC组提示纤维环纹理维持良好,髓核组织状态基本正常。DMEM组出现明显退变,椎体边缘出现骨赘,纤维环纹理紊乱,髓核组织变性,与椎间盘界限模糊(见图2)。
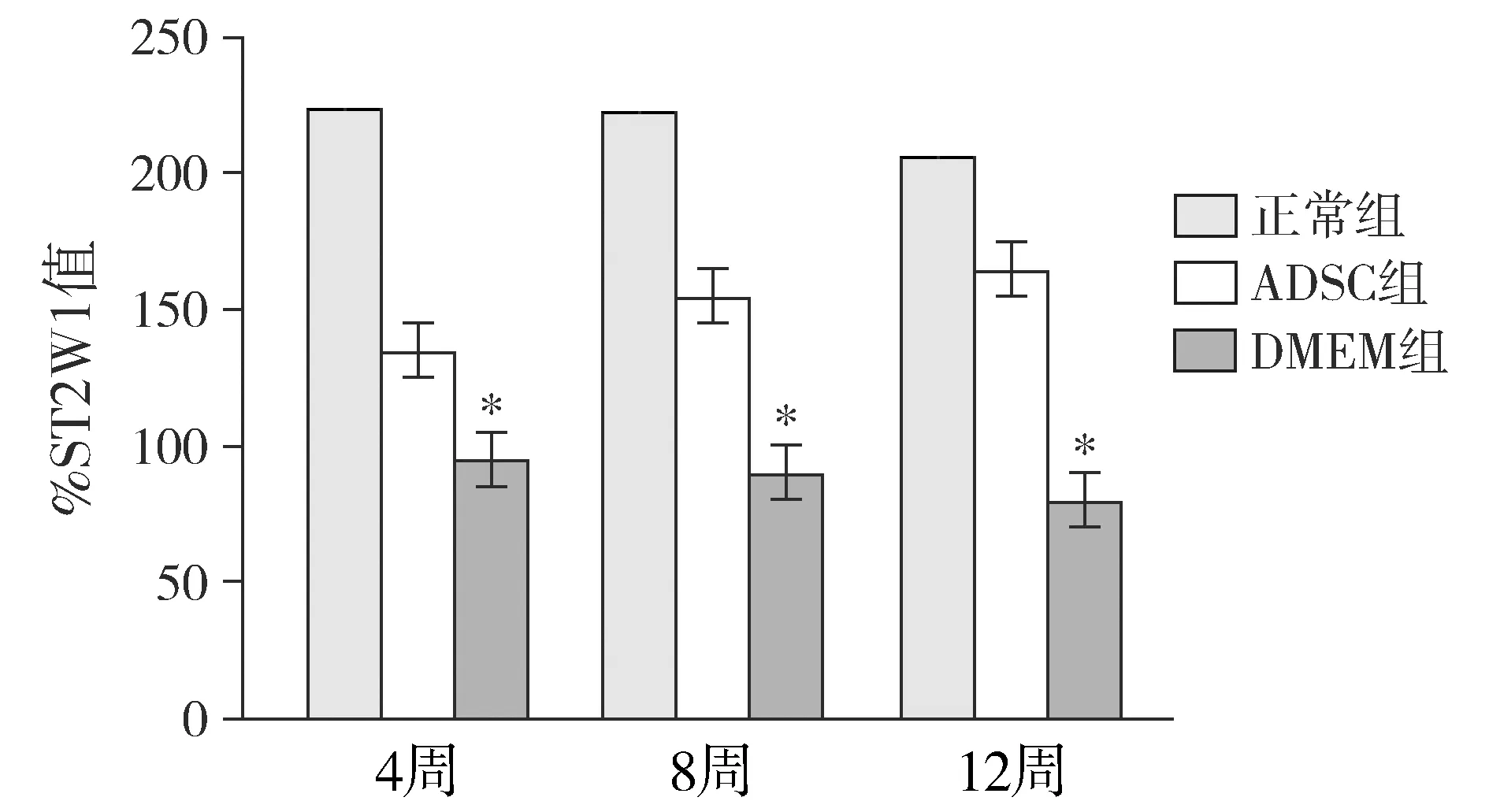
与ADSC组相比,*P<0.05图1 术后各个时间点%ST2WI值变化Figure 1 Changes of %ST2WI at different time points after operation
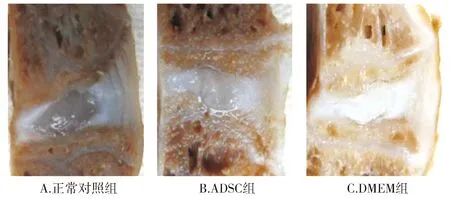
图2 术后12周椎间盘矢状面大体观察Figure 2 General observation of sagittal plane of intervertebral disc 12 weeks after operation
2.3 组织切片染色结果及组织学评分
NC组HE染色和番红O染色结果显示髓核组织成椭圆形,可见较多细胞及细胞外基质,边界清晰完整,周围纤维环层次分明,无明显紊乱,髓核组织显示均质红染,collagenⅡ免疫组化染色结果显示髓核组织区域可见广泛棕黄色collagenⅡ阳性表达,边界清晰完整,周围纤维环层次分明。
ADSC组HE染色和番红O染色结果显示髓核组织区域可见大量细胞团块及明显的细胞外基质,髓核组织显示均质红染,与纤维环边界清晰,纤维环轻度紊乱,术后12周可见细胞团明显增多,细胞外基质明显丰富,纤维环层次仍表现为轻度紊乱,collagenⅡ阳性表达,细胞外基质丰富,纤维环显示轻度紊乱。
DMEM组术后12周时HE染色和番红O染色椎间盘显示出髓核缺如或空洞,显示出明显的退变征象;collagenⅡ阳性表达较为局限(见图3)。
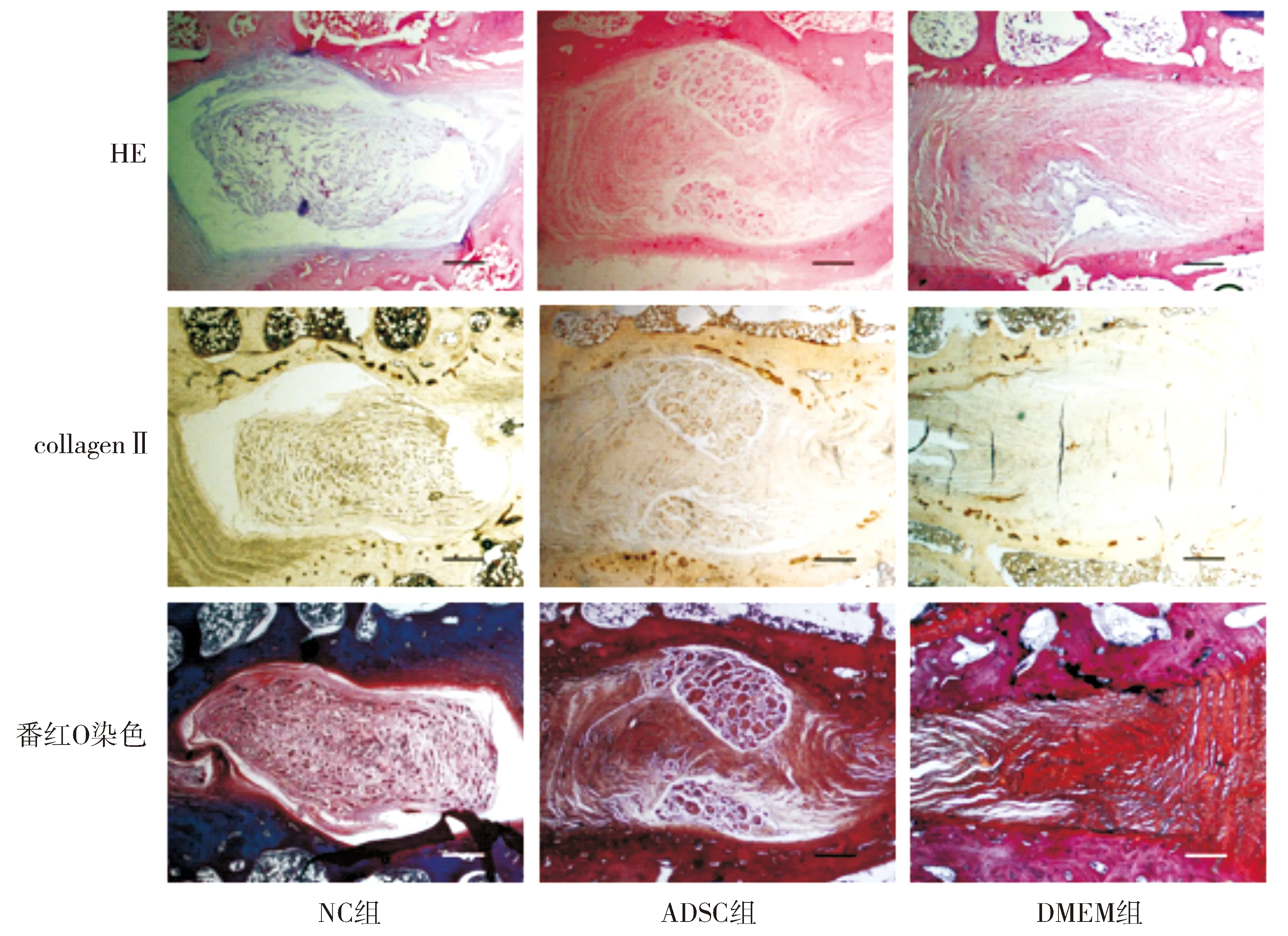
图3 术后12周椎间盘组织的HE染色、collagenⅡ和aggrecan免疫荧光染色结果 (×40, bar=300 μm)Figure 3 Results of HE staining, immunofluorescence staining of collagenⅡ and aggrecan in discs 12 weeks after operation (×40, bar=300 μm)
根据的组织学评分量表,各时间点椎间盘的退变程度的评分见表3。ADSC组和DMEM组退变分数明显高于正常对照组(P<0.05);ADSC组退变分数明显低于DMEM组(P<0.05);ADSC组与正常对照组之间比较差异没有统计学意义。
2.4 real-time PCR测定结果
正常对照组collagen Ⅱ和aggrecan mRNA的表达水平基本趋于稳定。术后12周,real-time PCR检测显示DMEM组collagen Ⅱ和aggrecan mRNA的表达明显低于其他组(P<0.05);ADSC组和正常对照组collagen Ⅱ和aggrecan mRNA的表达差异没有无统计学意义(P>0.05,见图4)。
表3 各组不同时间点退变分数的动态变化Table 3 Scales of degeneration at different time points after
与其他组相比有显著差异,*P<0.05
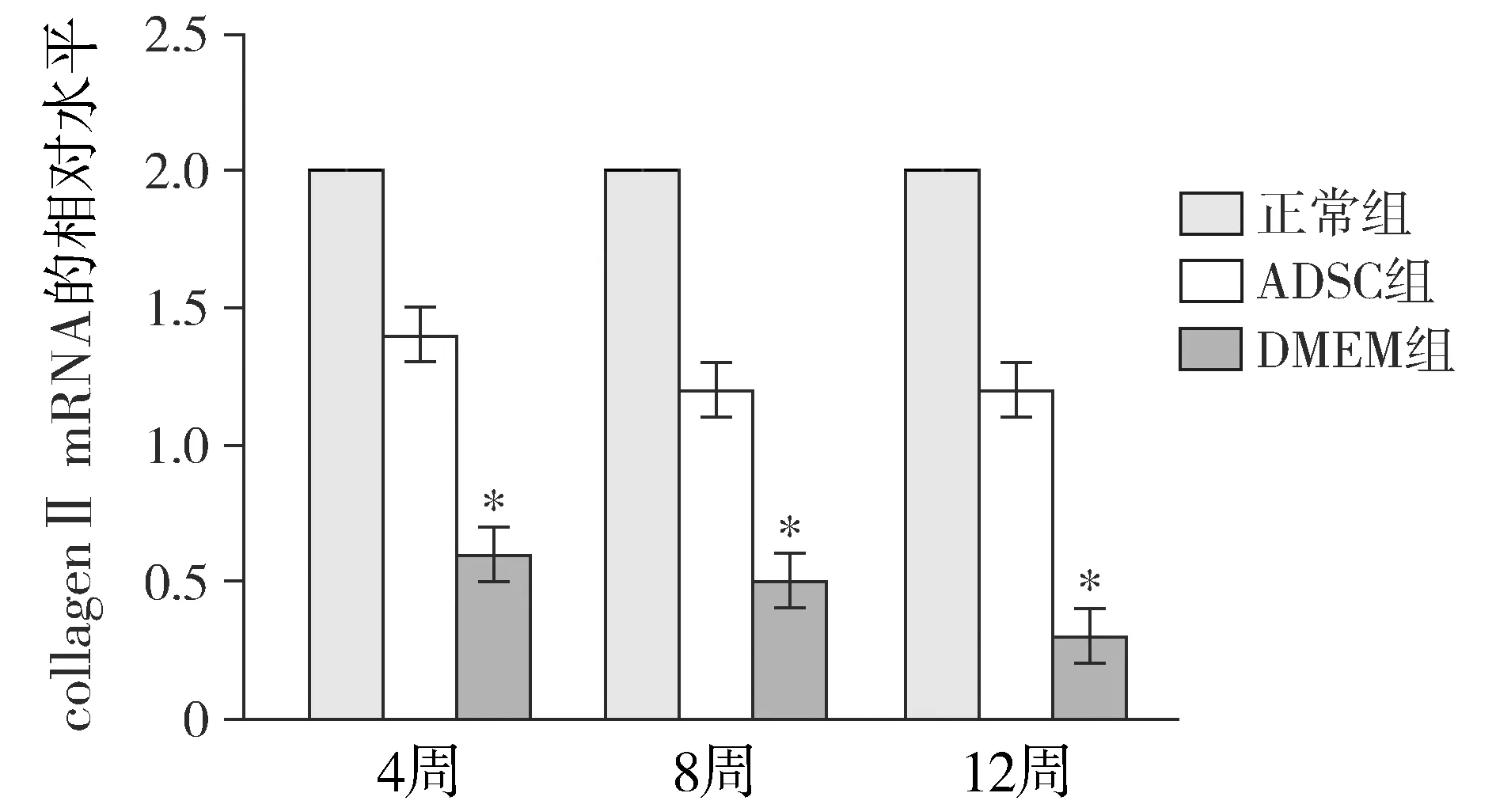
与其他两组比较,*P<0.05图4 各组不同时间点collagen Ⅱ mRNA的相对水平Figure 4 Relative expression level of collagenⅡ mRNA at different time points in each group
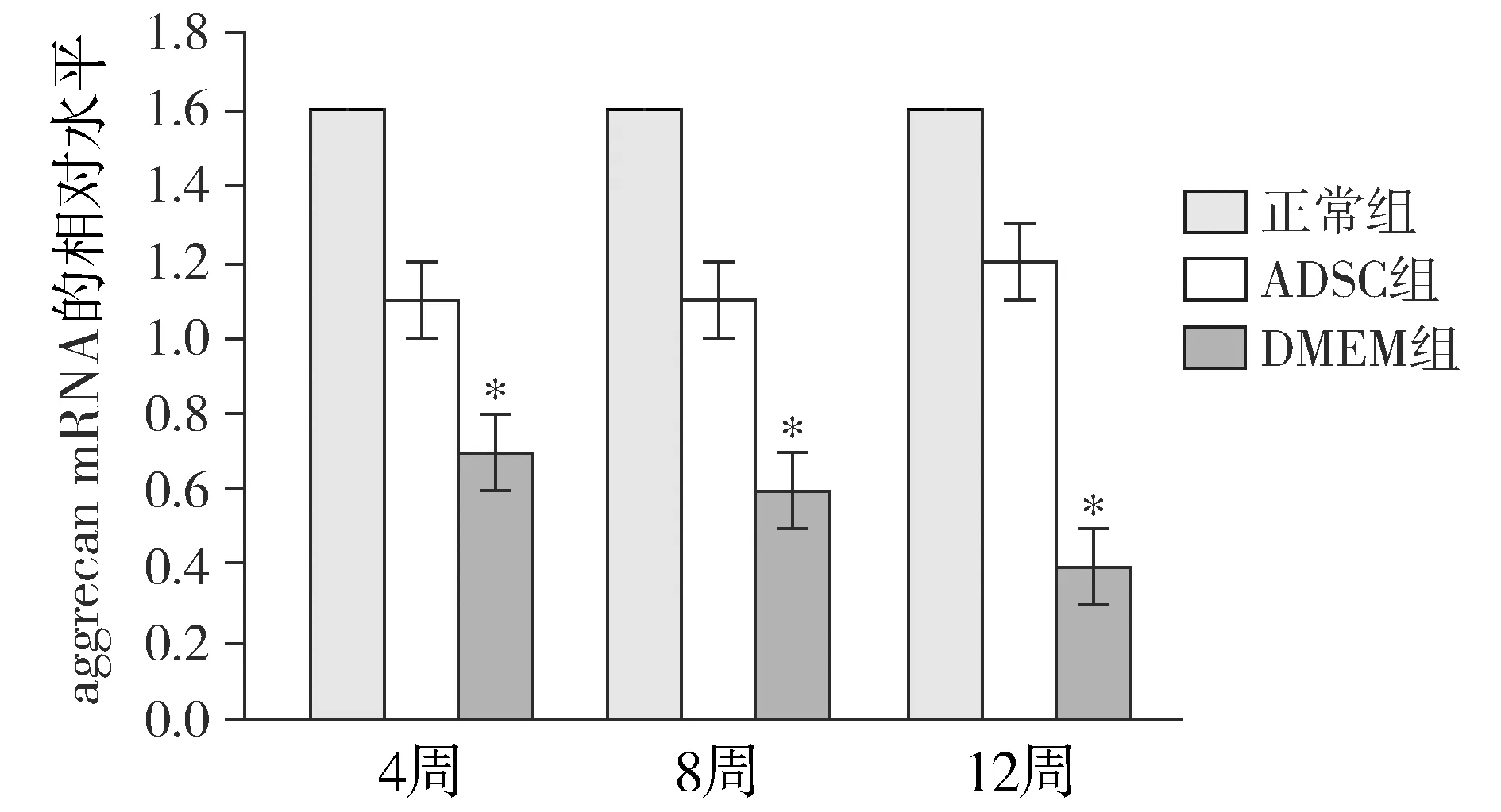
与其他两组比较,*P<0.05图5 各组不同时间点aggrecan mRNA的相对表达水平Figure 5 Relative expression level of aggrecan mRNA at different time points in each group
3 讨论
建立有效、可靠的IDD动物模型是研究IDD发生机制的基础,也为探讨IDD的治疗方式提供实验模型[5]。能够为研究其发病机制提供有利条件,也为治疗IDD的各种探索研究提供良好的实验载体,建立IDD模型的方式有很多,标准尚未达成统一。目前较为常用的模型均为诱发性退变,以直接干预损伤椎间盘结构诱发退变应用最为广泛[6]。
人类IDD的原因多与生活工作习惯相关,而非损伤性退变过程。完全模拟人类椎间盘退变过程所用周期较长,故而实验采用纤维环损伤建立模型的方式较为多见[7]。椎间盘退变模型的建立应当具有如下特点:能再现椎间盘退变的客观规律;具备高重复性、可靠性;尽可能与人类退变过程相似。本实验通过空针穿刺抽吸出5-8 mg(湿重)的髓核组织,此方法对实验动物椎间盘创伤小,使髓核组织丧失一定的体积,减少其含水量,髓核内静水压下降,诱发其发生退变,此方法能更好地模拟IDD早期病程中的髓核生物学功能丧失的基本特征,可以作为针对细胞移植治疗IDD的可靠动物模型。
ADSC是一种在组织工程领域应用非常广泛的干细胞,而且ADSC的体外扩增效率也较稳定,有足够的细胞来源。本实验中在采用穿刺抽吸法造模时同期进行ADSC的移植,观察在椎间盘发生退变的早期ADSC对椎间盘退变的治疗作用,尽管ADSC本身无法分泌类似髓核细胞的细胞外基质,但是ADSC的取材非常方便,人体内具有丰富的脂肪组织,本实验从兔腹股沟皮下获取脂肪组织,并成功分离出易于体外培养、并能稳定增殖的细胞。实验结果显示,原代培养的兔ADSC呈集落状生长,传代后的细胞生长速度明显增快。和其他成体干细胞相比,脂肪组织来源充足,取材简便。ADSC的增殖能力明显强于髓核细胞并且在特定的环境下可以分化成为类软骨细胞的表型[4]。本研究的实验结果提示ADSC可以抑制椎间盘继续发生退变。
在实验周期方面,本实验选取12周作为观察的时间周期,借鉴了国外相关领域学者的观察实效[8,9]。
在自然衰老的过程中,椎间盘高度的下降与髓核组织中蛋白多糖含水量的下降有关[10,11]。在临床诊断IDD时,MRI T2加权像显示的椎间盘信号强度是评价是否发生退变的重要参数,MRI T2加权像的信号可以直接反映椎间盘组织内的含水量,是较为敏感的评价指标,椎间盘内髓核组织的修复也直接表现为蛋白聚糖及其含水量的恢复。术后12周DMEM组MRI显示明显的信号降低,表明髓核组织内含水量显著下降,退变程度较为严重。故而,单纯使用DMEM培养基注射无法达到类似于种子细胞移植的修复效果,而ADSC组髓核组织信号轻微的降低,形态结构仍然相对完整。上述观察到的影像学改变表明,通过ADSC的早期移植的技术可以抑制椎间盘退行性变。
为了进一步观察ADSC对IDD的修复效果,本实验还进行了组织学染色和免疫组化染色。HE染色结果可以显示出椎间盘清晰的结构,ADSC组在椎间盘结构完整性方面强于DMEM组。由于HE染色无法显示出髓核组织的内部蛋白成分,所以我们又进行了番红O染色和免疫组化染色,collagen Ⅱ和aggrecan是ADSC的主要细胞外基质,aggrecan免疫荧光染色和番红O染色均显示髓核组织中aggrecan的蛋白表达情况。免疫组化染色显示在ADSCs组中髓核组织呈现广泛的阳性,而DMEM组随着时间的推移阳性表现进行性减弱,12周后表现为阴性反应,表明椎间盘已发生严重退变。real-time PCR在基因水平检测了collagen Ⅱ和aggrecan mRNA的表达水平,其结果与免疫组化染色一致,说明ADSC很好地抑制了髓核组织的继续退变。
我们在细胞移植过程中使用的是29G胰岛素注射器,可以满足细胞移植的需要而不使纤维环产生二次破坏[12],相反,如果纤维环被二次破坏后,将会有血管神经长入椎间盘内部,进而种子细胞将暴露于血液而产生免疫反应,最终影响其修复效果[13]。我们认为外源性地补充ADSC对椎间盘内残余髓核细胞进行影响,或者椎间盘的内环境可以满足ADSC的增殖分泌相应的细胞外基质[14]。本实验主要目的在于观察椎间盘早期的退变情况,在造模的早期进行干预操作,此时纤维环和髓核组织受到穿刺抽吸刺激后刚刚开始发生退变,此时是选择干预的最佳时机,同时避免了对实验动物的二次手术。
本实验的不足之处是缺乏生物力学的检测指标,对于各个时间点椎间盘的活动功能没有明确的数据支持,在组织工程各种常用的干细胞中,对椎间盘的退变抑制作用之间的差异,这将是实验下一步进行的主要方向。
