miR-590-5p通过靶向PTEN调控胃腺癌细胞SGC7901对顺铂敏感性的影响
2019-02-10章海斌丁晓娇王子安
陈 莹,章海斌,刘 玉,丁晓娇,王子安
(蚌埠医学院第一附属医院肿瘤内科,蚌埠 233004;*通讯作者,E-mail:wangzian118@sina.com)
胃癌是世界上第四常见的人类恶性肿瘤,具有较高的发病率与死亡率。据统计,胃癌死亡率占全球癌症死亡原因的第二位[1-3]。尽管近年来胃癌的治疗已得到提升,但其5年生存率仍不能确切统计[4,5],远处转移和化疗耐药是其致死率增高的主要原因,因此,提高胃癌早期诊断率以及降低其耐药性对提高患者生存率和生活质量尤为重要。miRNAs是一种能够在转录后水平负性调节基因表达的内源性非编码小分子RNA,已经被广泛证明能够通过与靶基因的3′UTR(3′非编码区)结合发挥癌基因或抑癌基因的作用[6-9]。前期研究发现miR-590-5p在胃癌耐药细胞SGC7901/DDP中高表达,表明其可能与胃癌耐药具有一定的相关性,同时通过生物信息学软件预测到miR-590-5p与PTEN能够靶向互补,本课题主要研究miR-590-5p与PTEN的关系及其在胃癌耐药中的作用。
1 材料与方法
1.1 细胞株及主要试剂
SGC7901细胞及SGC7901/DDP细胞购自上海复旦(IBS)细胞资源中心,RPMI-1640培养基购自Hy-clone股份有限公司,胎牛血清购自浙江天杭生物科技股份有限公司,miRNA-590-5p mimics、miRNA-590-5p inhibitors、阴性对照序列、GAPDH引物、PTEN引物均购自上海吉玛基因有限公司,miR-590-5p引物、U6引物购自上海生工生物工程有限公司,转染试剂Lipofectamine2000购自Thermo Scientific公司。总RNA提取试剂盒购自天根科技(北京)有限公司,RNA反转录试剂盒购自Thermo Scientific有限公司,TB Green TM Primix Ex Taq TM试剂盒购自日本TaKaRa公司,一抗β-actin、PTEN及辣根过氧化物酶标记的羊抗兔/鼠二抗均购于Abbkine科技有限公司,Western blot试剂盒及BCA蛋白浓度测量试剂盒购自碧云天生物技术公司,四甲基偶氮唑盐(MTT)购自Biofroxx公司。
1.2 细胞培养及转染
人胃癌细胞SGC7901培养于含10%胎牛血清的RPMI1640培养基中,人胃癌耐药细胞SGC7901/DDP稳定培养于顺铂浓度为0.1 mg/L含10%胎牛血清的RPMI1640中,两者均在37 ℃,5%CO2饱和湿度培养。取对数生长期的细胞进行转染,要求转染时细胞融合达到60%,严格按照Lip2000及基因片段说明书进行转染操作,将实验分为空白组、NC组(阴性对照)、转染组。SGC7901细胞及SGC7901/DDP细胞分别转染miRNA-590-5p mimics及miRNA-590-5p inhibitors,分别用10 μl Lip2000混合4 μg基因片段置入500 μl不含血清培养基静置20 min后加入培养皿,最终培养液终浓度为1 μg/L,6 h更换不含双抗仅含10%胎牛血清培养液,48 h进行后续实验。
1.3 检测SGC7901细胞及SGC7901/DDP转染后miR-590-5p的表达
转染后用总RNA提取试剂盒提取细胞内总RNA,并用RNA反转录试剂盒按照说明反转录RNA为cDNA,合成的cDNA用TB GREEN试剂盒通过PCR仪进行PCR扩增,以U6为内参检测miR-590-5p相对表达量,最终Ct值采用2-ΔΔCt进行分析。引物序列如下:U6正向5′-TG G CA CCCA GCACAATGAA-3,反向5-CTAAGTCATAGTCCGCCTAGAAGCA-3;miR-590-5p正向5′-GAGCTTATTCATAAAAGTG-3′。实时荧光定量PCR采用两步法PCR扩增标准程序:第一步预变性(95 ℃,30 s),第二步PCR反应(95 ℃ 5 s,60 ℃ 30 s),共40个循环,所有试验均重复3次。
1.4 MTT检测转染后胃癌细胞对顺铂敏感性的变化
胰酶消化收集转染后空白组、NC组、转染组SGC7901细胞及SGC7901/DDP细胞分别按5 000个/孔接种于96孔板,置于37 ℃,5% CO2,在饱和湿度环境下培养24 h,吸去原培养液,分别加入终浓度为0,2,4,8,16,32 μmol/L的含顺铂培养液,以不接种细胞而只加培养基的孔作为调零孔,以不加药的孔作为对照组,每个浓度设5个复孔,给药后培养48 h,检测其490 nm处吸光度。
1.5 生物信息学预测miR-590-5p的下游靶基因
通过生物信息学软件(Target Scan和PicTar)预测能够与miR-590-5p结合的下游靶点作为备选的靶基因。
1.6 总RNA提取及实时荧光定量PCR检测
转染后用总RNA提取试剂盒提取细胞内总RNA,将提取的RNA用RNA反转录试剂盒说明反转录RNA为cDNA,合成的cDNA用TB GREEN试剂盒通过PCR仪进行PCR扩增,以GAPDH为内参检测PTEN相对表达量,最终Ct值采用2-ΔΔCt进行分析,引物序列如下:GAPDH正向5′-TCTCTCCTCCTCCTGTTCG-3′,反向5′-GCGCCCAATAGGACCAAATC-3′;PTEN正向5′-CAATGACAGCCATCATCAAAGAG-3′,PTEN反向5′GCTCAGACTTTTGTAATTTGTG-3′。实时荧光定量PCR采用两步法PCR扩增标准程序:第一步预变性(95 ℃,30 s),第二步PCR反应(95 ℃ 5 s,60 ℃ 30 s),共40个循环,采用2-ΔΔCt法计算基因的相对表达量,所有试验均重复3次。
1.7 Western blot法检测蛋白表达水平
胰酶消化收集转染后空白组、NC组、转染组SGC7901及SGC7901/DDP细胞,2 500 r/min离心8 min,弃上清,加入裂解液,冰上裂解30 min,-20 ℃冰箱过夜,次日4 ℃离心机12 000 r/min离心30 min,取上清液,蛋白定量后PAGE-SDS胶对蛋白样品进行电泳分离1.5 h,PVDF膜转膜1.5 h,含5%脱脂牛奶的TPST室温封闭4 h,一抗β-actin、PTEN 4 ℃下孵育过夜(PTEN抗体按1 ∶1 000稀释,β-actin抗体按1 ∶5 000稀释),二抗室温下孵育2 h,TPBS洗3次,曝光显影。
1.8 统计学分析
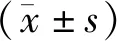
2 结果
2.1 qRT-PCR检测转染后miR-590-5p表达水平
RT-PCR结果表明,SGC7901细胞转染miR-590-5p mimics后其表达量明显升高,而SGC7901/DDP细胞转染miR-590-5p inhibitor后其表达量明显降低,差异具有统计学意义(P<0.05,见图1)。
与空白组及NC组比较,*P<0.05图1 转染后胃癌细胞中miR-590-5p表达水平的变化Figure 1 Changes of miR-590-5p expression in gastric cancer cells after transfection
2.2 MTT检测转染后细胞增殖抑制作用
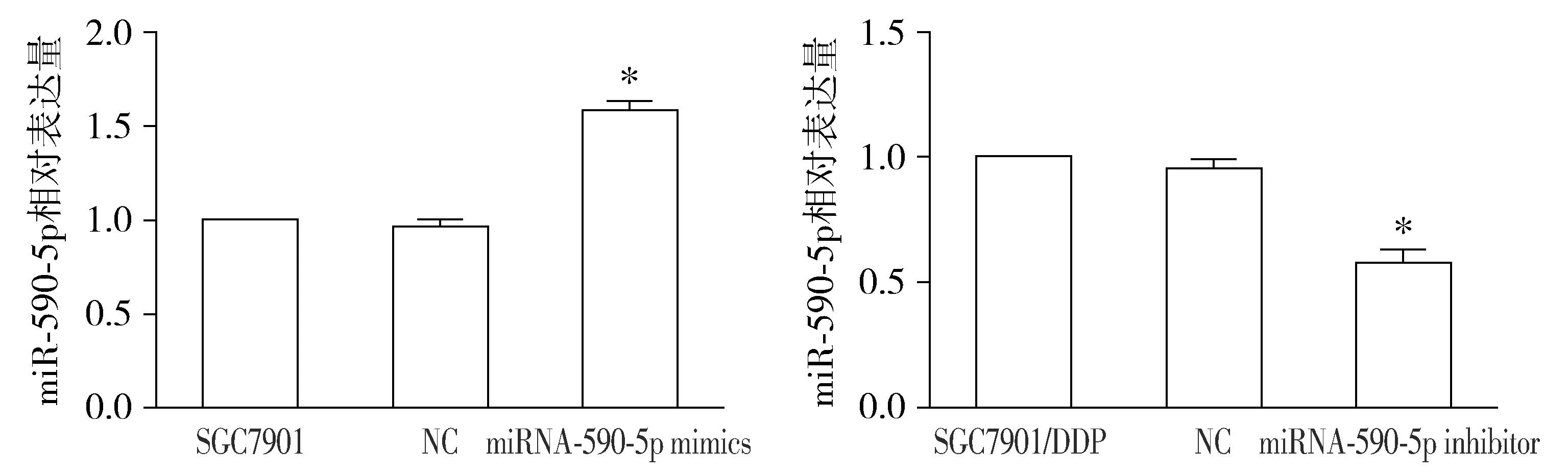
MTT结果显示,上调SGC7901细胞中miR-590-5p的表达,胃癌细胞SGC7901对顺铂的敏感性降低,而敲低SGC7901/DDP胃癌细胞中的miR-590-5p,其对顺铂的敏感性升高(P<0.05,见图2),提示miR-590-5P能够影响胃癌细胞的耐药性。
与NC及空白对照组比较,*P<0.05图2 miR-590-5p对胃癌细胞顺铂敏感性的影响Figure 2 Effect of miR-590-5p on cisplatin sensitivity of gastric cancer cells
2.3 Targetscan软件预测靶基因
通过生物信息学软件预测出miR-590-5p能够与PTEN 3′UTR靶向结合,可将PTEN作为miR-590-5p的备选靶基因(见图3)。

图3 生物信息学软件预测miR-590-5p靶基因Figure 3 Bioinformatics software predicts miR-590-5p target gene
2.4 miR-590-5p对PTEN mRNA表达的影响
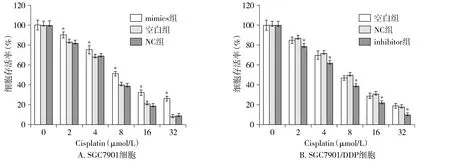
结果显示,在胃癌细胞SGC7901中转染组相较于阴性对照组及空白对照组PTEN mRNA表达水平降低;相反地,在胃癌耐药细胞SGC7901/DDP中转染组PTEN mRNA表达水平较阴性对照组及空白对照组升高,差异具有统计学意义(P<0.05,见图4)。
与NC及空白对照组比较,*P<0.05图4 MiR-590-5p对PTEN mRNA表达的影响Figure 4 Effect of miR-590-5p on the expression of PTEN mRNA
2.5 miR-590-5p对PTEN蛋白表达的影响
Western blot结果显示,在胃癌细胞SGC7901中转染组相较于阴性对照组及空白对照组PTEN蛋白表达水平降低;相反地,在胃癌耐药细胞SGC7901/DDP中转染组PTEN蛋白表达水平较阴性对照组及空白对照组升高,差异具有统计学意义(P<0.05,见图5)。
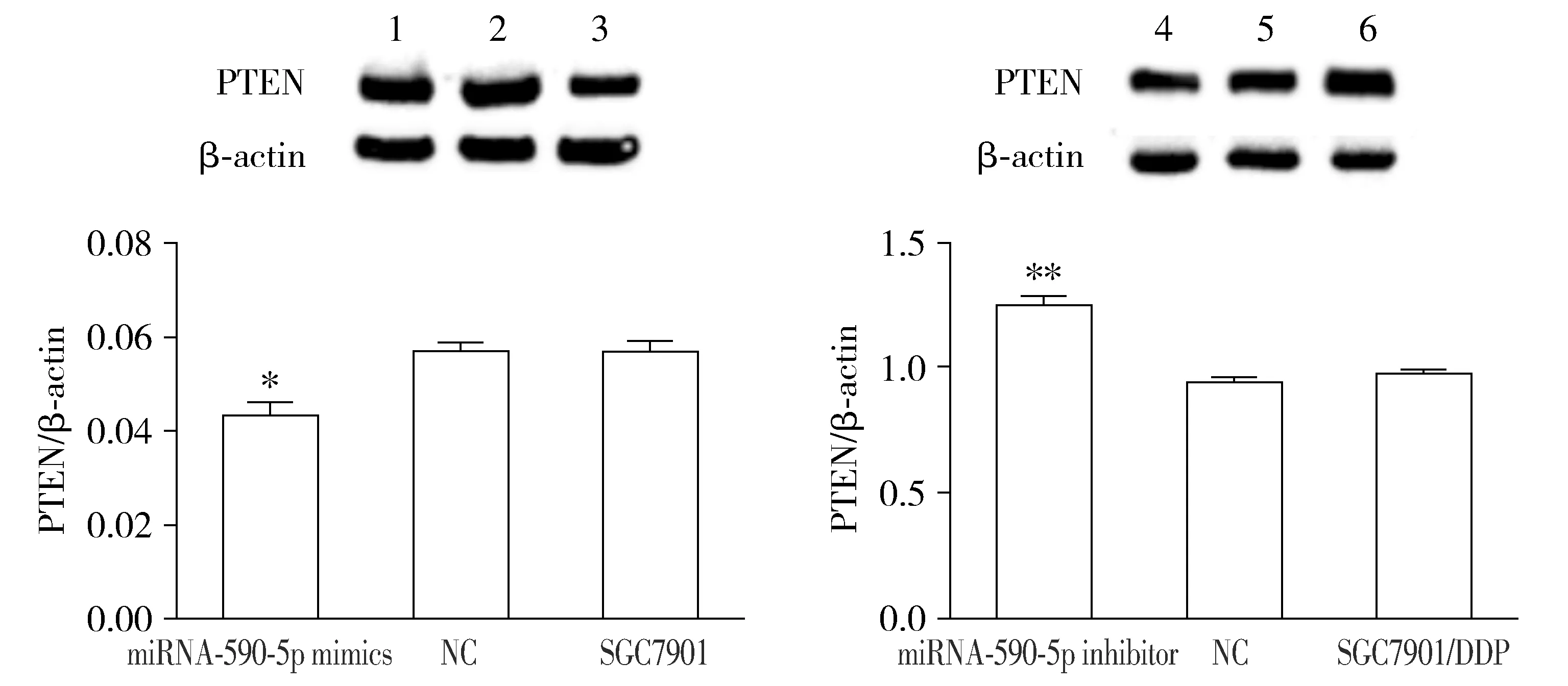
1.SGC7901组;2.SGC7901 NC组;3.miR-590-5p mimics组;4.SGC7901/DDP组;5.SGC7901/DDP NC组;6.SGC7901/DDP inhibitor组;与相应的NC及空白对照组比较,*P<0.05,**P<0.01图5 miR-590-5p对PTEN蛋白表达的影响Figure 5 Effect of miR-590-5p on PTEN protein expression
3 讨论
胃癌耐药在胃癌患者的治疗中尤为常见,胃癌患者存活率明显低于其他肿瘤患者,多数胃癌患者治疗后会出现肿瘤复发转移[10]。因此,明确胃癌耐药的具体机制能够为胃癌患者的治疗及改善预后提供新的思路。
miRNAs是一类可能具有癌基因或抑癌基因功能的小分子非编码RNA,越来越多研究表明miRNAs广泛参与肿瘤的病理学研究并且能够通过结合下游靶基因3′UTR来调控多种肿瘤细胞的生物学功能及肿瘤耐药等,miRNAs的发现在一定程度上为肿瘤发病机制提供新的思路,也为肿瘤的诊断及治疗提供新的方向[11-13]。已有研究表明在肝癌、宫颈癌、肾癌、结直肠癌、食管鳞癌细胞中上调miR-590-5p能够影响肿瘤细胞的增殖、凋亡、侵袭等生物学行为[14-17],因此推测miR-590-5p在多种肿瘤细胞中可作为癌基因或抑癌基因发挥重要作用。同时,miR-590-5p可以通过调节下游靶基因RECK等的表达变化影响胃癌细胞的增殖、凋亡等生物学行为,并且具有调节胃癌细胞对顺铂及紫杉醇的耐药作用[18],但其具体的机制尚未明确。磷酸酶及张力蛋白同源物基因(phosphatase and tensin homologue deleted on chromosome ten, PTEN),于1997年发现,是位于10号染色体具有双特异性磷酸酶活性的肿瘤抑制基因[19]。研究发现,PTEN与肿瘤的发生密切相关,在多种肿瘤中如胆管癌、肺癌、结肠癌、黑色素瘤、肝癌等常常存在表达和功能的异常[20-23],发挥着抑癌基因的功能。
本研究通过比较miR-590-5p在胃癌亲本细胞SGC7901和耐药细胞SGC7901/DDP中的表达表明,miR-590-5p在胃癌耐药细胞SGC7901/DDP细胞中有较高表达,通过过表达和敲低SGC7901细胞和SGC7901/DDP细胞中的miR-590-5p发现,SGC7901细胞对顺铂的敏感性下降,而SGC7901/DDP细胞对顺铂敏感性提高,表明miR-590-5p能够影响胃癌细胞的耐药性。为了研究miR-590-5p影响胃癌细胞发生耐药的机制,本实验通过软件Targetscan预测出miR-590-5p的下游靶基因PTEN,并通过荧光定量PCR及Western blot表明,miR-590-5p能够在转录后水平调节PTEN的表达,由此表明,miR-590-5p能够通过靶向调节PTEN来调控胃癌细胞耐药,提示miR-590-5p可以作为胃癌耐药治疗的一个新的方向。
