MTH1抑制剂TH287对胃癌细胞BGC-823的抑制作用及其机制
2019-02-10詹丹凯张新鑫贾建光
詹丹凯,张新鑫,贾建光
(蚌埠医学院第一附属医院肿瘤外科,蚌埠 233000;*通讯作者,E-mail:jiajianguang1978@126.com)
癌细胞由于氧化还原失调产生大量活性氧损伤DNA、RNA以及游离核苷酸。损伤的核苷酸一旦插入到DNA当中,将会进一步造成DNA损伤,导致细胞死亡[1]。此外,氧化应激与人类基因组的稳定性和疾病有关[2]。氧化损伤的碱基一旦插入DNA链中,将会诱发DNA损伤,这将会导致疾病的发生。8-氧化鸟嘌呤(8-oxo-G)是最常见的氧化碱基,它容易与腺嘌呤(adenine,A)发生错误配对,从而导致DNA复制、转录及蛋白质翻译错误。此外,8-氧化鸟嘌呤还能够调节端粒酶的活性,并且与癌症和其他疾病有关[3,4]。在正常氧化还原环境中,8-oxo-G能够促进端粒酶延长,而氧化应激条件下,端粒会发生功能紊乱或者缩短,从而进一步导致细胞死亡[5]。
哺乳动物中的MutT同源蛋白1(MTH1)是nudix水解酶家族成员之一,主要分布在细胞质和线粒体中。它能够水解包括8-氧化鸟嘌呤在内的氧化嘌呤三磷酸核苷酸,从而阻止细胞损伤和死亡[6]。不仅如此,MTH1还能够有效地水解甲基化碱基,阻止甲基化碱基插入DNA链中,以免干扰DNA正常复制和基因的正常表达[1,7-9]。近年来,大量研究证实,MTH1有望是癌症治疗中新的靶点。MTH1水平的变化可能与细胞损伤和疾病的发生有关,MTH1表达水平下降可以导致8-OXO-G诱导的RNA损伤增加[10];而MTH1表达水平降低,可能与溃疡性结肠炎相关的癌变有关[11]。调控MTH1水平或功能可能会成为癌症治疗的新途径。
胃癌仍然是全世界最常见的恶性肿瘤之一,其发病率在肿瘤中高居第五,死亡率高居第三[12,13]。尽管早期胃癌患者通过手术治疗预后良好,然而进展期胃癌因其复发,转移及耐药等因素,其预后仍然堪忧。生物靶向治疗俨然发展为现代肿瘤治疗的重要手段,随着对MTH1的研究不断取得进展和突破,TH588、TH287等MTH1小分子抑制剂,被认为可以通过靶向MTH1杀死癌细胞[1,11,14]。据报道,MTH1功能失调时癌细胞存活率较低,因此,靶向MTH1活性可能是一种有效的治疗策略[15-17]。本研究旨在探讨MTH1抑制剂TH287对胃癌细胞的作用及其机制。
1 方法与材料
1.1 细胞株与主要试剂
人胃癌细胞株BGC-823购自上海生物研究所细胞库(中国,上海)。胎牛血清购自杭州天杭生物科技公司公司(中国,杭州),RIPM1640液体培养基购自赛默飞世尔科技公司(中国,上海),100 U/ml青霉素和100 U/ml链霉素双抗购自碧云天生物技术公司(中国,上海),CCK-8试剂盒购自亚科因生物技术公司(中国,湖北)。BCA蛋白定量试剂盒及蛋白印迹(Western blot)试剂盒均购自碧云天生物技术公司(中国,上海)。Annexin-Ⅴ/FITC试剂盒及线粒体膜电位试剂盒均购自贝博生物公司(中国,上海)。MTH1抑制剂TH287购置Selleck生物科技公司(美国,休斯顿)。Bcl-2、Bax、PI3K、AKT、p-AKT多克隆抗体及二抗均购自武汉三鹰生物技术公司(中国,武汉)。
1.2 细胞培养
胃癌细胞株BGC-823在含10%胎牛血清,100 U/ml青霉素,10 U/ml链霉素的RIPM1640液体培养基中培养,培养在37 ℃,5% CO2环境培养箱。细胞每2 d换液,当细胞密度生长至80%-90%时,PBS洗涤,用0.25%胰酶(含EDTA)消化并进行后续试验或传代。
1.3 细胞活力检测
CCK-8细胞增殖检测试剂盒测定细胞活力,取对数生长期细胞,胰酶消化后用1640培养基重悬至7×104密度,充分混匀后按100 μl/孔接种于96孔板,最终细胞数为7 000/孔,最外缘孔加入同样体积PBS,培养24 h。细胞贴壁后,将培养基换成含不同浓度TH287的培养基(0,4,8,16,32,64,128 μmol/L),另设空白组(只加培养基不加细胞),所有组设6个复孔。将96孔板置于37 ℃培养箱中按不同时间段分别培养24,48,72 h,结束培养后,每孔加入10 μl CCK-8试剂并且继续培养2 h,于450 nm波长用酶标仪检测OD值。实验重复3次,并记录结果。计算细胞活力。
1.4 克隆形成实验
将生长状态良好的细胞取其对数生长期细胞,胰酶消化后用培养基重悬,按2 000个/皿接种于3.5 cm培养皿中,37 ℃培养过夜,细胞贴壁后,将培养基换成TH287浓度为0,0.5,1.0,1.5 μmol/L的培养基并继续培养2周。弃培养基,用PBS洗涤,加入4%多聚甲醛固定10 min,室温晾干,结晶紫染色20 min,双蒸水洗涤,在室温晾干,拍照并记录结果。
1.5 划痕实验
将细胞接种于6孔板,待细胞密度至80%-90%密度时,用10 μl规格枪头划痕,PBS小心洗涤2次去除漂浮细胞,显微镜拍照记录为0 h。加入TH287浓度为0,4,16,64 μmol/L的无血清培养基,继续培养24 h,显微镜下拍照记录,计算细胞迁移率,迁移率=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
1.6 Transwell实验
Transwell实验用来检测TH287对胃癌细胞迁移能力的影响,取对数生长期细胞,用无血清培养基培养12 h,用无血清培养基重悬细胞,按5×104个/孔密度加入到Transwell小室上室中,下室加入0.6 ml含30%胎牛血清的1640培养基。37 ℃培养8 h至细胞贴壁,上室加入含不同浓度TH287(0,4,16,64 μmol/L)培养基继续培养24 h。用4%多聚甲醛固定10 min并用结晶紫染色20 min,用棉签小心擦去小室上面细胞并用双蒸水小心洗涤,室温晾干,200倍显微镜下选取5个随机视野拍照,用Image软件进行计数,细胞数取平均值。
1.7 Western blot法检测相关蛋白表达水平
取对数生长期细胞接种于6孔板,待细胞融合至70%时,弃培养基,用PBS洗2次,用含不同浓度TH287(0,4,16,64 μmol/L)的培养基继续培养48 h,用RIPA裂解液冰上裂解30 min,4 ℃ 12 000 r/min离心30 min,提取总蛋白。BCA法测定总蛋白浓度,加入1×蛋白上样缓冲液混匀,95 ℃变性。SDS-PAGE凝胶电泳并将蛋白用湿转法转移至PVDF膜上,TBST洗涤2次,5%脱脂牛奶封闭4 h,TBST洗涤,一抗(Bcl-2 1 ∶1 000,Bax 1 ∶1 000,PI3K 1 ∶500,Akt 1 ∶500,p-Akt 1 ∶500,GAPDH 1 ∶2 000)4 ℃孵育过夜,TBST洗涤3次,5 min/次,二抗(山羊抗兔Ig抗体1 ∶5 000)室温孵育2 h,洗涤后ECL显影液显影并暗室曝光。
1.8 细胞凋亡检测
BGC-823细胞接种于6孔板,生长至70%密度时,用含不同浓度TH287(0,4,16,64 μmol/L)的培养基处理细胞48 h。用不含EDTA的胰酶消化并用冷的PBS洗2次,用400 μl 1×Binding Buffer悬浮细胞,加入5 μl FITC,避光冰上孵育15 min,加入10 μl PI避光冰上孵育5 min,于孵育结束后1 h内流式细胞仪检测细胞凋亡率。
1.9 线粒体膜电位检测
细胞接种于6孔板,待细胞生长至合适密度时,用含不同浓度TH287(0,4,16,64 μmol/L)的培养基培养24 h,PBS洗涤2次,换新鲜培养液1 ml/孔,加入1 ml/孔JC-1染色工作液,37 ℃培养箱中避光孵育20 min,弃上清,用预冷1×JC-1染色缓冲液洗涤2次,加入2 ml新鲜培养液,荧光显微镜下拍照。
1.10 SC79验证TH287对PI3K/AKT信号通路的作用
为了证明TH287通过PI3K/AKT信号通路发挥作用,实验组胃癌细胞经过AKT磷酸化激活剂SC79(5 μmol/L)预处理2 h,再用含TH287(64 μmol/L)培养基培养24 h。对照组为含TH287(64 μmol/L)培养基培养24 h。空白对照组不加药。细胞培养24 h后,检测细胞活力、细胞凋亡以及蛋白表达情况。
1.11 统计学分析
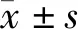
2 结果
2.1 TH287降低细胞活力抑制BGC-823细胞增殖
CCK-8法检测细胞增殖结果显示,TH287处理后BGC-823细胞活力降低,TH287浓度为0,4,8,16,32,64,128 μmol/L时,随着TH287浓度和作用时间增加,细胞活力不断下降(P<0.05,见图1),并且作用效果呈剂量和时间依赖性。克隆形成实验结果显示,实验组BGC-823的集落形成数量明显比对照组少,并且TH287浓度越高,集落形成数量越少(见图1)。TH287明显抑制BGC-823增殖能力。
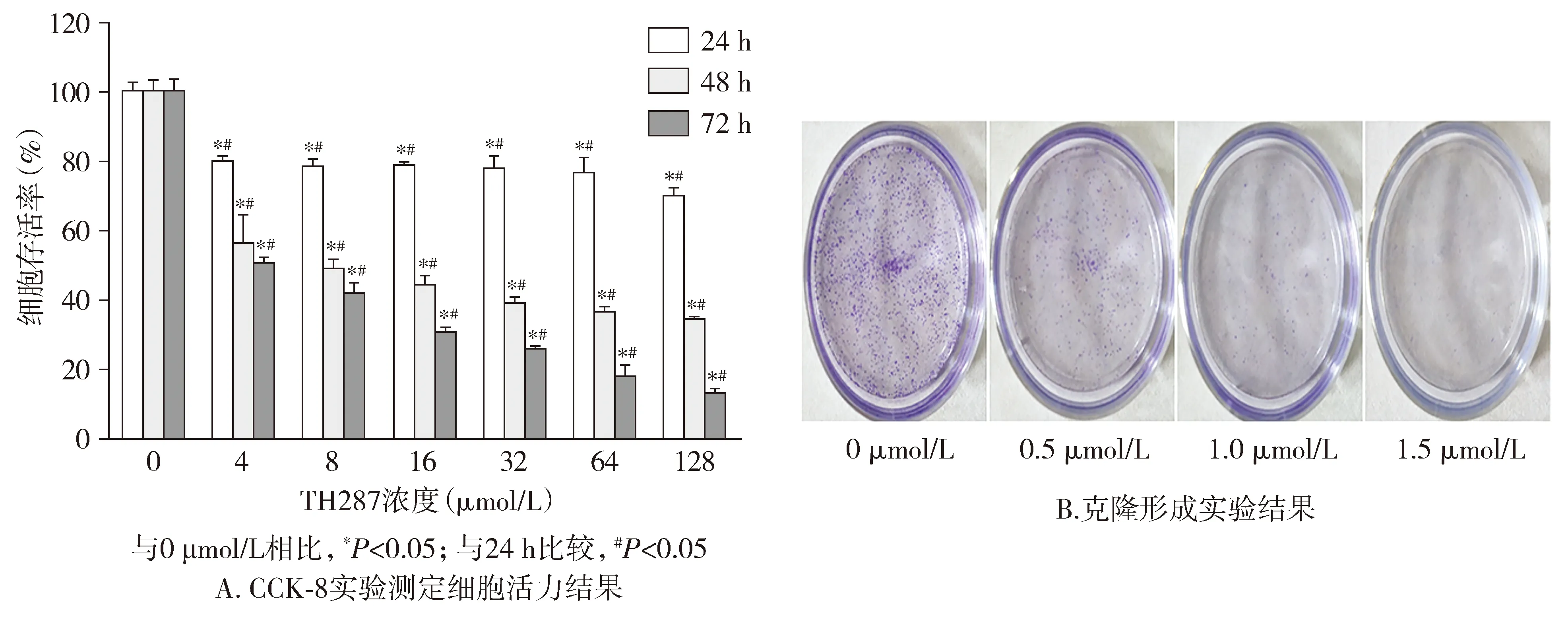
图1 TH287对胃癌细胞BGC-823活力和克隆形成的影响Figure 1 Effect of TH287 on cell viability and clony formation of gastric cancer BGC-823
2.2 TH287抑制BGC-823细胞迁移
划痕及Transwell实验结果分别显示,不同浓度TH287(0,4,16,64 μmol/L)作用下,24 h细胞迁移率分别为(28.67±1.48)%,(19.87±1.20)%,(10.70±2.18)%和(3.07±1.25)%。与0 μmol/L组比较,随着TH287作用浓度的增加,BGC-823细胞迁移率逐渐下降(P<0.05);细胞迁移数目逐渐减少(P<0.01,见图2)。TH287对胃癌细胞株BGC-823迁移能力明显抑制。

与0 μmol/L相比,*P<0.05,**P<0.01图2 TH287对胃癌细胞BGC-823迁移的影响Figure 2 Effect of TH287 on migration of BGC-823 cells
2.3 TH287诱导BGC-823细胞凋亡和线粒体膜电位改变
Annexin Ⅴ-FITC/PI双染用于检测细胞凋亡,FITC水平反应细胞早期凋亡率,PI水平则反应晚期凋亡情况。结果显示,4,16,64 μmol/L TH287处理后,细胞凋亡率分别为(18.88±1.45)%,(45.3±2.88)%,(59.8±4.78)%;与0 μmol/L相比,细胞凋亡凋亡比率明显上升(P<0.01)。线粒体膜电位降低发生于细胞凋亡的早期,细胞线粒体的功能发生变化,检测结果显示,与0 μmol/L相比,随着TH287浓度(4,16,64 μmol/L)的增加,红光逐渐减弱,绿色荧光逐渐增强(见图3,4),提示线粒体膜电位在逐渐降低,并且与TH287作用有关。
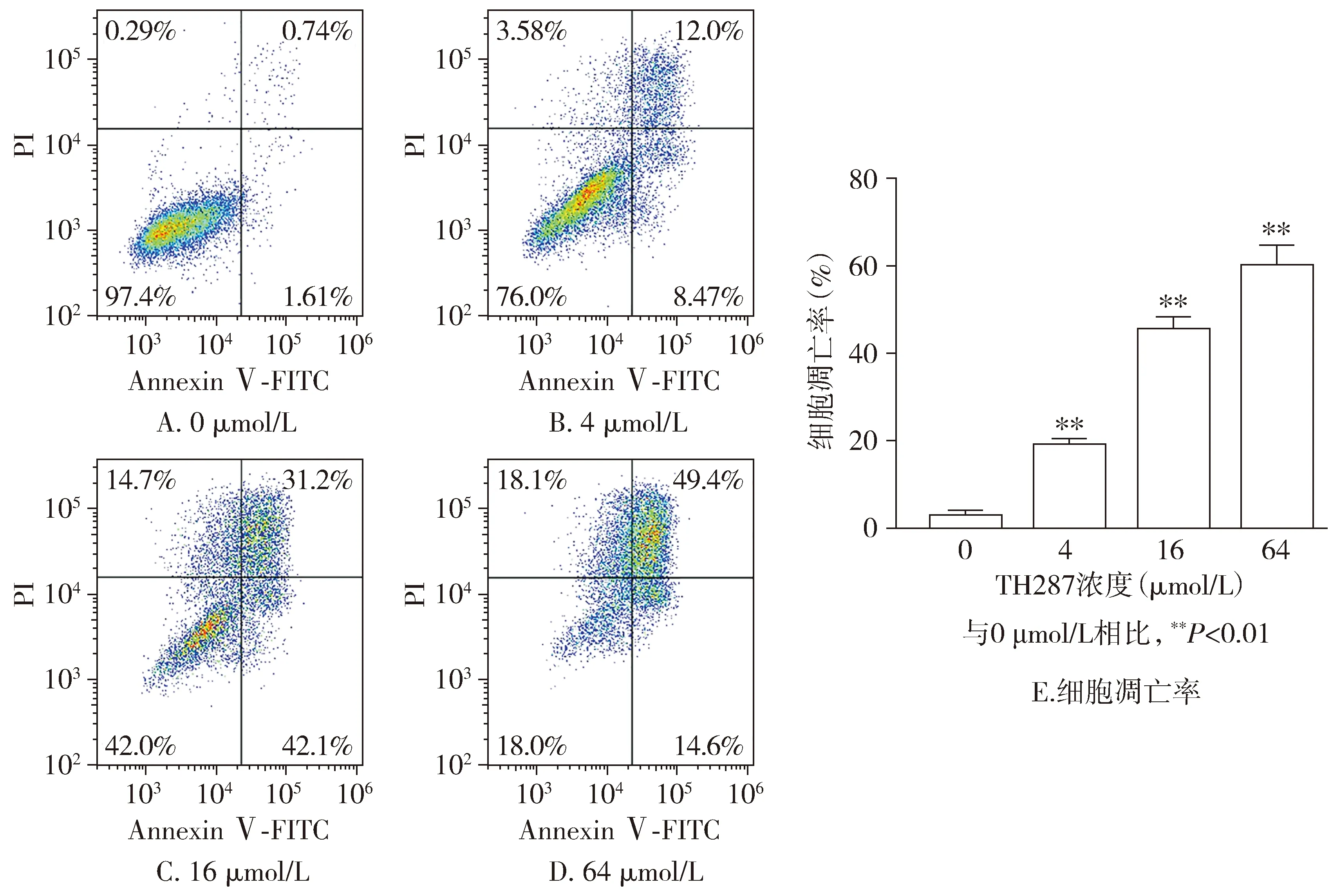
图3 TH287对胃癌细胞BGC-823凋亡的影响Figure 3 Effect of TH287 on apoptosis of BGC-823 cells
图4 不同浓度TH287对胃癌细胞线粒体膜电位的影响Figure 4 Effect of TH287 on mitochondrial membrane potential in BGC-823 cells
2.4 TH287对凋亡及PI3K/AKT信号通路相关蛋白表达的影响
Western blot结果显示,在不同浓度TH287作用下,BGC-823抗凋亡蛋白Bcl-2表达水平下降,促凋亡蛋白Bax水平上升,Bcl-2/Bax比值下降(P<0.05);TH287抑制PI3K,磷酸化AKT(p-AKT)水平,并且p-AKT/AKT比值下降(P<0.05,见图5)。表明TH287可能通过PI3K/AKT通路诱导细胞凋亡。
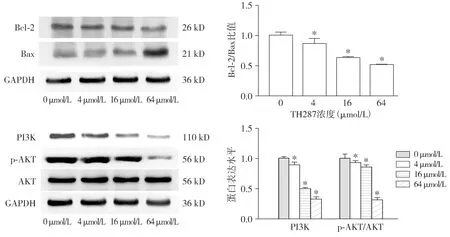
与0 μmol/L相比,*P<0.05图5 TH287对BGC-823细胞凋亡相关蛋白和PI3K/p-AKT通路相关蛋白的影响Figure 5 Effect of TH287 on the apoptosis-associated protein and PI3K/p-AKT pathway-associated protein in BGC-823 cells
2.5 TH287通过PI3K/AKT信号通路调控细胞凋亡的验证
为了进一步证明TH287是否通过PI3K/AKT通路调控细胞凋亡,胃癌细胞经过AKT磷酸化激活剂SC79预处理2 h。结果显示,与空白对照组相比,TH287单独作用诱导细胞凋亡,并且抑制AKT磷酸化水平;与TH287对照组相比,实验组TH287联合SC79作用,细胞活力增加,高于TH287组(P<0.01),并且凋亡比率也低于TH287单独作用(P<0.05);在蛋白水平,与TH287单独作用相比,TH287联合SC79作用时AKT的磷酸化水平高于TH287单独作用,p-AKT/AKT和Bcl-2/Bax比值增高(P<0.05,见图6,7)。结果表明,SC79能够抑制TH287对BGC-823的作用效果,提高AKT磷酸化水平,细胞凋亡减少。证明TH287可能是通过PI3K/AKT信号通路调控细胞凋亡的。
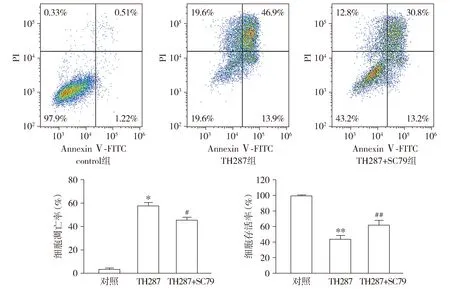
与对照组比较,*P<0.05,**P<0.01;与TH287组比较,#P<0.05,##P<0.01图6 AKT磷酸化激活剂SC79抑制TH287对胃癌细胞的作用Figure 6 SC79 partially reverses inhibitory effect of TH287 in BGC-823 cells
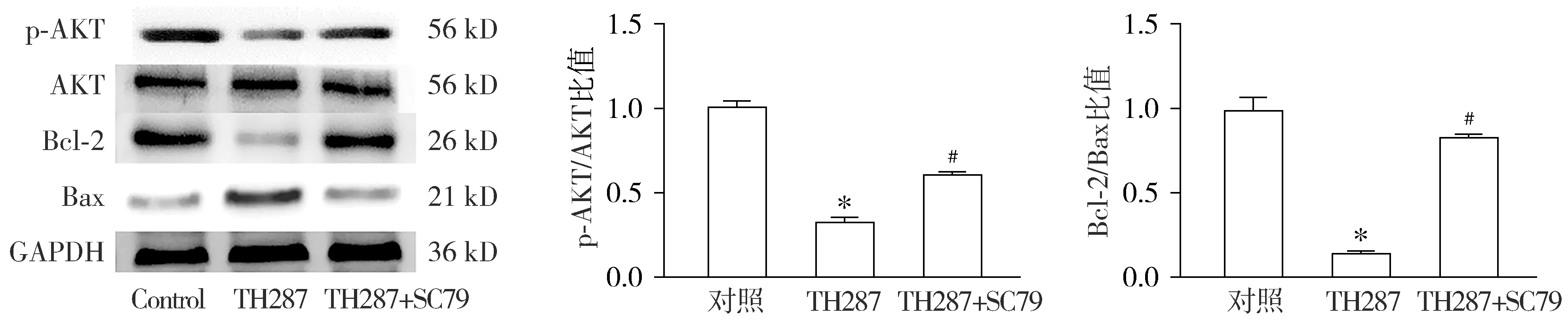
与对照组相比,*P<0.05;与TH287组比较,#P<0.05图7 SC79抑制TH287对胃癌细胞蛋白水平的作用Figure 7 SC79 partially reverses effects of TH287 on protein expression in BGC-823 cells
3 讨论
胃癌已经成为全球第三大高死亡率肿瘤,已经严重损害人类健康[18]。进展期胃癌,由于复发转移及耐药等原因,预后差,治疗效果并不满意[19]。目前多药联合化疗是治疗晚期复发转移癌症的可行性方案,然而,胃癌患者由于对化疗药物产生耐药性,疗效及预后仍旧不佳[20]。近年来,MTH1已经被视为癌症治疗中的新靶点,MTH1小分子抑制剂可能对胃癌有效。在本次研究中,体外实验结果表明,MTH1抑制剂TH287抑制胃癌细胞活力及增殖。并且进一步研究证实,TH287抑制胃癌细胞BGC-823细胞迁移。MTH1与基因组稳定性和细胞活力有关,TH287通过抑制MTH1的功能影响细胞活力。进一步对TH287作用机制的研究证实,MTH1抑制剂TH287能够诱导胃癌细胞BGC-823细胞凋亡。
线粒体是与细胞死亡有密切关联的细胞器,线粒体膜电位改变发生在凋亡早期,并且会导致包括凋亡相关分子释放等一系列反应[21,22]。实验结果表明,TH287治疗后,细胞线粒体膜电位发生改变,意味着TH287可以诱导线粒体膜电位降低。为了进一步证实TH287是否与细胞凋亡有关,进行了Annexin Ⅴ-FITC/PI双染实验,结果显示TH287治疗BGC-823细胞,细胞凋亡率明显上升。以往的研究表明,Bax蛋白由细胞质向线粒体外膜转移会刺激线粒体膜通透性的改变,并且会导致细胞释放Cyt c[23]。Bcl-2和Bax是Bcl-2蛋白家族成员之一,他们与细胞凋亡和肿瘤发生发展有关[24]。研究结果证实TH287诱导BGC-823凋亡相关蛋白表达水平发生改变,Bcl-2表达量下降,Bax表达量上升,Bcl-2/Bax比值下降。此外,有研究表明,Bcl-2/Bax在线粒体中定位决定凋亡的发生,其比值与凋亡水平有关[25]。以上研究结果表明,TH287诱导胃癌细胞BGC-823凋亡,可能是通过线粒体途径。
PI3K/AKT/mTOR信号通路对于细胞调控增殖、凋亡、自噬、细胞周期均有关[26-30]。此外,多种刺激因子通过刺激细胞激活PI3K/AKT信号通路来调节细胞生理功能[31]。PI3K/AKT信号通路是细胞内信号转导经典的信号通路,它调控细胞多种生理功能及病理过程,靶向PI3K/AKT信号通路的药物可能会诱导细胞凋亡。我们进一步研究TH287对胃癌细胞的作用机制是否与PI3K/AKT信号通路调控机制有关,结果显示,TH287处理胃癌细胞,PI3K表达水平下降,p-AKT减少,p-AKT/AKT比值下降,证明PI3K/AKT信号通路被抑制。进一步研究发现,AKT磷酸化激活剂SC79[32,33]预处理后,胃癌细胞接受TH287治疗,细胞活力和凋亡率发生部分逆转,并且TH287诱导的凋亡相关蛋白的改变也被抑制。这些结果证明,TH287通过抑制PI3K/AKT通路调控细胞凋亡,然而更多的证据还在研究当中。
综上所述,TH287能够通过诱导细胞凋亡抑制胃癌细胞BGC-823增殖,并且TH287还抑制胃癌细胞迁移能力。此外,TH287还可能通过PI3K/AKT信号通路调控细胞凋亡,影响凋亡相关蛋白Bcl-2、Bax的表达,从而发挥抗肿瘤作用。然而,细胞信号通路极其复杂,TH287对胃癌细胞作用是否还影响其他信号通路及存在更多的潜在作用机制,目前仍不清楚。不仅如此,MTH1抑制剂TH287作为小分子化合物,目前尚处于研究阶段,其毒副作用尚不清楚。尽管如此,研究结果证实了TH287具有明显抗肿瘤作用,提示MTH1抑制剂TH287治疗胃癌可能会是一种新的治疗策略。
