GTF2IRD1基因多态性与先天性小耳畸形发病的关系△
2019-01-24冯涛钱瑾王悦章庆国
冯涛 钱瑾 王悦 章庆国
先天性小耳畸形是仅次于唇腭裂的第二高发的颅面部出生缺陷,其在新生儿的发病率高达6.5/10 000[1]。小耳畸形可单独发生,也可出现在综合征型疾病中,非综合征型占所有小耳畸形的65%,而对其遗传机制的揭示却远不如综合征型小耳畸形[2,3]。
遗传和环境因素对小耳畸形的发生均有贡献,但研究认为排除孕期用药和接触致畸剂外,遗传因素对该病的发生起主要贡献[4~6]。全基因组关联研究已经证实神经嵴细胞发育异常是导致半侧颜面短小(小耳畸形为其代表表型)的重要病因[7]。目前小耳畸形的发病机制主要有“神经嵴细胞扰乱”和“局部缺血”假说,最新研究表明神经嵴细胞发育异常在小耳畸形的发病中起关键作用[4]。神经嵴细胞产生于胚胎神经管背侧,经分层、迁移至第一、二鳃弓,和间质细胞互相作用分化成为面部各个器官[8];先天性小耳畸形是由于胚胎期第一、二鳃弓发育受阻或发育异常导致的[9]。目前已鉴定的小耳畸形风险基因多为调控胚胎期发育的基因,如HOXA2、FGF3、SIX2、HMX1等[10~13],这些基因大都属于同源盒基因(homeobox gene)家族,它们是控制胚胎发育的主要基因,对器官发生和细胞分化调控起关键作用。同源盒基因家族的多个成员已被证实为小耳畸形的风险致病因素[14,15],GTF2IRD1是重要的同源盒家族成员,其编码蛋白包含5个GTF2I-样重复,每个重复包含1个HLH模体,可与其他HLH蛋白互作,作为转录调控因子调节诸多基因表达,进而影响颅面部发育。Bayarsaihan等[16]通过研究同源盒GTF2IRD1基因的产物BEN蛋白,发现其大量出现在神经管、颅面部的软骨、骨胳和软组织中,提示GTF2IRD1基因与第一、二鳃弓及其分化器官密切相关。为了探讨GTF2IRD1这一同源盒基因是否参与小耳畸形的发生,本研究采用候选基因关联研究策略对328例小耳畸形患者和500例健康人进行分析比较,以发掘更多的小耳畸形风险基因,为进一步揭示小耳畸形遗传病因提供依据。
1 资料与方法
1.1研究对象及分组 以2015~2017年张家口市妇幼保健院以及中国医学科学院整形外科医院诊治的328例8岁左右小耳畸形患者(患者组)和500例30岁左右健康人群对照样本(对照组)为研究对象,所有对象在3代内无亲缘关系。小耳畸形表型鉴定采用Nagata分型标准,包括:耳甲腔型82例,腊肠型201例,耳垂型45例;其中,男246例(75%),女82例,右侧197例(60%),左侧131例。
1.2标签SNP(单核苷酸多态性)位点挑选 下载千人基因组计划数据库(https://www.ncbi.nlm.nih.gov/variation/tools/1000genomes/)汉族人群(CHB)的GTF2IRD1基因以及上下游各10 kb内所有变异位点。由于小耳畸形为罕见病,故在挑选标签SNP时仅保留了最小等位基因频率>0.01的常见变异位点。使用Haploview软件[17]挑选标签SNP,具体参数为:r2阈值为0.6,多位点检验LOD阈值为3.0,最后挑选了4个变异位点作为标签SNP,分别为rs3735504、rs519462、rs571514、rs13244286。
1.3基因分型 两组每例对象采取静脉血2 ml,使用天根公司的全血DNA提取试剂盒完成DNA提取,使用Nanodrop对DNA质量进行检测。使用飞行质谱(Sequenom)法完成挑选的4个SNPs的基因分型,该工作由北京康普森生物技术有限公司完成,分型工作严格按照标准实验流程进行。
1.4数据分析 对于4个位点所有样本的基因型,患者组和对照组中并未发现丢失率有显著差异,同时对对照样本进行Hardy-Weinberg检验后未发现P<0.05的位点,提示样本为随机采样所得。使用plink软件对所有位点进行logistic检验,并对性别和年龄以及地理来源(按照南北人群分)进行了校正[18]。多重检验校正采用Bonferroni检验;采用Haploview构建连锁不平衡区块。使用SHAPEIT进行单体型构建,并采用Impute2进行基因组填充(使用千人基因组计划中的汉族人群作为背景)[19],仅保留填充后Info值>0.5的变异位点,然后使用SNPtest进行关联分析,关联分析时同样使用性别和年龄以及地理来源(按照南北人群分[18])作为协变量对关联结果进行校正。使用Seattleseq对所有变异位点进行功能注释,使用GTEx对显著关联的变异位点进行基因表达分析。原位杂交结果来源于MGI(Mouse Genome Informatics)数据库。
2 结果
经飞行质谱法对患者组和对照组GTF2IRD1基因的4个位点进行基因分型,位点分型成功率>97.2%,且这4个位点的对照数据均不背离Hardy-Weinberg平衡检验,因此将4个位点全部纳入后续的关联研究。关联分析后发现4个位点的P值均小于0.05,且rs13244286(P=0.0 007 097,OR=1.66)的P值经校正后仍然显著(表1)。该位点位于GTF2IRD1基因编码HLH模体的第22和23外显子中间的内含子上。
为了进一步揭示GTF2IRD1基因的单体型与小耳畸形之间的关联性,本研究构建了连锁不平衡区块(图1),可见,除rs13244286外,其它三个位点落入同一个连锁不平衡区块内。构建这4个位点的单体型并进行关联分析,发现GAGA单体型和小耳畸形显著关联(P=0.002 6, Perm-P=0.007 8)(表2)。以千人基因组计划的中国人群数据作为背景信息,使用基因组填充的方法推测出GTF2IRD1基因内另外12个SNP位点的基因型信息,然后对这所有16个(4个检测加上12个推测)变异位点进行关联分析发现,除rs13244286外,又有3个SNP位点(rs13246861、rs34158545、rs73137122)与小耳畸形显著关联 (表3);该结果进一步证实了GTF2IRD1基因与小耳畸形显著相关。利用软件对上述4个显著关联的变异位点进行基因注释,发现这4个位点均落于GTF2IRD1基因的内含子内。

表1 GTF2IRD1基因内4个标签SNP和小耳畸形的关联分析结果
注:SNP:单核苷酸多态性;HWE:Hardy-Weinberg检验;OR:比值比
为了进一步了解上述4个SNP位点如何影响GTF2IRD1基因功能进而与小耳畸形相关联,本研究将他们提交至表型和组织特异性表达数据库(genotype and tissue-specific gene expression,GTEx),该数据库并未记录这4个位点在特异性器官内是否为eQTL位点,但GTF2IRD1在肌肉和骨骼组织高表达,提示该基因仍可能与颌面部骨骼肌肉发育相关(图2)。考虑到GTF2IRD1可能在胚胎早期影响器官发育,本研究考察了该基因的小鼠胚胎原位杂交结果,发现其在胚胎期特别是在胚胎中晚期各器官分化过程中高度表达(图3),这与颌面部器官分化发生在胚胎发育中后期相吻合。
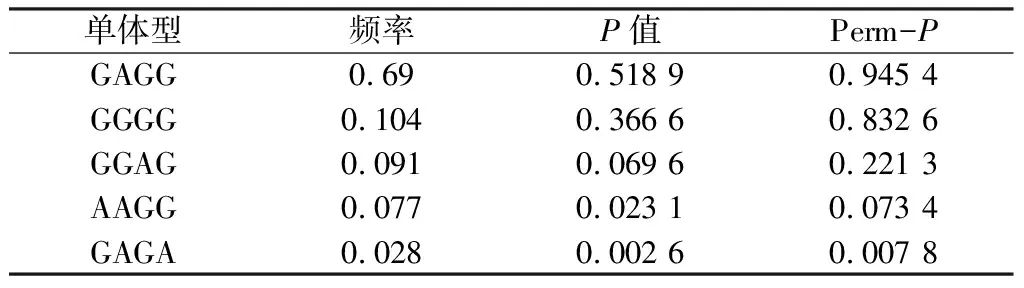
表2 GTF2IRD1基因内4个SNP位点构建的单体型以及和小耳畸形的关联分析结果
注:Perm-P:经过10 000个置换检验后获得的P值
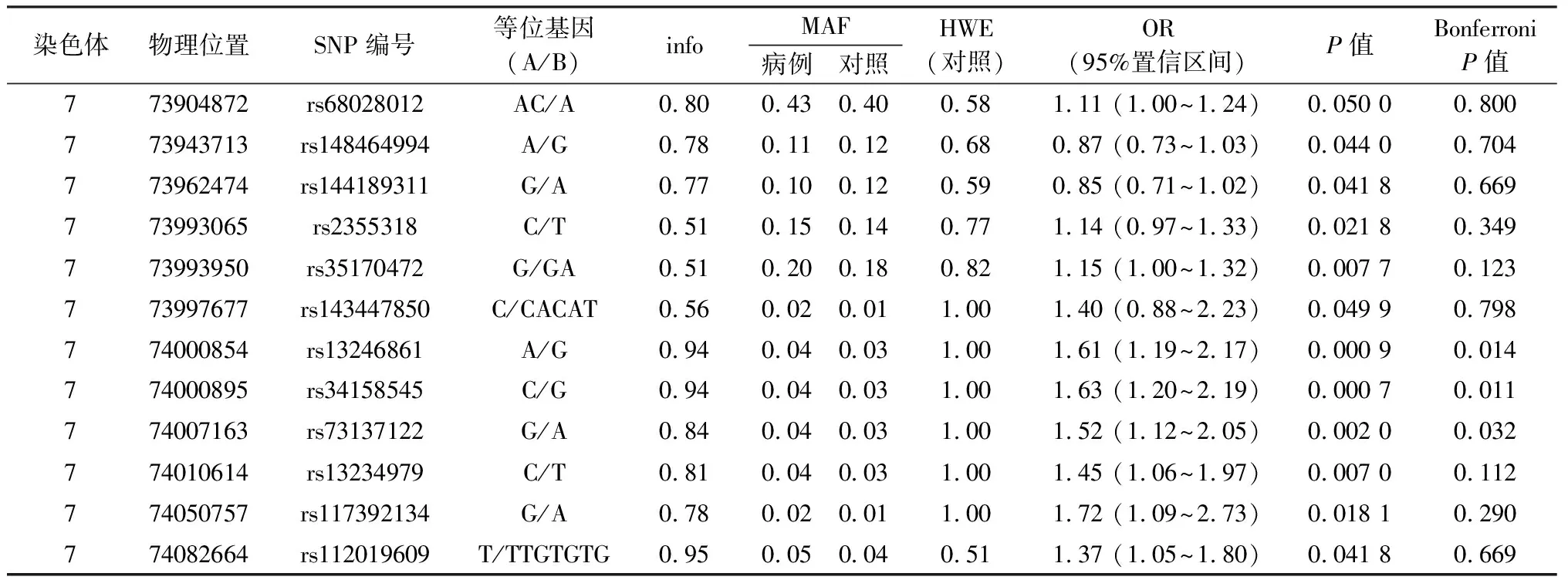
表3 基因组填充后的GTF2IRD1基因内的SNP位点和小耳畸形关联分析结果
注:SNP:单核苷酸多态性;info:基因组填充后的可信值,越接近1越可信;MAF:最小等位基因频率;HWE:Hardy-Weinberg平衡检验P值;BonferroniP值,经过Bonferroni多重检验校正的P值。
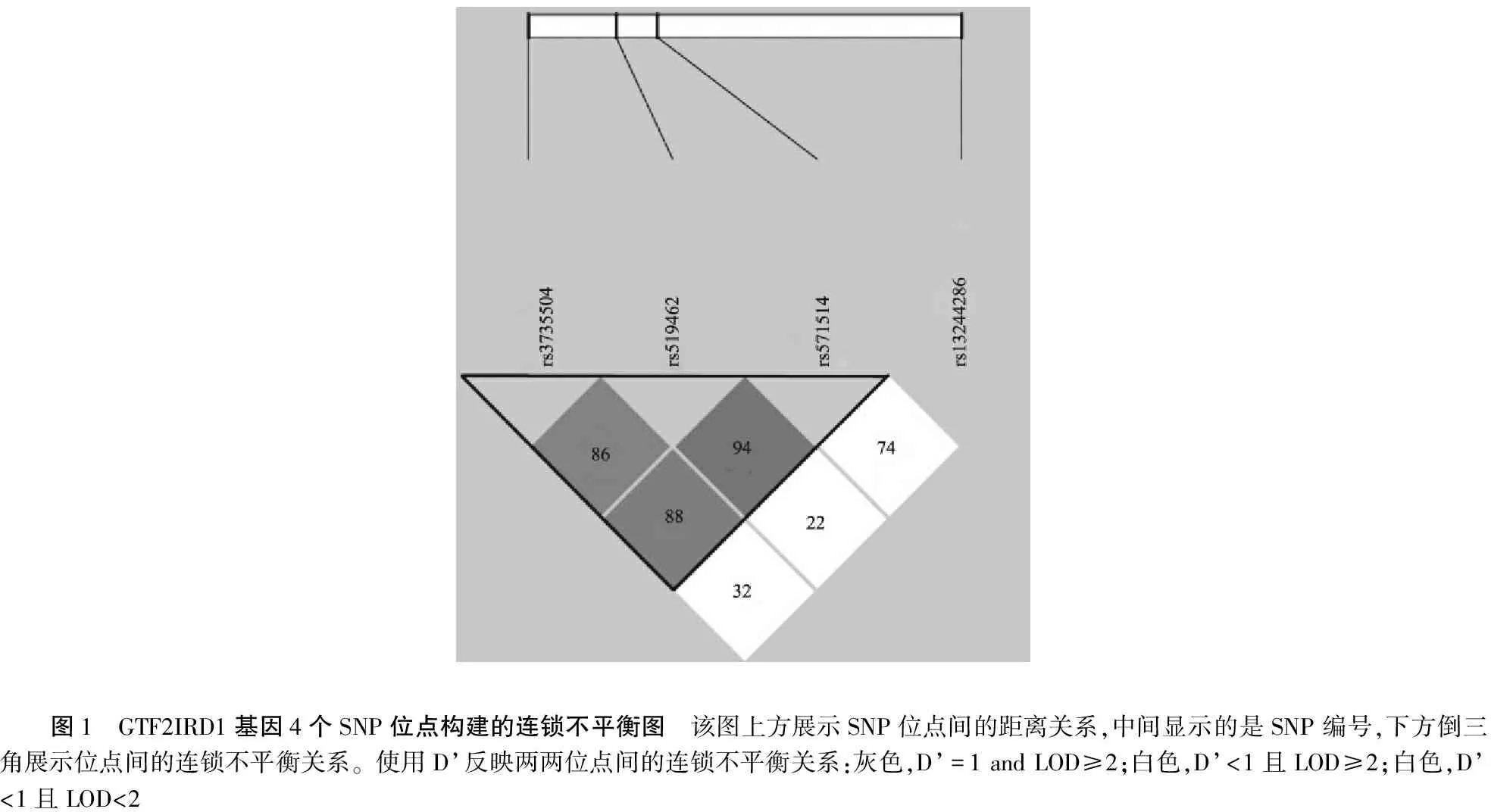
图1 GTF2IRD1基因4个SNP位点构建的连锁不平衡图 该图上方展示SNP位点间的距离关系,中间显示的是SNP编号,下方倒三角展示位点间的连锁不平衡关系。使用D’反映两两位点间的连锁不平衡关系:灰色,D’=1 and LOD≥2;白色,D’<1且LOD≥2;白色,D’<1且LOD<2
3 讨论
小耳畸形在我国高发,但对其遗传机制的研究仍处于早期阶段,目前仅明确证实4p16.2及HOXA2基因与非综合征型小耳畸形相关[12,13,15,20],其他基因,如:HMX1、FGF3等与综合征型小耳畸形相关[11,21,22]。目前公认与颅面部发育畸形相关的基因主要来自同源盒基因家族,动物模型显示该家族成员如Hoxa1、Hoxb1、Six1、Six4等突变可导致颅面畸形,甚至出现小耳畸形[4]。郝少娟等[23]应用Affymetrix SNP 6.0芯片技术筛选出5个先天性小耳畸形的候选致病基因,其中4个基因MSX1、MSX2、GSC和HOXA2 均为同源盒家族基因。GTF2IRD1也是重要的同源盒家族成员,本研究通过候选基因关联分析对GTF2IRD1基因和小耳畸形进行关联研究,发现多个变异位点与国人小耳畸形显著相关。
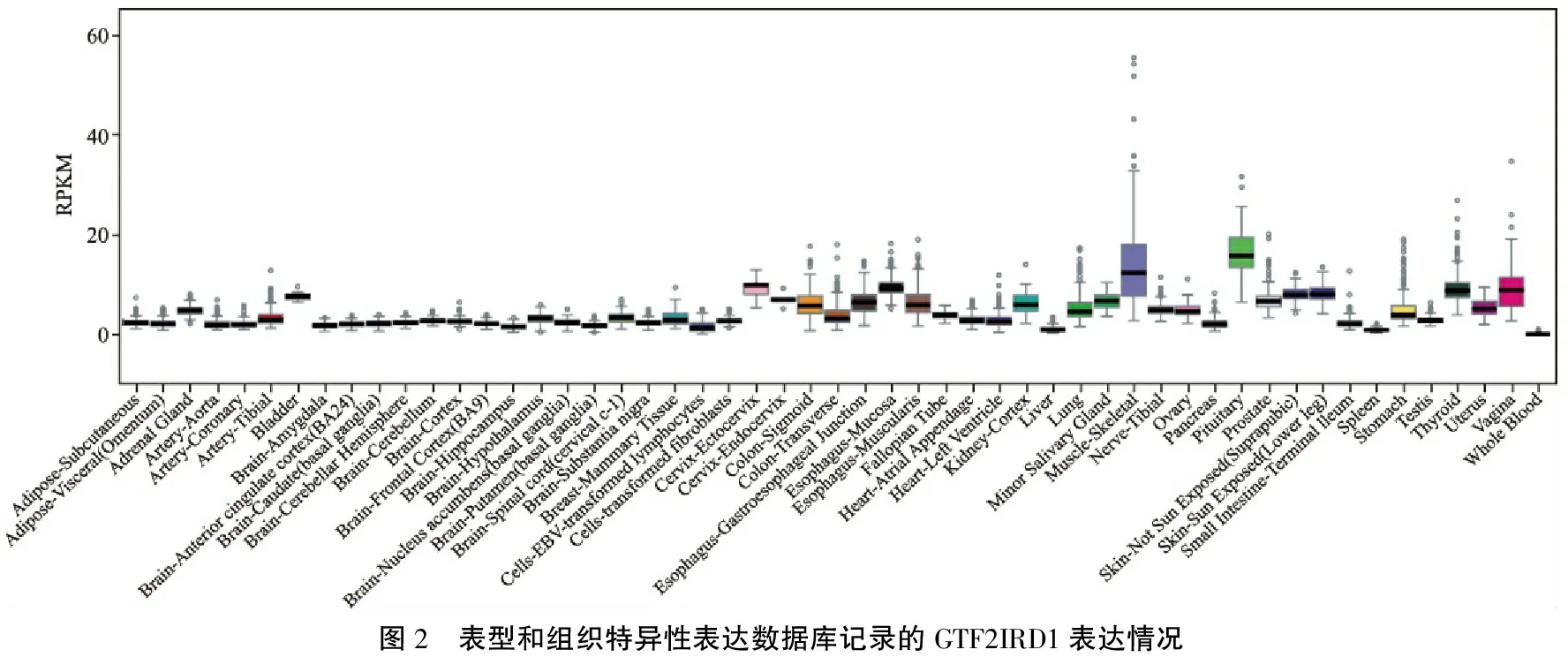
图2 表型和组织特异性表达数据库记录的GTF2IRD1表达情况

图3 GTF2IRD1在小鼠胚胎期以及各胚层和分化器官内的表达情况 该图左侧显示的是小鼠胚胎分化的各个结构组织,上方显示的是小鼠不同胚胎发育阶段,如TS1 E0~2.5代表胚胎发育的第1个Theiler期即第0~2.5天。方框内显示的是各阶段GTF2IRD1基因的表达量,白色表示该阶段无该组织结构,方框内带圆圈表示对应组织器官该阶段无数据,蓝色代表基因表达,红色表示基因不表达,颜色的深浅反映表达量的高低
本研究通过飞行质谱法检测患者组和对照组的基因分型,关联研究所发现的1个显著关联的变异位点位于GTF2IRD1的第22和23外显子中间的内含子上,而与该内含子相邻的外显子均参与HLH模体,因此推测和这个显著关联位点共连锁的致病突变可能位于编码HLH模体的DNA序列内,它(它们)可导致HLH模体功能异常,进而导致颅面部畸形。研究发现[24]敲除GTF2IRD1基因后,小鼠颅面部成像显示颅骨和颌骨都出现异常,并发现GTF2IRD1基因下游靶点Goosecoid的调控出现失调,说明GTF2IRD1是哺乳动物颅面和认知发育的遗传决定因子;Canales等[25]研究表明GTF2IRD1突变可导致Williams-Beuren综合征,特征表型为血管、颌面部骨骼以及神经发育异常;Howard等[26]构建GTF2IRD1基因敲除小鼠模型后发现突变小鼠的表型与Williams-Beuren综合征表型相似,如:颅面骨胳畸形、耳发育畸形等;其他动物模型研究同样发现GTF2IRD1敲除小鼠模型出现鳃弓畸形、颅面部不对称发育、耳发育异常等表型[27,28];这些证据均提示GTF2IRD1突变可能是导致耳发育畸形的病因之一。
本研究通过对同源盒基因GTF2IRD1与小耳畸形关联分析后发现了1个显著关联位点rs13244286,并利用Impute2进行基因组填充后分析又发现3个位点与小耳畸形显著相关(BonferroniP<0.05)。通过eQTL分析后发现他们均不参与基因表达调控,且这4个位点位于GTF2IRD1基因的HLH模体附近,推测和关联位点连锁的致病突变可能位于编码HLH模体的DNA序列上。采用基因测序的手段挖掘对应DNA序列的致病突变将是后期对GTF2IRD1基因研究的重点,同时在更大样本中验证本研究结果并挖掘新的致病突变,进而阐明致病突变导致小耳畸形发生的机制也是今后的研究方向。
