糖肾平对糖尿病肾病大鼠足细胞凋亡及PI3K/AKT信号通路的影响*
2019-01-18王颖超刘运华张丰丰赵宗江
王颖超,刘运华,张丰丰,赵 敬,杨 敏**,赵宗江**
(1. 北京航天总医院 北京 100007;2. 北京中医药大学中医学院 北京 100029;3. 中国实验方剂学杂志 北京 100700)
据一项权威的流行病学调查报告显示,我国糖尿病(Diabetes Mellitus,DM)患者的总数高达1.14 亿之多,已经达到了世界的糖尿病患者总人数的1/3[1],DM对人类健康的危害和世界经济造成的损失不亚于脑血管疾病、恶性肿瘤。 糖尿病肾病(Diabetic nephropathy,DN)是DM 长期损害机体伴发的一种严重并发症,随着病情的进展,最终一步步恶化为终末期肾病,导致患者不得不依靠透析来维持生命[2,3]。因此,全球医学界DM 研究领的重难点之一便是DN,而深入研究DN 的发病机制,探求有效的防治的方法对于攻克DN 来说,具有重要的研究意义和研究价值。病理研究显示,DN 的主要病理改变是肾间质纤维化和肾小球硬化。不少针对足细胞的研究表明,足细胞的损伤和凋亡对DN 肾小球硬化和间质纤维化病变有着至关重要的影响[4]。大量研究显示磷脂酰肌醇3 激酶/蛋白激酶B(Phosphoinositide 3 Kinese/Protein KinaseB,PI3K/AKT)信号转导通路,在体内的抗凋亡过程中发挥着举足轻重的作用,而PI3K/AKT 信号转导通路的激活又依赖于nephrin-CD2AP 复合体的作用[5]。
糖肾平在多年临床DN 的预防和治疗中展现出了显著的疗效,它是依据赵宗江教授多年来研究文献资料并在大量临床基础上提出的DN“肾痿”理论所组建的[6]。并且,我们课题组前期的实验研究证明,糖肾平能通过影响各种信号通路途径保护肾小球滤过屏障的正常功能,减轻甚至逆转足细胞的损伤,降低氧化应激反应[7-9]。因此,本实验在前期的实验基础上,进一步研究糖肾平对DN 大鼠足细胞凋亡的影响和对通过PI3K/AKT通路抗凋亡通路的机制。
1 材料
1.1 动物
74 只清洁级雄性Wistar 品种大鼠,体重(200 ±20)g,购自北京华阜康生物股份有限责任公司(许可证编号:SCXK京2009-0007)。
1.2 药物及试剂
厄贝沙坦片(杭州赛诺菲安万特民生制药有限公司,批号:J20080061);糖肾平(组成:生黄芪6 g、水蛭2 g、山萸肉2 g、熟地黄3 g、地骨皮3 g、丹皮3 g,批号:2006008,北京中医药大学中药学院制剂室制备);链脲佐菌素(批号:S0130,Sigma 公司);细胞凋亡检测试剂盒(批号:1168481791,中杉金桥公司);胰蛋白酶(批号:41500-067,Gibco 公司);DAB(批号:CW0125A,康为世纪生物科技有限公司);Triton(批号:9002-93-1,Sigma);PI3K(批号:2382072,Monoclonal 公司);AKT(产品批号:4691,Cell Signaling Technology 公司);Bad(批 号:ab62465,Abcam Technology 公司);山羊血清封闭液(批号:120312,中杉金桥公司);GFVisionTM Ⅱ抗(批号:2013102801,上海基因科技有限公司);A3500(批号:00000541604,Promega公司);Marker(批号:071513,赛百盛基因技术有限公司)。
1.3 仪器
普通显微镜(日本Olympus 公司,型号L340099),电热恒温培养箱20-60℃(湖北省黄石市医疗器械厂,型号skp-01),凝胶成像系统(美国Bio-Rad公司,型号Gel Doc XR+),PCR 仪(美国Bio-Rad 公司,型号T100),电源(美国Bio-Rad 公司,型号041BR111842),Image J图像分析软件。
2 方法
2.1 动物模型制备与分组
适应性喂养购买的74只Wistar大鼠1周,根据体质量按照随机数字表法分为10只正常组和64只造模组。通过多次预实验最终确立STZ 的注射剂量为45 mg·kg-1,按照此用药标准对大鼠进行一次性腹腔注射链脲佐菌素(用柠檬酸缓冲液配STZ 为1%的溶液,放置在冰上用铝箔纸遮盖避光,时间不超过30 min),建立DKD 动物模型。72 h 后分别采取尾静脉取血法和代谢笼法检测大鼠血糖和尿糖,以血糖≥16.7 mmol·L-1和尿糖4 个“+”为糖尿病大鼠造模的成功标准[5]。然后把造模成功的大鼠再按照每组16 只得标准随机分为模型组、厄贝沙坦组、糖肾平小剂量组和糖肾平大剂量组。按照人临床用药剂量和1 mL/100 g体质量系数标准换算灌胃药量,确立糖肾平小剂量组0.525 g·kg-1、大剂量组2.1 g·kg-1和厄贝沙坦组17.5 mg·kg-1的标准每日灌胃,模型组给与等量生理盐水,全部大鼠均按每笼不超过6 只得标准分笼饲养在洁净动物橱,采用普通大鼠饲料喂养,用标准水瓶给予饮水,每日更换木质垫料及打扫洁净动物房。
2.2 观察指标及测定
2.2.1 一般情况
每天按时观察并且记录大鼠的精神状态、毛发色彩和光泽度、饮食饮水量大小的变化以及二便及活动情况等,每周一对大鼠进行体质量测定。
2.2.2 TUNEL染色
从-20℃取出切片,4℃30 min,室温30 min;常规脱蜡至水,同HE 染色,0.5%胰蛋白酶37°C 40 min,滴加TUNEL 37°C 80 min;(阴性对照组:加50 μL 荧光素标记的dUTP 液即试剂2;阳性对照组:加反应混合液。试剂1∶试剂2 = 1∶20;现配现用),滴 加50 μL converter-POD 37℃50 min;DAB显色,苏木素复染2 min,常规脱水,中性树胶封片。
2.2.3 免疫组化检测大鼠肾组织中PI3K、AKT、Bad蛋白表达情况
取4℃保存的石蜡切片,复温半小时后石蜡切片常规脱蜡至水,Triton、CH3OH-H2O2分别孵育10 min;使用微波炉进行抗原修复;蛋清、山羊血清进行封闭,滴加稀释好的一抗(WT-1 浓度为1∶200,PI3K 浓度为1∶100,AKT 浓度为1∶200,Bad 浓度为1∶1200,阴性对照组加PBS),把湿盒放于冰箱中4℃过夜,第二日复温后滴加HRP标记二抗,纱布擦干后DAB显色3 min,在苏木素染缸中复染后流水冲洗返蓝10 min,最后中性树胶封片。
2.2.4 大鼠肾组织PI3K、AKT、Bad、CD2AP 及nephrin mRNA的表达
RT-PCR 检测上述指标的mRNA 的表达,引物序列见表1。

表1 引物序列表
2.4 统计学分析
免疫组化用Image-pro Plus 6.0 图像分析软件分析,在40 倍物镜下,每组记数20 个肾小球内足细胞数目,取平均数;TUNEL 染计数每张图片中阳性细胞数及总细胞数,计算调亡百分率(Apoptotic index,AI)=阳性细胞数/总细胞数并进行统计分析。RT-PCR 实验重复3 次,用ImageJ 图像分析软件,进行图像分析。所有统计用均采用SPSS22.0 软件进行数据处理,计量资料以±s表示;采χ2 检验,P<0.05 为差异具有统计学意义。
3 结果
3.1 大鼠的一般状况
对大鼠进行STZ 腹腔注射72 h 后,模型组大鼠开始逐渐有多饮、多食、多尿、形体消瘦的变化,模型组在第6周后体重明显下降、皮毛干枯并且动作迟缓;部分大鼠还出现了尿路感染、白内障等多种糖尿病并发症。到14 周末取材为止共死亡5 只大鼠,治疗组大鼠的一般状态均有不同程度的改善。
3.2 糖肾平对STZ 诱导的DN 大鼠肾小球细胞凋亡的影响
通过TUNEL检测计算细胞凋亡率进行分析,结果发现正常组肾小球内细胞调亡较少;与正常组相比,模型组细胞调亡率明显增加,有显著性差异(P<0.01)。厄贝沙坦组及糖肾平治疗组的细胞调亡率与模型组相比显著降低(P<0.01)(表2,图1,图2)。与正常组相比,模型组肾小球足细胞数目明显减少(P<0.01);而经过厄贝沙坦组及糖肾平,厄贝沙坦组及糖肾平治疗组足细胞数量明显增加(表2,图1,图2)。
表2 糖肾平对STZ诱导DKD大鼠肾小球细胞凋亡率的影响(AI,±s)
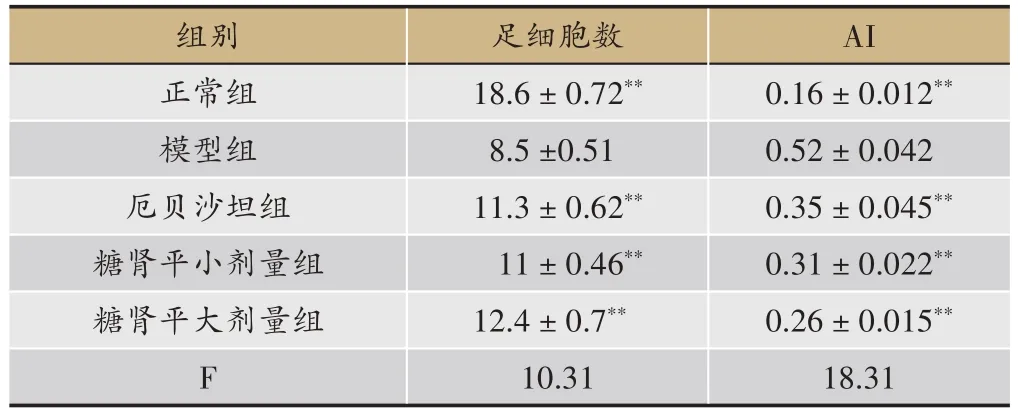
表2 糖肾平对STZ诱导DKD大鼠肾小球细胞凋亡率的影响(AI,±s)
注:与模型组比较,*P <0.05,**P <0.01。
组别正常组模型组厄贝沙坦组糖肾平小剂量组糖肾平大剂量组F足细胞数18.6±0.72**8.5±0.51 11.3±0.62**11±0.46**12.4±0.7**10.31 AI 0.16±0.012**0.52±0.042 0.35±0.045**0.31±0.022**0.26±0.015**18.31
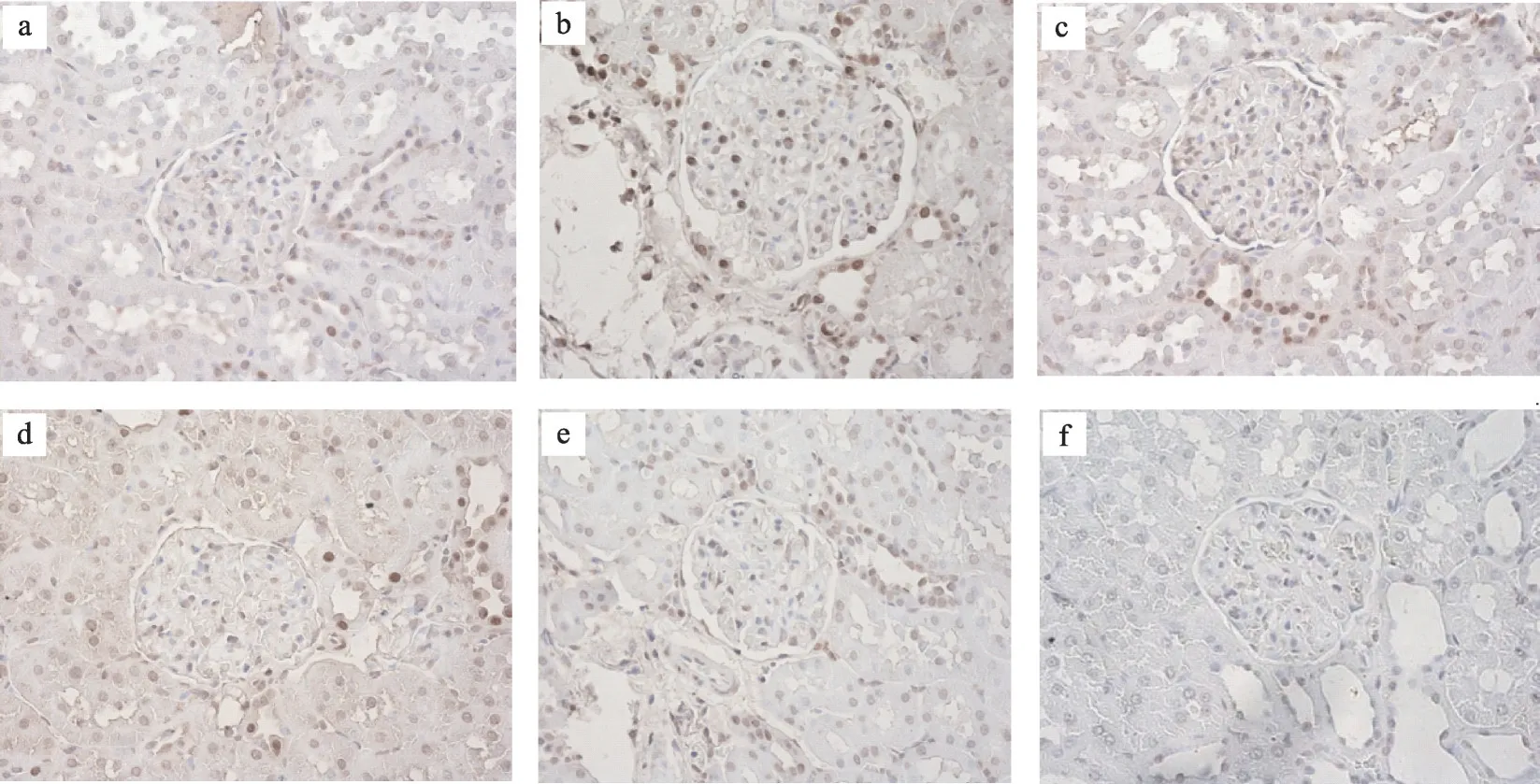
图1 肾组织TUNEL染色(TUNEL×400)
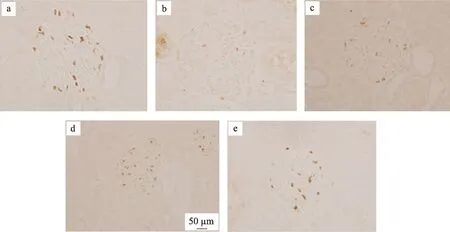
图2 肾组织免疫组化WT-1蛋白表达(IHC×400)
3.3 糖肾平对STZ 诱导的DN 大鼠肾组织中PI3K、AKT、Bad蛋白表达的影响
正常组大鼠的肾小球内PI3K、AKT 表达较多,Bad蛋白表达减少与模型组相比有统计学差异(P<0.01),厄贝沙坦组、糖肾平大剂量组PI3K 蛋白表达增多,糖肾平大剂量组AKT 蛋白表达增多,与模型组相比具有显著统计学差异(P<0.01),糖肾平小剂量组PI3K、AKT 蛋白表达增多有统计学差异(P<0.05)与模型组比较,厄贝沙坦组及糖肾平各治疗组Bad 蛋白表达明显减少(P<0.01)(表3,图3,图4,图5)。
表3 糖肾平对STZ诱导DKD大鼠肾组织AKT、PI3K、Bad的影响(OD,±s)
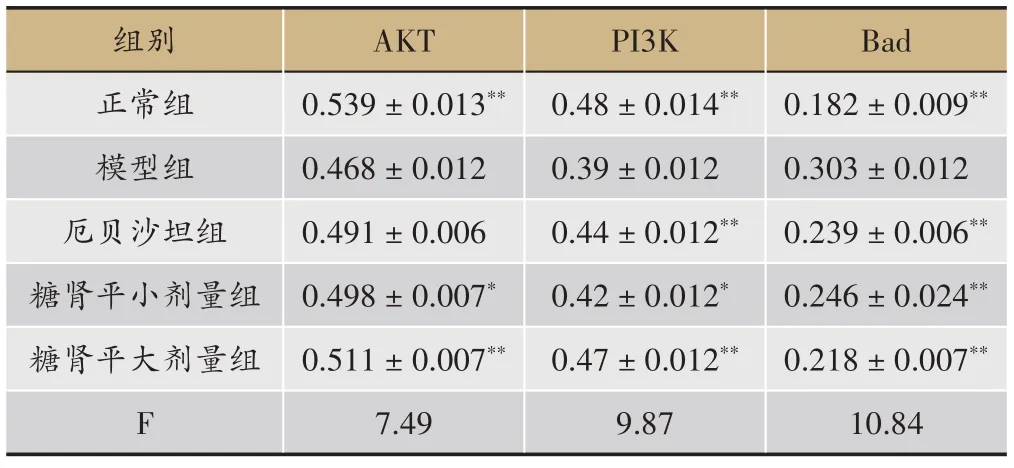
表3 糖肾平对STZ诱导DKD大鼠肾组织AKT、PI3K、Bad的影响(OD,±s)
注:与模型组比较,*P <0.05,**P <0.01。a 正常组;b 模型组;c 厄贝沙坦组;d 糖肾平小剂量组;e 糖肾平大剂量组;f阴性对照组
组别正常组模型组厄贝沙坦组糖肾平小剂量组糖肾平大剂量组F AKT 0.539±0.013**0.468±0.012 0.491±0.006 0.498±0.007*0.511±0.007**7.49 PI3K 0.48±0.014**0.39±0.012 0.44±0.012**0.42±0.012*0.47±0.012**9.87 Bad 0.182±0.009**0.303±0.012 0.239±0.006**0.246±0.024**0.218±0.007**10.84
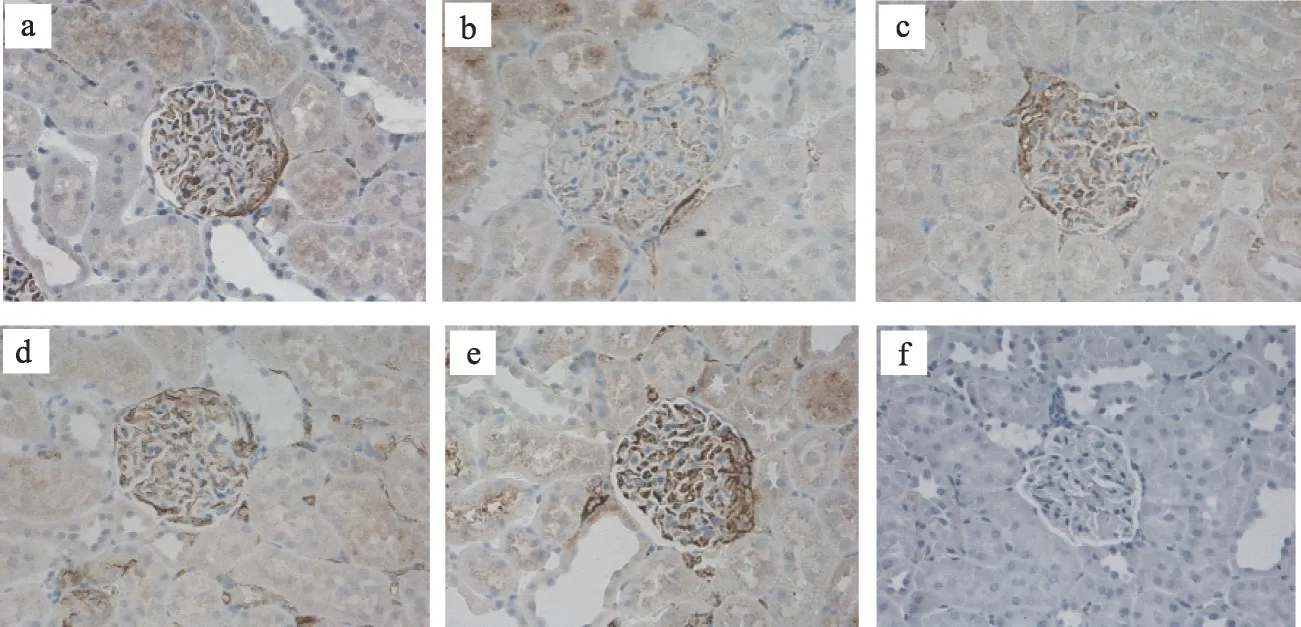
图3 肾组织免疫组化PI3K蛋白表达(IHC×400)

图4 肾组织免疫组化AKT蛋白表达(IHC×400)

图5 肾组织免疫组化Bad蛋白表达(IHC×400)
3.4 糖肾平对STZ 诱导的DN 大鼠肾组织中nephrin、CD2AP、PI3K、AKT、BadmRNA表达的影响
正常大鼠肾组织中CD2AP、nephrin、PI3K、AKTmRNA呈高表达,而BadmRNA 少量表达;DN 大鼠肾组织中CD2AP、nephrin、PI3K、AKTmRNA 表达明显减少(P<0.01),BadmRNA 表达明显升高(P<0.01)。与模型组相比,厄贝沙坦组肾组织中CD2AP、nephrinmRNA表达增多(P<0.01,P<0.05);PI3K、AKTmRNA 表达增多(P<0.05);BadmRNA 表达明显减少(P<
0.01)。与模型组相比,糖肾平大剂量组肾组织中CD2AP、nephrin、AKTmRNA 表达增多(P<0.01);BadmRNA 表达明显减少(P<0.01);PI3KmRNA 表达增多但无明显统计学差异。糖肾平小剂量组肾组织 中CD2AP、AKT、nephrin、PI3K mRNA 表 达 增 多(P<0.05),BadmRNA 表达明显减少(P<0.01)(表4,表5,图6)。
表4 糖肾平对STZ诱导DKD大鼠肾组织CD2AP、nephrin mRNA表达的影响(±s,n = 3)
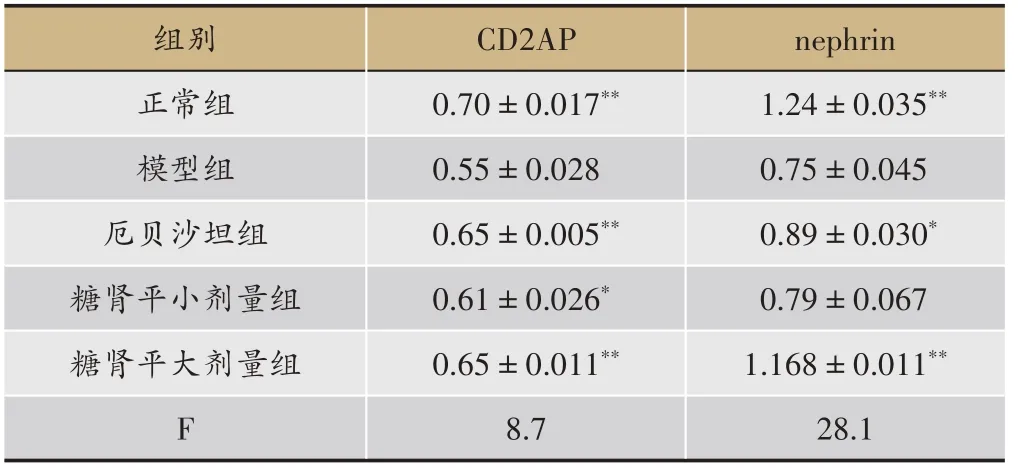
表4 糖肾平对STZ诱导DKD大鼠肾组织CD2AP、nephrin mRNA表达的影响(±s,n = 3)
注:与模型组比较,*P <0.05,**P <0.01。
nephrin 1.24±0.035**0.75±0.045 0.89±0.030*0.79±0.067 1.168±0.011**28.1组别正常组模型组厄贝沙坦组糖肾平小剂量组糖肾平大剂量组F CD2AP 0.70±0.017**0.55±0.028 0.65±0.005**0.61±0.026*0.65±0.011**8.7
表5 糖肾平对DKD大鼠肾组织AKT、PI3K、BadmRNA表达的影响(±s,n = 3)

表5 糖肾平对DKD大鼠肾组织AKT、PI3K、BadmRNA表达的影响(±s,n = 3)
注:与模型组比较,*P <0.05,**P <0.01。
Bad 0.83±0.024**1.10±0.045 0.93±0.025**0.93±0.021**0.87±0.028**12.2组别正常组模型组厄贝沙坦组糖肾平小剂量组糖肾平大剂量组F AKT 0.76±0.038**0.49±0.050 0.65±0.060*0.62±0.024*0.70±0.039**5.59 PI3K 1.22±0.124**0.73±0.031 0.99±0.026*0.89±0.081 0.90±0.093 5.14

图6 大鼠肾组织中CD2AP、nephrin、AKT、PI3K、Bad mRNA电泳图
4 讨论
在我国经济迅猛发展、人口老龄化的社会趋势影响下,DM 的发病率年年攀升。目前,我国成年人中DM 患者约占7%,总人数高达0.92 亿[10]。DN 是DM 最为常见的并发症,它是严重威胁人类健康慢性疾病之一,往往最终进展为回天乏术的终末期肾病[11]。DN 最为主要的病理改变是肾小球硬化和肾间质纤维化,而足细胞(podocyte)主要有维持肾小球滤过膜结构和功能正常的作用,在DN的发病中起着关键的作用,当足细胞受到高糖和炎症等的刺激,便会发生形态的改变,甚至发生凋亡脱落,从而对肾小球的正常功能造成不可挽救的损害。PI3K/AKT信号转导通路参与足细胞生长、分化、凋亡的调控[12],研究表明,足细胞裂孔蛋白CD2AP和nephrin复合体可以与PI3K-P85亚基结合,参与并激活PI3K/AKT 依赖的信号转导途径,调控足细胞的凋亡[13,14]。
糖尿病肾病归属于中医“水肿”、“尿浊”、“关格”、“腰痛”、“肾消”和“消渴肾病”范畴。DN 的基本病机是本虚标实,以气阴两虚、精气亏耗、阴阳两虚为本虚,以燥热内生、水湿潴留、湿浊瘀毒为标实,病位在肾可累及肝、脾。DM 日久不愈,耗损机体气血津液,“久病多虚”可见DN的发病是以虚为本[15]。DN久病不愈,外热、郁、痰湿、瘀血、毒邪相互胶结于肾脏,导致肾脏的正常生理功能损失,大量的有害物质聚集在肾组织内,长此以往,肾脏废萎不用,即发为“肾萎”。肾萎不用,导致水湿、湿浊、瘀毒内阻,阻碍肾脏气血运行,日久更甚,失去固摄精微的能力,因此出现蛋白尿。DN 不同时期的病理是不同的,早期正气不足,邪气稽留,瘀血阻滞,邪气与浊毒凝集,形成癥瘕积聚肾内,从而可见肾脏体积增大;中晚期,癥瘕日久,瘀血浊毒不断损伤肾脏的正常生理结构,从而发生肾小球硬化和肾间质纤维化,最终可发为终末期肾病。糖肾平是在“肾萎”假说指导下,按照君臣佐使组方的复方。方中君药黄芪能够利尿消肿、补中益气、固摄精微;臣药熟地黄和山萸肉能够补肝滋肾和益气生津;佐药丹皮和地骨皮共奏活血化瘀和清退蓄热,使药水蛭起破血消癥之功。全方以滋补肝肾、益气固精为主,以活血化瘀通肾络为辅,其特色为补而不滞,祛瘀而不伤正。祛瘀毒的同时不伤正气,瘀去浊降除宿根,使气阴充养,助脾气、肾精的化生,适宜于治疗DN之气阴两伤、瘀血阻络、精微下泄等症。糖肾平在多年临床和实验上都展现出了对DN 的显著疗效[16,17],大量组织细胞分子生物实验研究证实,糖肾平能够显著降低DN 大鼠24 h尿蛋白量,改善DN 大鼠的氧化应激状态,缓解DN 大鼠肾脏的病理改变,抵抗足细胞的损伤和凋亡[9]。
PI3K/AKT 信号通路是参与调控细胞生长和凋亡的关键通路之一,而磷脂酰肌醇3- 激酶(phosphatidylinositol 3-kinase,PI3K)为该通路的关键细胞因子,它具有磷脂酰肌醇激酶和丝氨酸/苏氨酸蛋白激酶的双重活性,PI3K 被激活后会转变成第二信使PIP3,PIP3 接着又会把AKT[18]活化为p-AKT,而p-AKT 又可以通过阻断凋亡分子Bad 与Bcl-2/Bcl-xL 的结合从而抑制细胞凋亡的发生[19]。本实验通过TUNEL检测到糖肾平可降低肾小球中细胞凋亡率,维持足细胞正常生理;免疫组化和RT-PCR结果同时表明,糖肾平能明显增加大鼠肾组织中CD2AP、nephrin、PI3K、AKT 的蛋白和mRNA 表达,降低Bad 蛋白和mRNA 表达。除此之外,本课题组还应用Western blot方法测定了离体培养的足细胞的相关蛋白,发现糖肾平可以维持足细胞裂孔隔膜蛋白稳定蛋表达,保护肾小球滤过屏障,同时进一步激活PI3K/AKT 信号通路,抑制足细胞凋亡,相关结果已发表[20]。
综上,糖肾平可能通过保护足细胞胞裂孔蛋白,维持足细胞正常的形态和功能,进而保持完整的肾小球滤过屏障,减轻蛋白尿的症状,并进一步激活PI3K/AKT 信号转导通路,从而抑制了足细胞凋亡,减轻肾脏损伤、减轻肾纤维化。
