生物转化的人参皂苷F2分离及其结构鉴定
2019-01-07何丹
何丹
辽宁农业职业技术学院,辽宁 营口 115009
引言
人参皂苷是药材人参的最重要的活性成分之一,口服人参后,大多数多糖基的人参二醇类皂苷(PPD)不能被人体直接吸收,通常会在人体消化系统中的酶和肠道菌的作用下,水解掉苷元上连接的糖基生成活性更高的低糖基皂苷,例如F2和C-K等天然人参中含量极低的稀有皂苷[1]。如果在体外完成这种转化,会提高人体的利用率。因此,在体外制备人参皂苷F2对人参乃至医药行业具有重要意义。
生物转化法是一种极具潜力的方法,用此法制备低糖基的皂苷具有环境友好、副产物少、后处理简单等诸多优点。本实验室在此方面做了大量的研究,已经发现了能转化多糖基二醇类人参皂苷的微生物,还有人参皂苷酶I型、II、型、III型、IV型[2-5],其中的Ⅰ型人参皂苷酶可以水解PPD生成人参皂苷F2。本文利用Ⅰ型人参皂苷酶转化PPD生成的人参皂苷F2进行分离纯化,并利用核磁共振法鉴定其结构。
本文对用槐花诱导的sp.848菌产的人参皂苷Ⅰ型酶转化人参二醇类皂苷PPD制备的粗品人参皂苷C-K进行了分离纯化,经高效液相色谱分析产品纯度,并用核磁共振法确定了产物的结构。
1 材料与方法
1.1 材料与设备
人参皂苷标准品F2、C-K,PPD酶反应产物(主要含F2),本实验室提供;薄层层析板Silica gel 60-F254,德国Merck公司产品;AB-8树脂、D-296树脂,南开大学化工厂生产;柱层层析硅胶,青岛海洋化工厂分厂产品;高效液相色谱仪,美国Waters公司;
1.2 试验方法
1.2.1 人参皂苷F2的分离纯化
取50g脱糖脱色后的、来源于酶转化PPD的人参皂苷F2粗产品,与125倍体积的80-100目硅胶混合,制成样品胶,用900g的300-400目的硅胶作为分离胶进行分离。用V(氯仿):V(甲醇)= 9∶1的洗脱液洗脱,将相同的组分收集合并,干燥、称重。取纯度最高的F2产品进行高效液相色谱及核磁共振检测。
1.2.2 薄层层析法
用薄层层析法对皂苷进行检测,展开剂为V(氯仿):V(甲醇):V(水)=7∶2.5∶0.5,显色剂为10%的硫酸溶液,加热显色。将样品点与标准品点对照以确定样品中所含皂苷成分[6]。
1.2.3 高效液相色谱检测产品纯度
经硅胶分离得到的产品采用高效液相色谱法分析,美国Waters 2695型高效液相色谱仪、Waters 2996二极管阵列检测器、Empower2色谱工作站;色谱柱为Knauer (5 μm,250 mm×3 mm);流动相为乙腈(A)和水(B);进样量,10 μL;柱温,35℃;流速,0.6 mL/min;检测波长,203 nm。流动相比例见表1:
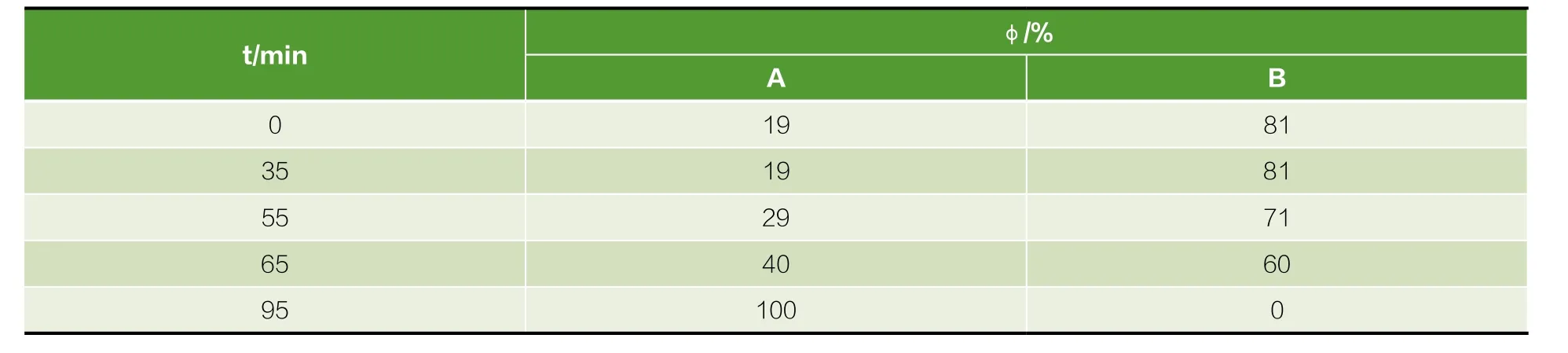
表1 流动相比例表Table 1 Rate of mobile phase
1.2.4 核磁共振法分析产品结构
采用核磁共振法检测人参皂苷F2的结构,测试仪器为瑞士Bruke AVANCE 600 超导核磁共振波谱仪,检测条件为探头5 mm BBO,溶剂为Pyridine-D5 (氘代吡啶)。
2.结果与讨论
2.1 硅胶柱层析法分离人参皂苷F2
本实验室前期已经利用豆粕诱导的sp.848菌产的人参皂苷Ⅰ型酶转化人参二醇类皂苷PPD制备了粗品人参皂苷F2。取经过脱糖脱色处理后的F2粗品50g,进行硅胶柱层析分离,得到高纯度的F2 共4.19g,得率8.38%。TLC检测结果如图1所示:

图1 硅胶分离的F2的TLC检测图Figure 1 TLC of ginsenoside F2 after separation by silica gel
从图1可以看看出,样品与F2标准品的迁移率相同,说明为同一种物质。然后采用HPLC检测样品,结果如图2所示。

图2 硅胶分离的F2的HPLC图谱Figure 2 HPLC of ginsenoside F2 after separation by silica gel
由图可知,分离得到的F2产品的纯度约为96.7%。
2.2 人参皂苷F2的结构分析
采用核磁共振法对经硅胶柱分离得到的纯品进行结构鉴定。其一维13C核磁共振谱(13C NMR)如图3所示:

图3 样品F2的一维13C NNE核磁共振谱全图Fig. 3 13C NNE NMR full Score of F2
根据一维13C核磁共振谱图分析:从一维13C NMR定量谱中可以观察到42条谱线,谱线无重叠。积分面积为原子个数相对比,故由相对积分面积可知,该样品中含有42个碳原子。烯碳区(δ 120~130 ppm)的两条谱线是由2个烯碳所贡献的,说明化合物中含有-CH=C<独立双键结构。氧碳区(δ 60~110 ppm)共有15条谱线,是由人参皂苷中与氧相连的碳所贡献的,此区应该有1个季碳,2个-CH2-质子碳和12个>CH-质子碳。其中,最低场的δ 107.10 ppm位移峰应归属于3-O-Glc上的第1’号碳,δ 98.42 ppm位移峰归应属于20-O-Glc上的第1’号碳,这两个位移峰由于受到糖苷键的影响而落到此处。位于氧碳区最高场的δ 63.04 ppm、δ 63.24 ppm位移峰应分别归属于20-O-Glc上的第6’号碳和3-O-Glc上的第6’号碳所贡献。氧碳区最低场的δ 107.10 ppm、δ 98.42 ppm位移峰应分别归属于3-O-Glc上的第1’号碳和20-O-Glc上的第1’号碳所贡献。人参皂苷元为饱和四环式结构,化学位移值相差很小,甲基位移十分相近。通过对比13C NMR谱该区域(δ 0~110 ppm)各位移峰的化学位移和文献[7]中的数据,确定了样品F2结构中1~30号碳的化学位移。如表3所示。从表3中可以看出,第22号碳化学位移落在δ 36.31 ppm、第21号碳化学位移落在δ 25.95 ppm,说明该化合物为20(S)构型。
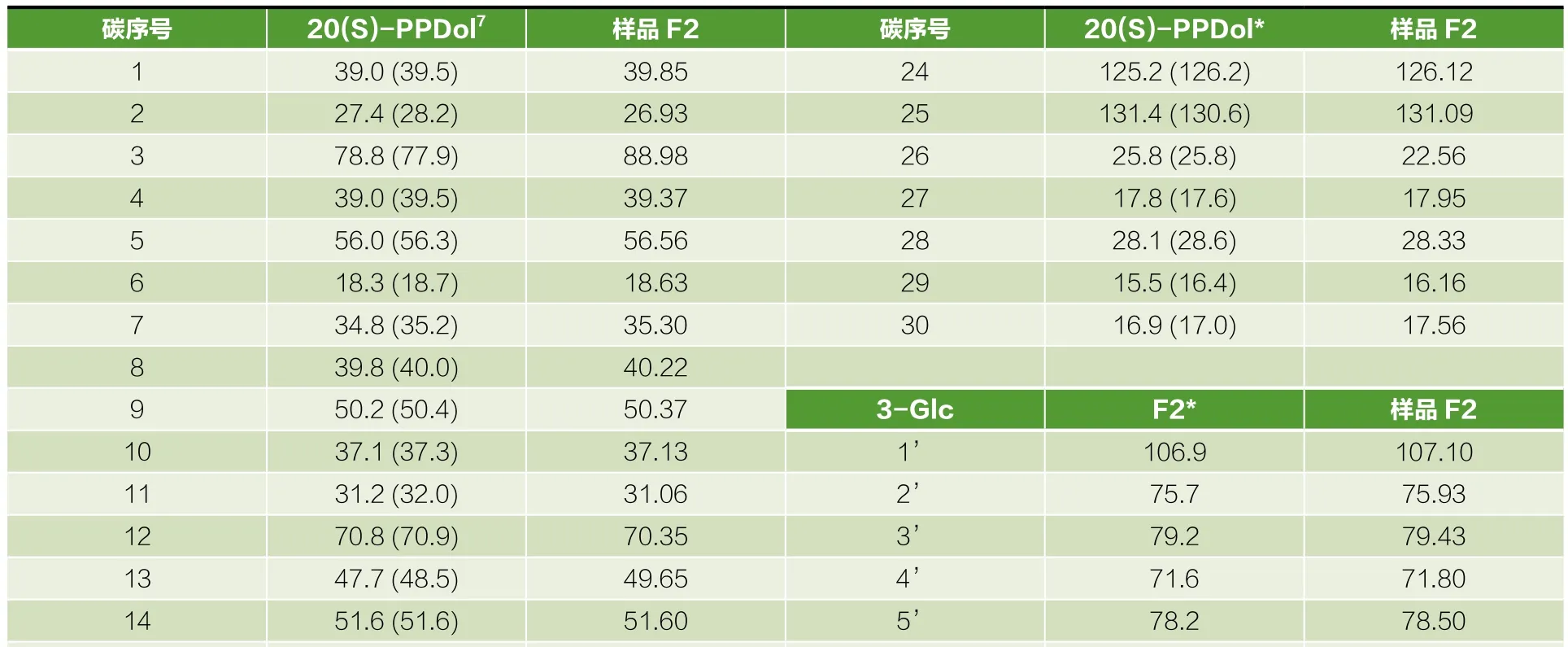
图3 样品F2的一维13C NNE核磁共振谱全图Fig. 3 13C NNE NMR full Score of F2
综上所述,样品为人参皂苷C-K(3-O-β-D-吡喃葡萄糖基-20-O-β-D-吡喃葡萄糖基-20(S)-原人参二醇),结构式如图4所示,分子式为C42H72O13,分子量为785.01。

图4 人参皂苷F2结构Figure 4 Structure of ginsenoside F2
3 . 结论
本文采用硅胶柱层析法,对前期采用生物酶转化法制备、并经脱糖脱色处理过的粗品人参皂苷F2进行了分离纯化,并采用核磁共振法测定了其结构。50g的F2粗品经硅胶层析分离后,得到纯度为96.7%的F2共4.19g,得率为8.38%。采用核磁共振(NMR)法对分离后的产品进行分析鉴定,最终确定了其结构,即3-O-β-D-吡喃葡萄糖基-20-O-β-D-吡喃葡萄糖基-20(S)-原人参二醇,分子式为C42H72O13,分子量为785.01。
