TLR4介导克罗恩病不同病变部位淋巴归巢水平的差别
2018-12-26
克罗恩病(Crohn's disease,CD)是一种肠道的持续性慢性炎症疾病,其发病机制至今未明[1],且病变呈跳跃性分布,病变肠段之间可存在正常肠段,病变肠段与正常肠段的分布尚无明显规律可循。是何种机制造成了CD发病部位差异性如此巨大的特点?大量研究表明CD的病变部位分布可能与淋巴细胞归巢有关,归巢受体的表达差别可能决定了病变肠段的分布。那么淋巴细胞归巢又受何种上游炎症途径调控与介导?这一现象值得深入研究。
1 材料和方法
1.1 实验材料
1.1.1 对象 选取广州医科大学附属第二医院于2014年1月—2017年12月经肠镜及病理确诊为CD的22例患者作为研究对象,年龄为18~39岁,平均年龄(27.0±4.2)岁;其中,男性12例,女性10例。另设10名行肠镜示正常的健康人作为空白对照。
1.1.2 材料和仪器 CCR9、TLR4引物来源于北京鼎国生物技术有限公司。9700PCR仪来源于美国ABI公司。兔抗人CCR9、TLR4及羊抗兔二抗来源于美国SantCruz公司。
1.2 试验方法
1.2.1 标本的采集 22例患者于肠镜下分别在病变肠段及正常肠段取得黏膜组织,10名健康人亦于肠镜下取组织标本。
1.2.2 RT-PCR检测CCR9、TLR4在核酸水平的表达 提取结肠组织RNA后RT-PCR检测CCR9、TLR4的表达,95℃ 3 min,95℃40 sec;54 ℃ 50 sec(β-actin),59 ℃ 50 sec(CCR9、TLR4);72℃ 50 sec共30循环;72℃ 10 min。聚丙烯酰胺凝胶电泳,计算积分光密度。
1.2.3 Western blotting检测CCR9、TLR4在蛋白水平的表达 结肠标本蛋白提取后上样于凝胶,于86 V下电泳80 min,转膜1 hr,封闭1 hr。分别加入一抗1 hr。洗去一抗;封闭液处理。加入对应二抗1 hr。洗去二抗。显色4 min,显影1 min,定影5 min。计算条带的积分密度。
1.2.4 统计学方法 采用SPSS 19.0软件对数据进行分析处理,计量资料以(均数±标准差)表示,采用LSD-t检验;计数资料以(n,%)表示,采用χ2检验,以P<0.05表示差异具有统计学意义。Pearson分析法分析各计量资料之间的相关性。
2 结果
2.1 RT-PCR检测CCR9、TLR4在CD患者肠道不同病变部位的表达
CD患者病变肠段组CCR9、TLR4的表达高于CD患者正常肠段组,差异具有统计学意义(P<0.05),CD患者正常肠段组、CD患者病变肠段组均高于正常组,差异具有统计学意义(P<0.05)。正常人结肠内未观察到CCR9、TLR4表达。见图1,表1。

图1 RT-PCR检测CCR9、TLR4的表达
表1 RT-PCR检测各组样本CCR9、TLR4的表达(±s)
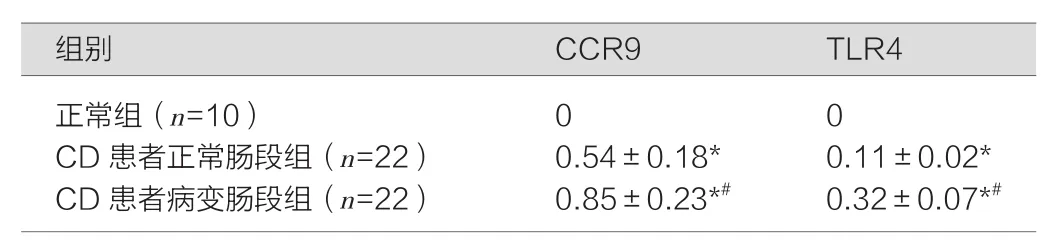
表1 RT-PCR检测各组样本CCR9、TLR4的表达(±s)
注:与正常组比较,*P<0.05;与CD患者正常肠段组比较,#P<0.05
正常组(n=10) 0 0 CD患者正常肠段组(n=22) 0.54±0.18* 0.11±0.02*CD患者病变肠段组(n=22) 0.85±0.23*# 0.32±0.07*#
2.2 Western blotting检测CCR9、TLR4在CD患者肠道不同病变部位的表达
CD患者病变肠段组织中CCR9、TLR4的表达高于CD患者正常肠段,差异具有统计学意义(P<0.05),CD患者正常肠段组、CD患者病变肠段组均高于正常组,差异具有统计学意义(P<0.05)。正常人结肠内未观察到CCR9、TLR4表达。见图2,表2。

图2 Western blotting检测CCR9、TLR4的表达
表2 Western blotting检测各组样本CCR9、TLR4的表达(±s)
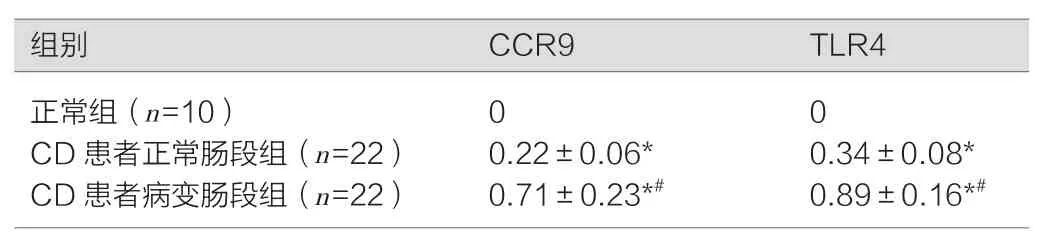
表2 Western blotting检测各组样本CCR9、TLR4的表达(±s)
注:与正常组比较,*P<0.05;与CD患者正常肠段组比较,#P<0.05
?
2.3 CCR9与TLR4表达水平的相关性
CCR9与TLR4在核酸表达水平呈明显正相关(r=0.842,P<0.05)。CCR9与TLR4在蛋白表达水平上亦呈明显正相关(r=0.791,P<0.05)。
3 讨论
CD的发病机制一直是当前胃肠道疾病的研究热点之一。有学者提出了淋巴细胞归巢(lymphocyte homing,LH)可能作为CD发病的始动因素[2]。国内外已有动物试验证实在IBD的动物模型中,可观察到LH的活化水平升高。类似的研究都表明,LH水平的升高是肠道细胞免疫的炎症反应中重要的一环,其与IBD的发病密切相关[3-4]。
本试验发现,在CD患者病变部位,趋化因子受体9(chemokine receptor 9,CCR9)的表达明显升高,CCR9是淋巴细胞归巢重要的受体之一,其升高说明局部淋巴细胞归巢的活化,而CCR9的升高程度与病变部位的炎症反应呈正比,说明淋巴细胞归巢介导了下游炎症反应的产生,其表达的升高与发病部位相关[5-8]。这与已有的动物实验结果是相一致的。虽然淋巴细胞归巢参与了CD的发病机理,但什么原因导致了CD局部病变部位炎症的起始及放大,使得相对整个肠道来说,只有局部特定部位才会出现淋巴细胞归巢水平的升高?本研究发现,淋巴细胞归巢的受体CCR9与Toll样受体4(Toll-like receptor 4,TLR4)密切相关,在CD患者的病变部位,不仅可观察到TLR4的明显升高,而且CCR9也与其保持一致;CD患者肠道的正常部位仍有TLR4的升高,且CCR9亦与其保持一致,这一现象值得进一步探讨。已有相当多的研究表明,CD的发病与TLR4密切相关[9-10]。结合本试验结果,我们推测,TLR4不但参与了CD的发病,而且其介导的淋巴细胞归巢也是形成CD病变处于肠道不同部位的重要原因。Toll样受体率先对原本耐受的微生物或其成分形成应答而不再耐受,Toll样受体活化后即通过其跨膜传递信号的特点相继激活下游炎症因子,将免疫失衡的信号放大传递给细胞及体液免疫系统,由此最终导致淋巴细胞归巢的水平变化,不仅如此,肠道不同部位的免疫稳态并不一定一致,在免疫严重失衡的部位,调控淋巴细胞归巢水平的免疫因素也更加活跃,这一系列反应最终导致归巢的淋巴细胞大量游出并粘附至相关病变部位,最终导致了病变的发生[11-14],这即可能成为CD的发病机制。
综上所述,本试验认为引起CD病变部位不同的机制可能与CCR9、TLR4介导的淋巴细胞归巢有关,其具体机制为Toll样受体介导的免疫失衡引起了病变部位淋巴细胞归巢的活化。
