感染后肠易激综合征小鼠不同肠段肠黏膜热休克蛋白70的表达及意义*
2015-12-16周旭春孙晓宁杨波黄白丽邓桃枝何周桃韩向阳蓝程
周旭春,孙晓宁,杨波,黄白丽,邓桃枝,何周桃,韩向阳,蓝程
(1.海南省人民医院消化内科,海南 海口 570311;2.重庆医科大学附属第一医院消化内科,重庆 400016)
·论著·
感染后肠易激综合征小鼠不同肠段肠黏膜热休克蛋白70的表达及意义*
周旭春1,孙晓宁1,杨波2,黄白丽1,邓桃枝1,何周桃1,韩向阳1,蓝程1
(1.海南省人民医院消化内科,海南 海口 570311;2.重庆医科大学附属第一医院消化内科,重庆 400016)
目的探讨感染后肠易激综合征(PI-IBS)小鼠不同肠段肠黏膜热休克蛋白70(HSP70)的表达,及其与炎症细胞因子表达的相关性。方法旋毛虫感染小鼠,不同肠段肠黏膜组织苏木精-伊红染色法(HE)染色,炎症评分。腹壁撤退反射(AWR)和结肠传输试验(CTT)观察内脏敏感性和肠道动力变化。免疫组织化学及酶联免疫吸附试验(ELISA)检测不同肠段HSP70和炎症细胞因子的表达。Spearman相关性分析HSP70与炎症细胞因子表达的相关性。结果①小鼠感染旋毛虫后末段回肠和结肠出现明显炎症,炎症消退后仍存在明显的内脏高敏感和肠道动力异常。②PI-IBS小鼠空肠和末段回肠的HSP70表达较对照组明显增强(P<0.01)。③PI-IBS小鼠末段回肠白细胞介素-17(IL-17)、干扰素-γ(IFN-γ)水平明显升高,空肠、末段回肠及结肠白细胞介素-10(IL-10)水平明显降低(P<0.01)。④PI-IBS小鼠空肠HSP70表达与炎症细胞因子IL-10呈负相关(P<0.01);末段回肠HSP70表达与IL-10呈负相关(P<0.01),与IL-17、IFN-γ呈正相关(P<0.01)。结论①不同肠段HSP70和炎症细胞因子的相关差异性表达可能在PI-IBS发病中起作用。②末段回肠可能是PI-IBS最重要的炎症免疫启动和调控部位。
感染后肠易激综合征;热休克蛋白70;炎症;细胞因子;免疫组织化学;酶联免疫吸附试验
尽管发病机制尚未完全阐明,但大量证据提示感染和炎症可能是肠易激综合征(irritable bowel syndrome,IBS)重要的发病机制之一,即感染后肠易激综合征(post-infectious irritable bowel syndrome,PI-IBS)[1-2]。热休克蛋白70(heat shock protein 70,HSP70)是分子伴侣热休克蛋白家族的一员,在胃肠黏膜的炎症和损伤中起重要作用[3-4]。有关PI-IBS不同肠段HSP70的表达及其在PI-IBS发病中的意义未见报道,本文则报道研究的初步成果。
1 材料与方法
1.1 实验材料
33只雌性C57BL/6(B6)小鼠(6~8周龄)购自中国科学院昆明动物所,随机分为PI-IBS第2周组、PI-IBS第8周组和对照组,每组11只。旋毛虫购自兰州兽医研究所,胃蛋白酶为美国Invitrogen公司产品,免疫组织化学试剂盒为武汉博士德公司产品,酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒为深圳精美公司进口分装,所有抗体来自美国BD Bioscience公司。
1.2 PI-IBS小鼠模型的建立和临床指标的观察
旋毛虫感染法制作小鼠PI-IBS模型[5]。旋毛虫包囊感染60 d的Sprague Dawley小鼠以胃蛋白酶人工消化法分离肌幼虫。每只小鼠灌服0.2 ml含300个幼虫的生理盐水,感染后第8周进行腹壁撤退反射(abdominal withdrawal reflex,AWR)和结肠传输试验(colon transportation test,CTT),分别观察动物的内脏敏感性及肠道动力变化。结直肠气囊扩张刺激后按动物情绪和腹肌收缩评分,总分0~4分[6]。活性炭灌胃后记录首次排黑便时间以及粪便Bristol评分[7]。
1.3 组织病理学
感染后第2和8周分别取末端回肠和近端结肠组织,4%多聚甲醛固定,常规石蜡包埋切片,苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色。显微镜下观察各段肠黏膜组织炎症。按DIELEMAN等[8]报道的方法,由2位病理学家进行双盲法评分。
1.4 肠黏膜HSP70表达
感染后第8周免疫组织化学检测肠黏膜HSP70的表达。肠组织切片脱蜡至水,一抗为大鼠抗小鼠HSP70单克隆IgG抗体,二抗为HRP Polymer酶标兔抗大鼠IgG抗体,二氨基联苯胺(diaminobenzidine,DAB)显色,光镜观察。
参照ZAGZAG等[9]的方法对染色强度和阳性细胞比例进行综合评分,并对两组的结果进行半定量比较。染色强度评分:0分,未见黄色;1分,浅黄色;2分,棕黄色;3分,棕褐色。阳性细胞比例评分:0分,无阳性细胞;1分,<1%;2分,1%~10%;3分,10%~50%;4分,>50%。
1.5 细胞因子表达
感染后第8周,取动物不同肠段组织,在4℃下经机械+超声粉碎后,组织匀浆离心取上清液,ELISA测定细胞因子干扰素-γ(interferon gamma,IFN-γ)、白细胞介素-17(interleukin-17,IL-17)、白细胞介素-4(interleukin-4,IL-4)、白细胞介素-10(interleukin-10,IL-10)及肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)的表达,按照试剂盒说明书进行操作。
1.6 统计学方法
采用SPSS 13.0统计软件进行数据分析,计量资料以(±s)表示,用t检验,相关性分析用Spearman相关性检验,P<0.05为差异有统计学意义。
2 结果
2.1 建立小鼠PI-IBS模型
2.1.1 HE染色与对照组比较,模型组小鼠末端回肠和近端结肠组织在感染后第2周起,存在显著中性粒细胞的炎症细胞浸润和间质充血水肿;第8周炎症和水肿逐渐减轻至基本恢复正常,空肠的炎症不明显。见图1。

图1 3组小鼠肠道病理变化(HE×200)
2.1.2 肠道组织炎症评分PI-IBS第2周组、PI-IBS第8周组及对照组小鼠肠道组织炎症评分见表1。
表1 3组小鼠肠道组织炎症评分(n=11±s)

表1 3组小鼠肠道组织炎症评分(n=11±s)
注:1)与对照组比较,t=-13.823,P=0.000;2)与对照组比较,t= -12.076,P=0.000
分组空肠回肠结肠PI-IBS第2周组1.36±1.217.91±1.301)7.36±0.922)PI-IBS第8周组1.09±1.301.64±1.571.27±1.49对照组1.1 8±1.330.82±1.401.00±1.41
2.1.3 AWR评分当结直肠的扩张空气量为0.35和0.50 ml时,PI-IBS组小鼠的AWR评分明显高于对照组,差异有统计学意义。见图2。
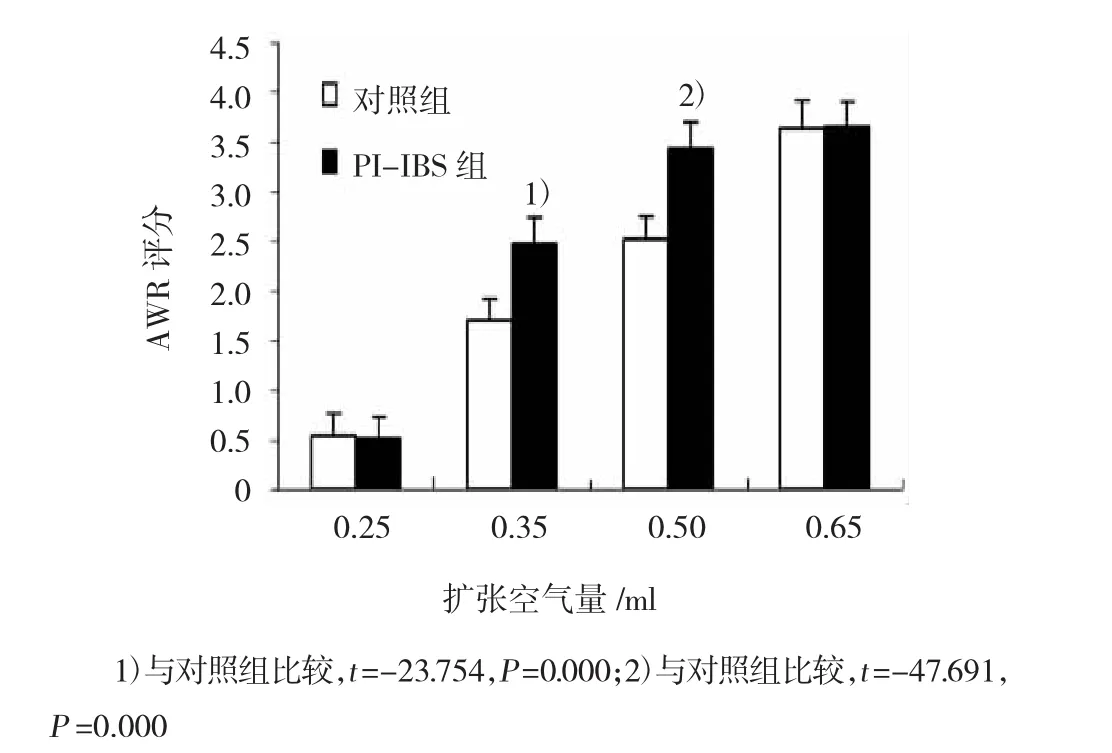
图2 小鼠结直肠气囊扩张AWR评分
2.1.4 肠道动力检测PI-IBS组小鼠首次排黑便时间为(87.33±10.16)min,比对照组[(109.36±10.24)min]明显缩短(t=6.187,P=0.000)。8 h粪便Bristol评分PI-IBS组(2.08±0.32),明显高于对照组(1.02±0.20)(t=10.822,P=0.000)。
2.2 肠黏膜HSP70表达
HSP70主要表达于肠道黏膜上皮细胞的胞浆,在固有层部分表达,在黏膜下层及黏膜肌层表达相对较少。与对照组比较,PI-IBS小鼠空肠和末段回肠的HSP70表达明显增强(P<0.01)。见图3和表2。
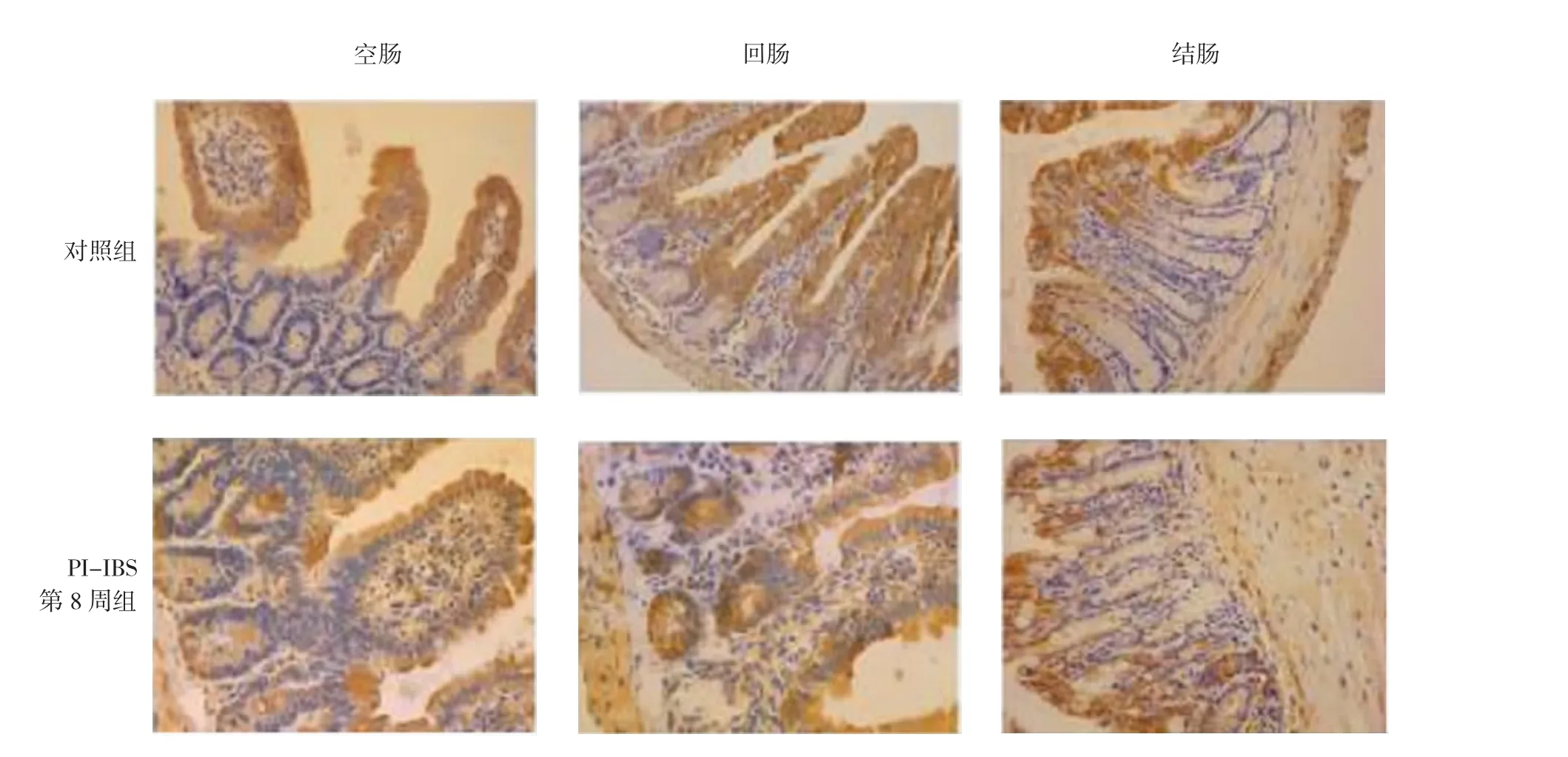
图3 免疫组织化学检测小鼠不同肠段HSP70表达(×200)
表2 两组小鼠肠道组织HSP70免疫组织化学染色评分(n=11±s)

表2 两组小鼠肠道组织HSP70免疫组织化学染色评分(n=11±s)
注:1)与对照组比较,t=7.416,P=0.000;2)与对照组比较,t=5.190,P=0.000
组别空肠回肠结肠PI-IBS组5.18±0.231)4.82±0.232)2.73±0.24对照组3.18±0.223.09±0.152.72±0.19
2.3 肠道炎症细胞因子表达
与对照组比较,PI-IBS组小鼠末段回肠IL-17、IFN-γ明显升高,空肠、末段回肠及结肠IL-10明显降低(P<0.01)。见图4~6。

图4 小鼠不同肠段IL-17的表达

图5 小鼠不同肠段IFN-γ的表达

图6 小鼠不同肠段IL-10的表达
2.4 肠黏膜HSP70与PI-IBS小鼠肠道炎症细胞因子表达的相关性
Spearman分析表明,PI-IBS小鼠空肠HSP70表达与肠道炎症细胞因子IL-10呈负相关(r=-0.782,P<0.01);回肠HSP70表达与IL-10呈负相关(r= -0.752,P<0.01),与IL-17、IFN-γ呈正相关(r=0.718和0.727,P<0.01)。见表3。
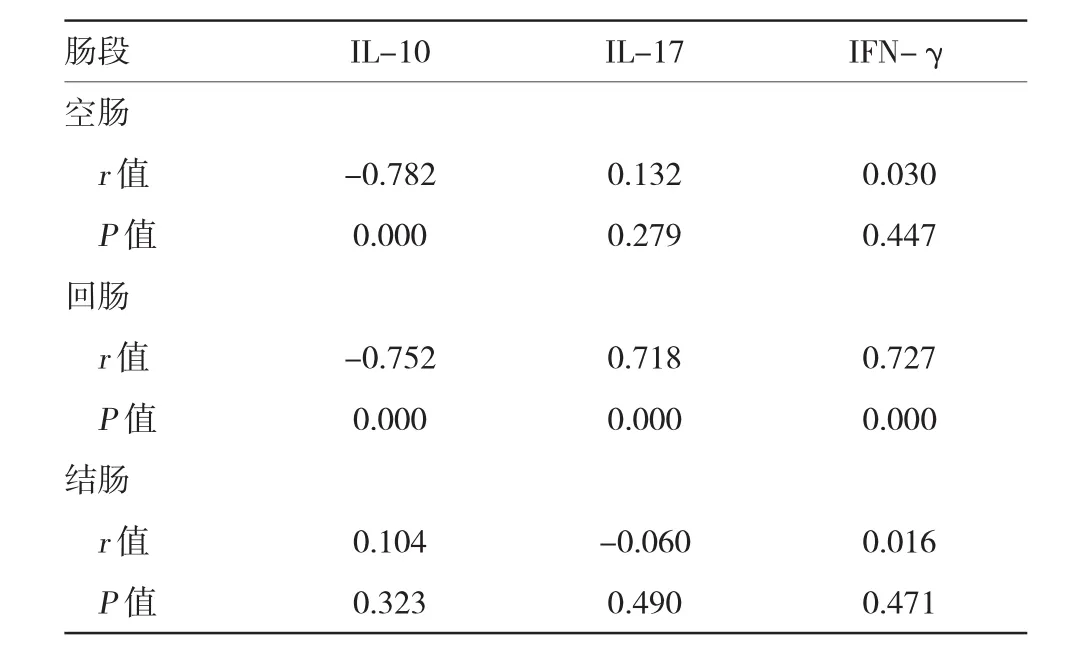
表3 PI-IBS小鼠不同肠段HSP70与肠道炎症细胞因子表达的相关性
3 讨论
肠道的部位划分实际上是一个功能区分的概念,不同肠段承担着消化、吸收、粪便形成等基本功能;在病理生理角度,不同肠段在分泌消化酶、转运营养物质、肠道动力变化或者免疫调控方面起不同作用。IBS是胃肠动力异常、内脏敏感性增高、局部炎症免疫反应、心理、社会因素等多种复杂因素共同作用的结果。体现在肠道功能就远不止腹泻和便秘这么简单。过去一般认为,IBS的主要功能区在于结肠的变化,对其他肠段的作用则研究很少。HSP70是一组结构高度保守的分子伴侣蛋白,在多数原核和真核细胞中呈结构性表达或由热休克及其他刺激诱导表达。HSP70可以协助由于应激或炎症损伤而改变折叠结构的重要蛋白重新折叠,从而使损伤得到修复[10]。应急和炎症时表面表达HSP分子的炎症效应细胞可以被免疫细胞识别并清除[11]。另外,HSP70可能是胃肠黏膜炎症和损伤的重要调节因子[12]。本文通过观察PI-IBS小鼠不同肠段的HSP70表达及其与相应肠段炎症的关系,试图从肠段功能异质性这一新的角度来寻找PI-IBS发病机制的新线索。笔者发现,①PI-IBS小鼠不同肠段的炎症不同,即末端回肠和近端结肠最明显;第8周时肠道炎症基本消退,但末端回肠和近端结肠的HSP70表达仍有明显增强,十二指肠和空肠的HSP70表达没有变化。这说明末端回肠和近端结肠可能是PI-IBS重要的调控部位。②进一步观察不同肠段炎症细胞因子的变化,发现PI-IBS小鼠末段回肠的IL-17、IFN-γ水平明显升高,空肠、末段回肠及结肠IL-10明显降低。该结果可以解释不同肠段的炎症。那么,不同肠段HSP70表达与炎症的关系是通过什么途径实现呢?笔者分析HSP70和几种炎症细胞因子的相关性,发现PI-IBS小鼠空肠HSP70表达与肠道炎症细胞因子IL-10呈负相关;末段回肠HSP70表达与IL-10呈负相关,与IL-17、IFNγ均呈正相关。IL-10是抗炎因子,而IL-17和IFN-γ则是原炎症因子[13-15]。这提示PI-IBS不同肠段HSP70可能与相应肠段的炎症细胞因子表达有关,前者可能通过影响后者来影响肠道炎症。
有趣的是,不论肠段炎症、HSP70还是炎症细胞因子表达,回肠末段都是变化最明显的部位,这提示末段回肠可能是PI-IBS最重要的炎症免疫启动和调控部位。这可能是由于回肠末段免疫组织丰富的缘故。
综上所述,不同肠段HSP70和炎症细胞因子的相关差异性表达可能在PI-IBS发病中起作用,末段回肠可能是PI-IBS最重要的炎症免疫启动和调控部位。探讨不同肠段HSP70表达在PI-IBS中的作用,将为深入阐明PI-IBS的病理生理机制提供线索。当然,其具体的细胞和分子调控机制有待进一步研究。
[1]SOARE S RL.Irritable bowel syndrome:a clinical review[J]. World J Gastroenterol,2014,20(34):12144-12160.
[2]FUTAGAMI S,ITOH T,SAKAMOTO C.Systematic review with meta-analysis:post-infectious functionaldyspepsia[J].Aliment Pharmacol Ther,2015,41(2):177-188.
[3]DUNCAN EJ,CHEETHAM ME,CHAPPLE JP,et al.The role of HSP70 and its co-chaperones in protein misfolding,aggregation and disease[J].Subcell Biochem,2015,78:243-273.
[4]MATTOORU,GOLOUBINOFFP.Molecularchaperonesare nanomachines that catalytically unfold misfolded and alternatively folded proteins[J].Cell Mol Life Sci,2014,71(17):3311-3325.
[5]YANG B,ZHOU X,LAN C.Changes of cytokine levels in a mouse model of post-infectious irritable bowel syndrome[J].BMC Gastroenterol,2015,15:43.
[6]DISTRUTTI E,CIPRIANI S,MENCARELLI A,et al.Probiotics VSL 3 protect against development of visceral pain in murine model of irritable bowel syndrome[J].PLoS One,2013,DOI: 10.1371/journal.pone.0063893.
[7]CAROFF DA,EDELSTEIN PH,HAMILTON K,et al.The Bristol stool scale and its relationship to Clostridium difficile infection[J].J Clin Microbiol,2014,52(9):3437-3439.
[8]DIELEMAN LA,PALMEN MJ,AKOL H,et al.Chronic experimental colitis induced by dextran sulphate sodium(DSS)is characterized by Th1 and Th2 cytokines[J].Clin Exp Immunol,1998, 114(3):385-391.
[9]ZAGZAG D,ZHONG H,SCALZITTI JM,et al.Expression of hypoxia-inducible factor 1α in brain tumors[J].Cancer,2000, 88(11):2606-2618.
[10]SHIBER A,RAVID T.Chaperoning proteins for destruction:diverse roles of Hsp70 chaperones and their co-chaperones in targeting misfolded proteins to the proteasome[J].Biomolecules, 2014,4(3):704-724.
[11]HIRSH MI,HASHIGUCHI N,CHEN Y,et al.Surface expression of Hsp72 by LPS-stimulated neutrophils facilitates gammadelta T cell-mediated killing[J].Eur J Immunol,2006,36(3): 712-721.
[12]LIU H,DICKSVED J,LUNDH T,et al.Heat shock proteins: intestinal gatekeepers that are influenced by dietary components and the gut microbiota[J].Pathogens,2014,3(1):187-210.
[13]SAXENA A,KHOSRAVIANI S,NOEL S,et al.Interleukin-10 paradox:a potent immunoregulatory cytokine that has been difficult to harness for immunotherapy[J].Cytokine,2015,74(1): 27-34.
[14]CǍTANǍ CS,BERINDAN NEAGOE I,COZMA V,et al.Contribution of the IL-17/IL-23 axis to the pathogenesis of inflammatory bowel disease[J].World J Gastroenterol,2015,21(19): 5823-5830.
[15]FORSTER S.Interferon signatures in immune disorders and disease[J].Immunol Cell Biol,2012,90(5):520-527.
(申海菊 编辑)
Role of differentially expressed heat shock protein 70 in various intestinal segments of mice in pathogenesis of post-infectious irritable bowel syndrome*
Xu-chun ZHOU1,Xiao-ning SUN1,Bo YANG2,Bai-li HUANG1,Tao-zhi DENG1, Zhou-tao HE1,Xiang-yang HAN1,Cheng LAN1
(1.Department of Gastroenterology,Hainan Provincial General Hospital,Haikou,Hainan 570311,P.R.China;2.Department of Gastroenterology,the First Affiliated Hospital, Chongqing Medical University,Chongqing 400016,P.R.China)
【Objective】To elucidate the role of differentially expressed heat shock protein 70(HSP70)in various intestinal segments of mice in the pathogenesis of post-infectious irritable bowel syndrome(PI-IBS).【Methods】To establish the PI-IBS animal model,the mice were infected with Trichinella spiralis.After 8 weeks,the intestinal inflammatory score,abdominal withdrawal reflex(AWR),intestine transportation time and Bristol scores were used to evaluate the clinical features of the mice,which were regarded as the characteristics for IBS.The intestinal HSP70 level in the various bowel segments including jejunum,terminal ileum and colon was detected by immunohistochemistry.The concentration of the intestinal inflammatory cytokines was examined by ELISA.The relationship between the intestinal HSP70 level and the clinical features of PI-IBSwas studied by Spearman correlation analysis.【Results】①The infected mice showed remarkable visceral hypersensitivity and abnormal intestinal motility even after the significant inflammation disappeared in their terminal ileum and proximal colon.②The expression of HSP70 significantly increased in the jejunum and terminal ileum of the PI-IBS mice(P<0.01)compared to the control group.③The expressions of IL-17 and IFN-γ significantly increased in the terminal ileum of the PI-IBS mice(P<0.01),while that of IL-10 decreased in all the three intestine segments(P<0.01).④In jejunum and terminal ileum of the PI-IBS mice,there was a negative correlation between HSP70 level and IL-10(P<0.01),while there were positive correlations between HSP70 level and both IL-17 and IFN-γ in the terminal ileum(P<0.01).【Conclusions】①The differentially expressed heat shock protein 70 in various intestinal segments may play an important role in the pathogenesis of post-infectious irritable bowel syndrome.②The terminal ileum may be an essential location where the inflammatory process,immune response and regulating events are triggered.
post-infectious irritable bowel syndrome;heat shock protein 70;inflammation;cytokine;immunohistochemistry;ELISA
R574.4
A
1005-8982(2015)29-0001-06
2015-05-27
国家自然科学基金(No:81160057);海南省国际科技合作专项基金(No:KJHZ2013-14)
蓝程,E-mail:lancheng71@163.com;Tel:13078985175
周旭春,现工作单位为重庆医科大学附属第一医院消化内科
