一株高酶活力米曲霉菌株的选育及其在酱油生产中的应用
2018-12-07童星,彭勃
童 星,彭 勃
(1.佛山市海天(高明)调味食品有限公司,广东 佛山 528000;2.佛山市海天调味食品股份有限公司,广东 佛山 528000;3.广东海天创新技术有限公司,广东 佛山 528000)
酱油是以大豆、面粉等粮食作为主要原料,经微生物发酵酿造而成的具有独特风味的传统调味品。目前,我国酱油每年生产量超过600万t[1]。制曲在我国传统酱油酿造食品的生产工艺中广泛使用[2],在制曲过程中,米曲霉(Aspergillus oryzae)、酵母等多种微生物的生长,使原料被分解,对酱油的风味和品质的提高具有重要意义[3]。米曲霉是酱油发酵过程中起主要作用的微生物,在发酵过程中可以通过分解淀粉和蛋白质原料,为其他微生物的代谢作用提供物质基础[4],同时形成的小分子多肽和氨基酸类物质也是酱油中风味物质形成的前提[5]。
目前,国内酱油生产用米曲霉菌株都有独立的发酵特性,在生长速度、产孢数及主要酶系的分布等方面都有较为显著的差异[6]。米曲霉沪酿3.042是国内酱油厂家广泛使用的发酵菌种,具有生产周期短、抗性好、管理粗放等优点,为了获得更高的产量,对该菌种的最佳产酶条件[7]和菌株改造[8]进行研究。虽然筛选出的新菌株的蛋白酶活越来越高,但同时也打破了该菌株原来的酶系分布,而酱油酿造是一个多酶系共同作用的过程,酶系的改变容易造成利用纯曲霉菌株发酵出的酱油质量下降[9]。因此,可以通过多菌种混合发酵[10-11]、发酵过程加酶处理或菌种改良等方法解决,但因多菌种混合发酵过程中多菌株的竞争性生长、发酵过程中加酶处理引入外源物质,容易造成成本的增加和食品安全隐患。因此,只有通过菌种改良,选育出综合酶活力高、制曲过程原料消耗少的菌株,才能从根本上提高酱油生产时发酵原油的品质。
本研究通过常压室温等离子体(atmospheric roomtem-peratureplasma,ARTP)对米曲霉菌株As3.951进行诱变,筛选一株高酶活力的诱变菌株应用于酱油酿造,提高酱油品质,节省原料,为酿造酱油品质的提升提供优良菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌种
米曲霉(Aspergillus oryzae)As3.951:佛山市海天(高明)调味食品有限公司菌种保藏中心。
1.1.2 培养基
酪蛋白培养基:干酪素6 g,KH2PO40.36 g,Na2HPO40.58 g,MgSO40.244 g,琼脂粉20 g,溶于1 000 mL蒸馏水中,pH 6.0,121℃灭菌15 min。
大豆蛋白培养基:大豆分离蛋白10g,MgSO4·7H2O0.5g,木糖30g,KH2PO41 g,琼脂粉15 g,溶于1 000 mL蒸馏水中,pH 6.4,121℃灭菌15min。
制曲培养基:麸皮200 g,豆粉200 g,面粉50 g,蒸馏水550 g,混合均匀后121℃灭菌15 min。
豆汁培养基:葡萄糖30 g,酵母膏20 g,琼脂20 g,豆汁(100 g黄豆,用1 000 mL蒸馏水浸泡24 h,煮沸30 min,过滤,取汁定容至1 000 mL)100 g,溶于1 000 mL蒸馏水中,混匀,pH自然,121℃灭菌15 min。
1.1.3 试剂
磷酸二氢钾、磷酸氢二钾、硫酸镁(均为分析纯):广州化学试剂厂;木糖(分析纯):国药集团化学试剂有限责任公司;干酪素(生化试剂):北京奥博星生物技术有限责任公司;琼脂粉(生化试剂):上海环凯微生物科技有限公司;大豆分离蛋白(生化试剂):日本和光纯药工业株式会社;大豆、麸皮、面粉(均为食品级):佛山市海天(高明)调味食品有限公司。
1.2 仪器与设备
SHP-250型生化培养箱:广东环凯微生物科技有限公司;BX53型光学显微镜:日本OLYMPUS公司;759S型紫外分光光度计:上海棱光技术有限公司。
1.3 方法
1.3.1 菌种诱变
(1)取米曲霉As3.951菌株的成熟斜面孢子制成孢子悬液,浓度为1×108CFU/mL,并对孢子悬液进行ARTP诱变。用0.85%的无菌生理盐水将诱变后的孢子悬液梯度稀释至10-1、10-2、10-3、10-4、10-5、10-6,制成孢子稀释液。
(2)取0.2mL孢子稀释液涂布于酪蛋白培养基平板上,31℃避光培养96 h。
(3)挑取与出发菌种As3.951相比具有菌丝生长旺盛、透明圈大、产孢时间延迟特点的单菌落划线于大豆蛋白培养基上,31℃条件下培养60h,再次挑取与出发菌种As3.951相比菌落直径大、菌丝生长旺盛的单菌落,转接于大豆蛋白培养基培养,成熟后进行菌种保藏。
1.3.2 诱变菌株筛选
(1)诱变菌株的初筛
将诱变获得的目标菌种转接于大豆蛋白培养基斜面上活化,30℃培养4 d。刮取斜面上孢子至无菌水中,使最终孢子浓度为1×108CFU/mL,按接种量为制曲培养基质量的10%分别接种于制曲培养基中进行扩大培养,于30℃培养箱中培养48 h。挑选菌丝生长和孢子着生正常的菌株制曲,并对制曲完成后的成熟曲料进行质量分析(孢子数、中性蛋白酶活力、淀粉酶活力),优选生长正常和综合酶活力高的菌株进行复筛。
(2)诱变菌株的复筛
将初筛获得的菌株依次转接斜面活化后,进行三角瓶扩大培养,然后继续进行制曲和发酵试验。通过检测成曲(孢子数、原料消耗率、中性蛋白酶、谷氨酰胺酶和淀粉酶酶活)以及发酵原油(氨基酸态氮、全氮、全氮收得率、还原糖、谷氨酸)的质量,优选出最佳菌株。
1.3.3 菌落形态观察
挑取最优菌株的单菌落接种于豆汁培养基平板,于30℃培养箱培养60 h后,观察菌落生长状态。
1.3.4 成曲及原油制备工艺
成曲制备工艺[2]:将大豆润水,加水量为大豆质量的1.2倍,115℃蒸料15 min。熟料快速冷却至37~40℃,拌入30%的面粉,按原料质量接入0.15%菌种,拌匀。按照通风制曲培养方式进行培养,温度控制在30~35℃,培养42 h后制曲结束,获得成曲。
原油制备工艺[12]:采用我国传统高盐稀态发酵法。4 kg成熟曲料与8 kg盐水(18%)均匀混合,于30℃条件下恒温发酵50 d,过滤去除酱醪得到原油。
1.3.5 选育菌株酱油生产效果验证
将诱变筛选的新菌株与出发菌株同步应用于酱油生产的制曲及发酵阶段。制曲结束后抽样检测成曲的孢子数、原料消耗率、中性蛋白酶活力、淀粉酶活力及谷氨酰胺酶活力,发酵结束后检测原油的氨基酸态氮、全氮、全氮收得率、还原糖及谷氨酸含量,并对原油进行感官评定。
1.3.6 指标测定
孢子数测定采用显微镜计数法[13];全氮含量的的测定采用凯氏定氮法[14];全氮收得率=原油全氮(g/100 mL)/原料全氮(g/100mL)×100%;氨基酸态氮含量的测定采用GB/T 5009.39—2003《酱油卫生标准的分析方法》中甲醛滴定法;中性蛋白酶活力的测定按照SB/T 10317—1999《蛋白酶活力测定法》;淀粉酶活力的测定按照GB/T 5521—2008《粮油检验谷物及其制品中α-淀粉酶活性的测定比色法》;还原糖含量的测定按照GB/T 5009.7—2003《食品中还原糖的测定》;谷氨酰胺酶活力的测定参照邹敏娟等[15]的方法。
感官评定[16]:随机选出30人组成感官评定小组,对使用菌株As3.951和ZA189酿造的原油进行品鉴,并针对色泽、香气、鲜味、甜味、苦涩味、鲜味、酸味、综合口感以及体态进行比较及打分,评分范围为1~5分(满分为5分),分数越高表示喜爱度越高,具体评分标准见文献[16]。
2 结果与分析
2.1 菌株筛选
2.1.1 初筛菌株成曲质量分析
挑选菌丝生长和孢子着生正常的菌株ZA189、ZA191、ZA192、ZA193、ZA194分别制曲,并对成曲质量进行分析,结果见表1。
由表1可知,通过诱变获得的5株菌株的成曲质量与米曲霉As3.951相比,孢子数均降低;中性蛋白酶活力均提高,其中菌株ZA192成曲的中性蛋白酶活力最高,为3158.64U/g;除菌株ZA193(416.53 U/g)外,其他菌株的淀粉酶活力均高于出发菌株As3.951。因此,优选生长正常和综合酶活力高的菌株ZA189、ZA191、ZA192、ZA194进行复筛。

表1 初筛菌株成曲的质量分析Table 1 Quality analysis of finished kojimade with initial screening strains
2.1.2 复筛菌株的成曲质量分析
采用初筛获得的4株诱变菌株(ZA189、ZA191、ZA192和ZA194)制曲和发酵。检测成曲及发酵原油的质量,结果分别见表2和表3。

表2 复筛菌株成曲的质量分析Table 2 Quality analysis of finished kojiwith rescreening strains
由表2可知,4株诱变菌株中,菌株ZA189的孢子数较少,为2.18×108CFU/g,原料消耗率(5.79%)最低,而谷氨酰胺酶活力最高(3.43 U/g);菌株ZA192的中性蛋白酶活力和淀粉酶活力最高,分别为3 210.07 U/g和525.80 U/g,但其谷氨酰胺酶活力低于菌株ZA189;菌株ZA191和ZA192在所有指标中未见明显优势。
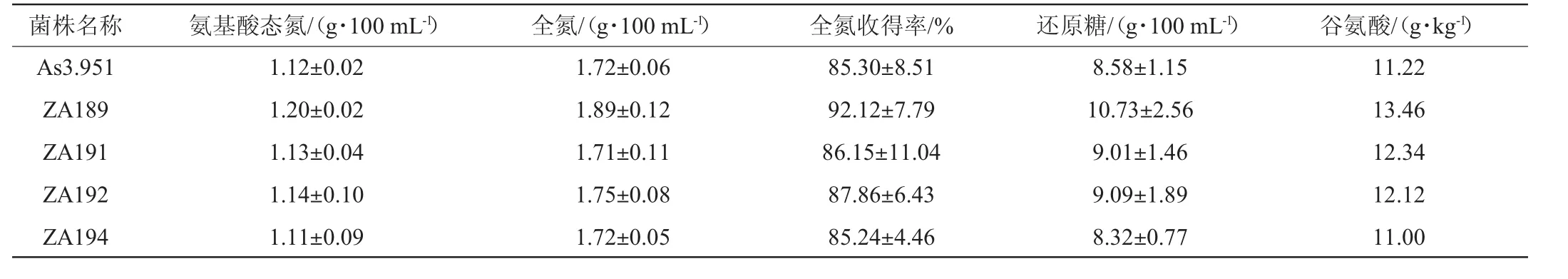
表3 复筛菌株发酵原油的质量分析Table 3 Quality analysis of crude soy sauce fermented with rescreening strains
由表3可知,复筛菌株发酵得到的原油的质量指标中,菌株ZA189的全氮收得率、还原糖和谷氨酸含量均高于其他3种菌株。综合成曲和发酵原油质量分析结果,米曲霉诱变菌株ZA189为最优菌株。
2.2 米曲霉菌株ZA189的菌落形态
米曲霉诱变菌株ZA189在豆汁培养基上的菌落形态如图1所示。
米曲霉孢子数和菌丝的生长旺盛程度与酱油制曲的效果直接相关,张贺迎等[17]认为,大量孢子不利于蛋白酶活力的提高。
由图1可知,米曲霉诱变菌株ZA189的菌落在豆汁培养基上生长快,培养60h后,成熟菌落形态单薄,直径达38mm,色泽青黄绿色,几乎无明显菌丝,透明圈清晰,菌落表层覆盖孢子厚度为(1.0±0.1)mm,而酱油生产用米曲霉孢子厚度在0.5~1.5mm范围内[18]。因此该菌株孢子着生适量,适宜用于酱油生产中。

图1 菌株ZA189的菌落形态Fig.1 Colony morphology of strain ZA189
2.3 选育菌株ZA189酿造酱油过程指标分析
2.3.1 菌株ZA189成曲质量分析
采用诱变筛选的新菌株ZA189与出发菌株As3.951同步制曲,制曲结束后抽样检测曲料的各项指标,结果见表4。
由表4可知,在制曲过程中,菌株ZA189的孢子数和原料消耗率显著低于出发菌株As3.951(P<0.05),酶活力明显提高,中性蛋白酶活力和淀粉酶活力分别达到3 210.21 U/g和480.29 U/g,谷氨酰胺酶活力达到3.48 U/g,较出发菌株提高38%。米曲霉的谷氨酰胺酶活性能够直接影响酿造酱油中的谷氨酸含量[19],因此谷氨酰胺酶活力的提高对酱油鲜味的增加具有直接关联。

表4 菌株ZA189与出发菌株As3.951成曲质量的比较Table 4 Quality comparison of finished kojimade with strain ZA189 and starting strain As3.951
2.3.2 菌株ZA189发酵原油质量分析
将制曲完成后的曲料进行发酵,并检测经发酵压榨后原油的各项理化指标,结果如表5所示。
由表5可知,选育菌种ZA189发酵原油的氨基酸态氮含量为1.16 g/100 mL、全氮含量为1.94 g/100 mL、还原糖含量为11.05 g/100 mL、谷氨酸含量为13.69 g/kg,均高于出发菌株As3.951,表明采用该选育菌株发酵原油的品质明显提高。

表5 菌株ZA189与出发菌株As3.951发酵原油质量对比Table 5 Quality comparison of crude soy sauce fermented with strain ZA189 and starting strain As3.951
2.3.3 发酵原油的感官评定
将原油加热处理后,对原油进行感官鉴评,结果见图2。

图2 原油的感官评定Fig.2 Sensory evaluation of crude soy sauce
由图2可知,相比出发菌株米曲霉As3.951,菌株ZA189所得原油味道更浓郁,色泽更鲜明,具备酱香浓郁、鲜甜突出、滋味醇厚持久的特征,综合口感达到3.66分,高于米曲霉As3.951(3.21分)。
3 结论
本研究采用ARTP对米曲霉As3.951进行诱变,选育出一株高酶活诱变菌株ZA189,与对照菌株As3.951相比,该菌株成曲的中性蛋白酶、淀粉酶和谷氨酰胺酶3种酶活力均得到明显增强,分别为3 210.21 U/g、4 80.29 U/g、3.48 U/g,同时孢子数减少,原料消耗率下降,能够改善现有米曲霉菌株普遍存在的主要问题;利用该菌株发酵得到的原油中氨基酸态氮、全氮、还原糖及谷氨酸含量增加,分别为1.17 g/100 mL、1.94 g/100 mL、11.05 g/100 mL和13.69 g/kg;菌株ZA189发酵得到的原油味道浓郁、色泽鲜明,能够明显提升酿造酱油发酵品质,对酿造酱油的发展具有积极意义。
