腌菜中细菌多样性研究及乳酸菌分离鉴定
2018-12-07尚雪娇代程洋王玉荣张振东
尚雪娇,代程洋,王玉荣,廖 华,张振东,郭 壮,3*
(1.湖北文理学院 食品科学技术学院 鄂西北传统发酵食品研究所,湖北 襄阳 441053;2.恩施市农业局,湖北 恩施 445000;3.恩施市公共检验检测中心,湖北 恩施 445000)
恩施土家苗族自治州是由齐跃、巫山和武陵山脉等组成的山地,全州水资源丰富、森林覆盖率高达71.2%,境内生活着汉族、土家族和苗族等27个民族,有着制作和食用发酵蔬菜的习俗[1-2]。该地生产的腌菜主要以芥菜为原料,采用传统手工技术将芥菜头和部分芥菜叶露天晾晒至七成干后切丁、加适量盐入坛腌渍而成。特殊的地理环境、开放的生产条件以及传统的制作技术使得腌菜成品中保留了多种由环境和原料等因素引入的微生物。近年来研究人员对腌菜的微生物多样性进行了初步解析,张奶英等[3]采用变性梯度凝胶电泳技术(denaturing gradient gel electrophoresis,DGGE)对四川叶用芥菜盐渍过程中微生物多样性进行了研究,发现其中优势菌为盐单胞菌(Halomonas sp.)、酿酒酵母(Saccharomy cerevisiae)和粘性红圆酵母(Rhodotorulamucilaginosa);邓元源等[4]从福建省农家自制腌菜中分离出3株乳酸菌,经鉴定分别为短乳杆菌(Lactobacillusbrevi)、发酵乳杆菌(Lactobacillusfermentum)和植物乳杆菌(Lactobacillus plantarum);林亲录等[5]从湖南省传统发酵芥菜中分离出10株乳酸菌菌株,通过初步鉴定将其鉴定为乳杆菌属(Lactobacillus),然而目前关于恩施地区腌菜中微生物多样性的研究报道尚少。
高通量测序技术(high-throughput sequencing,HTS)具有操作简单、通量高和检测速度快的特点,且一次可对多个样本进行平行分析[6],但因扩增引物通用性高,导致专门针对某一个种属的微生物群落进行研究时其适用性较差[7]。在使用种属特异性引物扩增16SrRNA多变区基因序列的基础上,使用DGGE技术可以完成肠道等复杂基质中乳酸菌菌群群落结构的研究工作[8],具有操作简单易行、灵敏度高和可检测到一个核苷酸水平的差异等优点[9]。由此可见,将高通量测序和DGGE技术相结合进行发酵食品多样性解析是可行的,且在窖泥[10]、豆酱[11]和肠道[12]细菌多样性解析方面已得到了广泛应用。
因此,本研究采用MiSeq高通量测序与DGGE指纹图谱技术相结合的方法对采集自恩施土家苗族自治州的腌菜中细菌多样性进行了分析,并采用稀释涂布平板法对其中所含乳酸菌进行了分离鉴定与保藏,为后续腌菜的产业化发展提供菌株支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
腌菜样品:采自恩施舞阳坝菜市场,3份,编号分别为YC01、YC02和YC03,每份分装两管。
1.1.2 试剂
聚丙烯酰胺、尿素、N,N-亚甲基二丙烯酰胺、四甲基乙二胺、过硫酸铵、乙醇、冰醋酸、甲醛、硝酸银、碳酸钙、丙三醇、过氧化氢、三氯甲烷、氯化钠、三羟甲基氨基甲烷、乙二胺四乙酸二钠、乙酸钙、十二烷基硫酸钠、酚、氯仿、异戊醇、醋酸钠(均为分析纯):国药集团化学试剂有限公司;Axygen清洁试剂盒:北京科博汇智生物科技发展有限公司;溶菌酶(400 U/μg)、蛋白酶K(20 U/μg)、脱氧核糖核苷三磷酸(deoxy-ribonucleotide triphosphate,dNTP)mix、10×聚合酶链式反应(polymerasechain reaction,PCR)Buffer、r Taq酶(5 U/μL)、pMD18-T vector、Solution I:宝生物工程(大连)有限公司;10×Loading buffer、DL2000 脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:宝日医生物技术(北京)有限公司;2×PCRmix:南京诺唯赞生物科技有限公司;QIAGENDNeasymericon Food Kit提取试剂盒:德国QIAGEN公司。
1.1.3 培养基
MRS培养基:青岛海博生物技术有限公司。
1.1.4 引物
高通量测序引物:正向引物338F(5′-ACTCCTACGGGAGGCAGCA-3′);反向引物806R(5′-GGACTACHVGGGT-3′)。
带有GC夹子的PCR-DGGE正向引物Lac-GC-V3F(5′-CGCCCGGGGCGCGCCCCGGGCGGCCCGGGGGCACCGGGGGACTCCTACGGGAGGCAGCAGT-3′),不带GC夹子的PCR-DGGE正向引物Lac-V3F(5′-ACCGGGGGACTCCTACGGGAGGCAGCAGT-3′)和PCR-DGGE反向引物Lac-V3R(5′-GTATTACCGCGGCTGCTGGCAC-3′)。
乳酸菌PCR扩增引物:正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′);反向引物1495R(5′-CTACGGCTACCTTGTTACGA-3′)。
验证阳性克隆引物:正向引物M13F(5′-CGCCAGGGTTTTCCCAGTCACGAC-3′);反向引物M13R(5′-GAGCGGATAACAATTTCACACAGG-3′)。
以上引物均由武汉天一辉远生物科技有限公司合成。
1.2 仪器与设备
VeritiTM96孔梯度PCR扩增仪:美国AB公司;ND-2000C微量紫外分光光度计:美国Nano Drop公司;DYY-12水平电泳仪:北京市六一仪器厂;DCodeTM System、UV PCDS8000凝胶成像分析系统:美国BIO-RED公司;Bio-5000 plus扫描仪:上海中晶科技有限公司;DG250厌氧工作站:英国DWS公司;5810R台式高速冷冻离心机:德国Eppendorf公司;ECLIPSECi生物显微镜:日本Nikon公司。
1.3 方法
1.3.1 基因组DNA提取
使用DNA提取试剂盒,按照试剂盒使用说明提取样品基因组DNA,然后用微量紫外分光光度计检测其浓度和纯度。
1.3.2 细菌多样性分析
PCR扩增及测序:PCR扩增16SrRNA V3-V4区。PCR扩增体系为5×FastPfu Buffer 4.0 μL,2.5mmol/L dNTPmix 2.0μL,5μmol/L的正(338F)反(806R)引物各0.8 μL,r Taq酶0.4μL,DNA模板10 ng,双蒸水(ddH2O)补齐至20μL。PCR扩增程序为95℃预变性3min;95℃变性30s,55℃退火30s,72℃延伸45 s,30次循环;72℃再延伸10 min[13]。扩增产物用1.0%的琼脂糖凝胶电泳检测合格后寄至上海美吉生物医药科技有限公司进行MiSeq高通量测序。
序列质量控制:参照文献[14]中的方法对下机后的序列进行拼接和质量控制,对合格的序列进行下一步分析。
序列分析:参照CAPORASOJG等[15-16]的方法使用QIIME数据分析平台对质控后的序列分别以100%和97%的相似度进行序列划分,从每个操作分类单元(operational taxonomic units,OTU)中选择一条代表性序列与Greengenes和RDP数据库进行比对,统计各分类水平信息。
1.3.3 乳酸菌指纹图谱分析
PCR扩增:将各样品基因组DNA质量浓度稀释至20 ng/μL。PCR扩增条件为10×PCRBuffer(含Mg2+)2.5μL,dNTPmix(2.5 mmol/L)2.0 μL,Lac-GC-V3F(10 μmol/L)和Lac-V3R(10μmol/L)各0.5μL,r Taq酶0.2μL,DNA模板0.5μL,用ddH2O将体系补齐至25μL[17]。PCR扩增程序为94℃预变性5 min;94℃变性30 s,55℃退火1 min,72℃延伸90 s,30个循环;72℃再延伸10 min[18]。用1.0%的琼脂糖凝胶电泳检测是否扩增出目的条带。
DGGE检测:聚丙烯酰胺凝胶变性剂变性范围为35%~52%,上样量为10μL,待0.5×三羟甲基氨基甲烷-乙酸-乙二胺四乙酸(trisbase-acetic acid-ethylenediamine tetra acetic acid,TAE)制成的缓冲溶液温度升至60℃时,调节电压120 V运行78 min,然后80 V维持13 h。电泳结束后,待缓冲溶液冷却至室温采用银染法使凝胶显色。
条带回收测序:将显色后的凝胶置于扫描仪上扫描成像,标记特征条带并用手术刀切下分别置于无菌EP管中,添加50μL无菌超纯水,4℃静置过夜,然后进行PCR扩增,PCR扩增条件为2×PCRmix 12.5μL,引物Lac-V3F和Lac-V3R各0.5μL,DNA模板2.0μL,无菌超纯水补齐至25μL。PCR扩增程序及检测方法同方法1.3.3。参照樊哲新等[19]的方法对合格的PCR产物进行清洁、连接pMD18-T载体、转化大肠杆菌(Escherichiacoli)Top10以及鉴定阳性克隆。将阳性克隆寄至武汉天一辉远生物科技有限公司进行测序。将测回的序列用DNAMAN软件处理后置于美国国家生物技术信息中心(national center of biotechnology information,NCBI)上进行比对,选取同源性较高的菌株,利用MEGA软件中的邻近法(neighbor joining,NJ)构建系统发育树。
1.3.4 乳酸菌的分离鉴定
分离:采用稀释涂布平板法分别将3个样品稀释至10-6和10-7梯度,然后取100μL稀释液涂布于含1.0%CaCO3的MRS琼脂培养基上,置于厌氧工作站中,37℃培养48 h后,挑选周围有透明圈的单菌落纯化2~3代,镜检合格后甘油保藏。
鉴定:对分离出的菌株进行革兰氏染色以及过氧化氢酶试验;参照文献[20]中的方法提取乳酸菌DNA,然后以提取的DNA为模板进行PCR扩增,扩增条件和程序以及鉴定方法同1.3.3。
2 结果与分析
2.1 细菌多样性分析
2.1.1 序列丰富度分析
采用MiSeq高通量测序技术分析细菌多样性时,在100%相似度下共测得42954条序列,平均每个样品14318条序列;在97%的相似度下又可将这些序列划分成4 347个OTU,现对平均相对含量>0.1%的OTU进行分析,结果如图1所示。
由图1可知,平均相对含量>0.1%的OTU有36个,其中OTU1168、OTU1427和OTU4213的平均相对含量明显高于其他OTU,且这3个OTU在腌菜样品YC01中的相对含量分别为71.16%、7.55%和0.33%;在腌菜样品YC02中的相对含量分别依次为68.40%、0和2.20%;在腌菜样品YC03中的相对含量分别为53.19%、0.08%和1.46%。将OTU1168的代表性序列分别在Greengenes和RDP数据库进行比对,均将该序列鉴定为乳酸杆菌属(Lactobacillus)。由此可见,恩施地区腌菜样品中存在大量共有细菌菌群,且乳酸杆菌可能为其优势细菌属。

图1 核心OTUs相对含量分析Fig.1 Relative abundance analysis of core OTUs
2.1.2 α多样性分析
在测序深度为28910条序列的条件下,对腌菜样品YC01、YC02和YC03进行α多样性分析。YC01、YC02和YC03的超1(Chao1)指数分别为700、837和983,香农(Shannon)指数分别为2.98、2.42和4.34,由此可见,腌菜样品YC03中的细菌丰富度和多样性要高于YC01和YC02。
2.1.3 优势菌相对含量分析
经比对发现,3个腌菜样品中共检测到10个门、24个纲、43个目、72个科和120个属的细菌,所有样品仅有2.68%的序列不能鉴定到属水平。将平均相对含量>0.1%的细菌门定义为优势菌门,优势菌门在各样品中的分布情况如图2所示。

图2 优势细菌门相对含量分析Fig.2 Relative abundance analysis of dominant bacteria phyla
由图2可知,腌菜样品中优势细菌门为硬壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)。所有腌菜样品中含量最高的均为Firmicutes,其平均相对含量达97.09%;其次为Proteobacteria,平均相对含量为2.02%。腌菜样品YC01、YC02和YC03中鉴定出的细菌属数量分别为54个、95个和73个,各样品优势细菌属的相对含量如图3所示。

图3 优势细菌属相对含量分析Fig.3 Relative abundance analysis of dominant genus of bacteria
由图3可知,平均相对含量>0.1%的优势细菌属有7个,即乳酸杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、弧菌属(Vibrio)、假单胞菌属(Pseudomonas)、嗜冷杆菌属(Psychrobacter)和黄杆菌属(Flavobacterium),其平均相对含量分别为82.37%、7.02%、5.38%、0.58%、0.27%、0.15%和0.14%。王一淇等[21]通过采用纯培养计数的方法对湖南芥菜腌制发酵过程中的菌相变化规律进行了解析,结果表明,乳酸杆菌属(Lactobacillus)在芥菜自然发酵的中期和后期都占主要优势,这与本研究结果有相似之处。
2.2 乳酸菌指纹图谱分析
经高通量测序分析发现,Lactobacillus在样品中的平均相对含量达82.37%,是恩施腌菜样品中平均相对含量最高的细菌属,本研究进一步采用DGGE指纹图谱技术对样品中Lactobacillus的种类及其在各样品间的差异进行研究,结果如图4所示。

图4 乳酸菌的DGGE指纹图谱Fig.4 DGGE fingerprint of lactic acid bacteria
由图4可知,在DGGE指纹图谱上每个样品都检测出数目不等的条带。其中条带LYC3和LYC4为腌菜样品中共有条带,而条带LYC1为腌菜样品YC03中特有条带,条带LYC5为腌菜样品YC01中特有条带,条带LYC2为腌菜样品YC01和YC03共有条带,这说明恩施腌菜中含有多种共有乳酸杆菌,同时各样品中也含有特有细菌菌群。腌菜样品YC03泳道中的条带数量及条带明亮度高于腌菜样品YC01和YC02泳道,说明腌菜样品YC03中的乳酸菌的丰度较腌菜样品YC01和YC02中的高,这与高通量测序结果一致。将回收条带的测序结果与NCBI中的模式株比对,结果如表1所示。

表1 乳酸菌PCR-DGGE优势条带比对结果Table 1 Comparison results of dominant band of lactic acid bacteria by PCR-DGGE
由表1所知,回收的优势条带中有4条隶属于乳酸杆菌属,其中LYC1为清酒乳杆菌(L.sakei),LYC2为L.insicii,LYC3为L.plantarum subsp.argentoratensis,LYC4为植物乳杆菌植物亚种(L.plantarum subsp.plantarum),LYC5为耐酸乳杆菌(L.acetotolerans)。
2.3 乳酸菌的分离鉴定
通过稀释涂布平板法从3个腌菜样品中分离出15株菌,编号分别为YC01-1、YC01-2、YC01-3、YC01-4、YC02-1、YC02-2、YC02-3、YC02-4、YC02-5、YC03-1、YC03-2、YC03-3、YC03-4、YC03-5和YC03-6,经生理生化试验得出,15株菌株革兰氏染色为阳性、过氧化氢酶试验检测为阴性,16SrRNA鉴定序列与最似模式菌菌株的相似度均在99%以上。乳酸菌菌株与模式株的进化关系如图5所示。
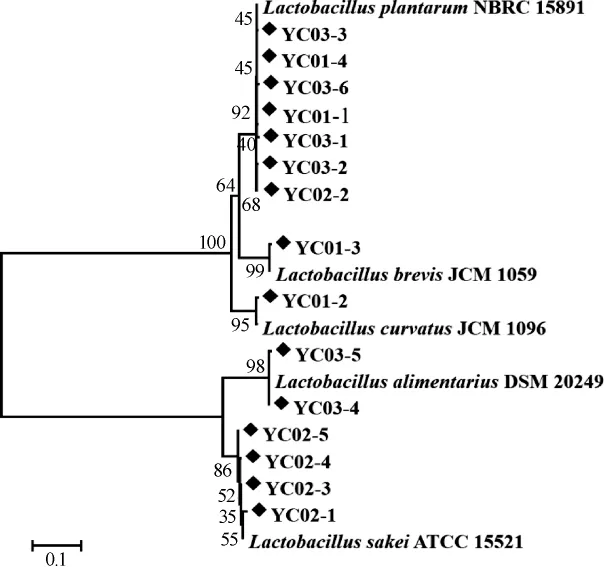
图5 乳酸菌基于16S rRNA序列构建的系统进化树Fig.5 Phylogenetic tree of lactic acid bacteria based on 16S rRNA sequences
由图5可知,经鉴定及比对发现这些菌株主要为植物乳杆菌(L.plantarum)、短乳杆菌(L.brevi s)、弯曲乳杆菌(L.curvatus)、消化乳杆菌(L.alimentarius)和清酒乳杆菌(L.sakei)。进一步对各菌株在样品中的分布进行统计,结果如表2所示。

表2 各腌菜样品中乳酸菌菌株的种类和数量Table 2 Species and quantities of lactic acid bacteria strains in each pickle sample
由表2可知,从腌菜样品YC01共分离出4株乳酸菌,经鉴定分别为L.plantarum、L.curvatus和L.brevi s;从腌菜样品YC02中共分离出5株乳酸菌,经鉴定分别为L.plantarum和L.sakei;从腌菜样品YC03中分离出6株乳酸菌,经鉴定分别为L.plantarum和L.alimentarius。由此可见,虽然Lactobacillus为腌菜样品中的优势菌,但乳酸杆菌的构成在样品间存在一定的差异。值得一提的是,腌菜样品YC02中的5株乳杆菌中有4株为L.sakei,有研究表明,该菌能产生多种细菌素,其中I类、部分IIa和IIb类清酒乳杆菌细菌素均具有一定的抑菌作用[22],这可能是导致腌菜样品YC02中细菌丰度低于其他样品的原因之一。此外,采用传统微生物学手段从样品中分离出15株隶属于5个种的乳酸菌,但未分离出DGGE检测到的L.insicii和L.acetotolerans,这可能与微生物特殊生长需求以及培养条件的限制有关。
3 结论
本研究采用MiSeq高通量测序和DGGE技术相结合的方法对采集自恩施地区的3份腌菜样品中细菌多样性进行了分析,MiSeq高通量测序结果表明,腌菜样品中含量最高的优势细菌门为硬壁菌门(Firmicutes),优势细菌属为Lactobacillus、Weissella、Leuconostoc、Vibrio、Pseudomonas、Psychrobacter和Flavobacterium,虽然Lactobacillus为恩施腌菜中的优势细菌属且平均相对含量高达82.37%,但不同腌菜样品间乳酸菌的种类存在较大差异。
DGGE测定结果表明,腌菜中含有L.sakei、L.insicii、L.plantarum subsp.argentoratensis、L.plantarum subsp.plantarum和L.acetotolerans。
经稀释涂布平板法从腌菜中共分离到15株乳酸菌,包括L.plantarum7株、L.alimentarius 2株、L.curvatus和L.brevi s各1株以及L.sakei4株。
