针对猪瘟病毒E2蛋白的实时荧光定量PCR方法的建立及应用
2018-11-23姜一峰李国新张玉娇李丽薇虞凌雪周艳君郑海红童光志
高 飞,姜一峰,李国新,张玉娇,李丽薇,虞凌雪,周艳君,郑海红,童光志
(1.中国农业科学院上海兽医研究所,上海200241,2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州225009)
猪瘟 (classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种急性、高度接触性的致死性传染病,是临床上严重威胁养猪业的一种传染病,呈世界流行,对养猪业危害严重[1-2]。近十几年来,猪瘟仍在全国范围内流行,给我国养猪业造成了巨大的经济损失。我国对于猪瘟的控制采取强制免疫策略。在全国范围内长时间高密度使用猪瘟疫苗,虽然控制了猪瘟的大面积流行与爆发,但参差不齐的免疫状况和复杂的生物安全环境,使猪瘟病毒仍然在中国流行,并且不时有新的基因亚型出现。最近十年,2.1b亚型CSFV占主导地位[4-5],2015年中国首次报道了2.1d亚型CSFV[6-8]。CSFV流行态势日趋复杂,对猪瘟的检测与控制丝毫不容放松。
CSFV属于黄病毒科、瘟病毒属,其基因组为长约12.3 kb的单股正链RNA,CSFV的囊膜糖蛋白E2是一种可以诱导机体产生高水平中和抗体的重要保护性抗原[9-10]。实时荧光定量PCR将常规PCR与荧光检测技术相结合,可应用于临床上高通量病原体的检测[11-12]。本研究以CSFV E2基因的保守区域为靶序列,设计并合成了一套特异性的引物和探针,建立了一种针对CSFV E2蛋白的实时荧光定量PCR。该方法特异性强,灵敏度高,重复性好,为临床上对猪瘟病毒的检测和定量研究提供了重要的工具,也为本实验室研制的表达猪瘟病毒C株E2蛋白的PRRSV重组病毒vA-C-E2[14]后期在猪体内的安全性分析和免疫保护效果评价等提供了一种定量检测方法。
1 材料与方法
1.1 材料
1.1.1 细胞与病毒 猪肾细胞系(PK-15)由中国农业科学院上海兽医研究所猪繁殖障碍综合征创新团队(本实验室)保存;高致病性猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)HuN4株(GenBank登录号:EF635006)以及其细胞传代致弱株vHuN4-F112、伪狂犬病毒(Pseudorabies virus,PRV)JS-2012株、猪圆环病毒2型(Porcine circovirus virus,PCV2)、猪瘟病毒石门株(GenBank登录号:AF092448)均由本实验室保存;猪瘟弱毒疫苗株HCLV(GenBank登录号:AF091507)购自广东永顺生物制药股份有限公司。
1.1.2 试剂和仪器 限制性内切酶购自NEB和TaKaRa公司;TOP10感受态细胞购自TIANGEN公司;RTPCR反转录酶为AMV,购自TaKaRa公司;质粒抽提试剂盒QIAprep Spin Miniprep Kit、RNA抽提试剂盒QIAamp Viral RNA Mini Kit、DNA凝胶回收试剂盒均购自QIAGEN公司;pMD18-T载体克隆试剂盒、Premix Ex Taq、dNTP、DNA Marker等均购自TaKaRa公司;PCR仪(DNA Thermal Cycler480)为美国PERKIN ELMER公司产品;Mastercycler ep realplex荧光定量PCR仪为Eppendorf公司产品。
1.2 方法
1.2.1 核酸抽提 病毒RNA抽提按照QIAamp Viral RNA Mini Kit的说明书操作,最后用60 μL的去离子水溶解,-20℃保存。
1.2.2 引物和探针的设计 参照GenBank中CSFV(登录号:AF092448、AF091507)E2基因序列,利用DNAStar Lasergene v7.1软件进行同源性分析,找出E2基因的保守区,利用Primer Premier 5.0软件设计出一套特异性引物和TaqMan探针。上游引物E2-F:5'-CGCAAAAACTTTGAAGAACAAGTAC-3',下游引物E2-R:5'-CACGTCCAGGTCAAAC CAGTA-3',探针E2-probe:5'-FAM-AGCCCA GGGACAGTTACTTCCAGCA-3'。探针的5'端选择FAM作为报告基团,3'端选择BHQ1作淬灭基团,扩增目的片段长度为100 bp。引物由上海桑尼生物科技有限公司合成,探针由上海吉玛生物科技有限公司合成。针对PRRSV N蛋白的荧光定量PCR引物和探针:PNPF/PNPR/NP-probe参考文献[13]。针对CSFV 5'UTR的荧光定量PCR引物和探针:P5UTRF/P5UTRR/ 5UTR-probe[15]由本团队保存。
1.2.3 标准品的制备 以CSFV RNA反转录的cDNA 作为模板,使用上游引物E2-BZ-F:5'- CGGCTAGCC TGCAAGGAAGA-3'和下游引物E2-BZ-R:5'-AAATTCTGCGAAGTAATCTGAG-3',进行常规PCR扩增。电泳检测PCR产物并回收,然后连接至pMD18-T载体,转化,挑菌培养后提取重组质粒。对 PCR鉴定结果为阳性的重组质粒进行测序和质粒浓度测定,再将浓度换算为拷贝数,进行10倍系列稀释。
1.2.4 荧光定量PCR反应条件的优化及其特异性、敏感性和重复性检测 对引物和探针的浓度采用矩阵法进行优化[16]。使用本研究中建立的荧光定量PCR方法对CSFV、PRV、PCV2、PRRSV的cDNA或者DNA进行检测;对标准品进行检测,检测结果与常规PCR的检测结果进行比较;另外对7个不同浓度的阳性标准品进行检测,重复3次,统计Ct值,计算标准差及变异系数。
1.2.5 临床样品检测 分别采集CSFV感染猪的血清、鼻拭子和肛拭子,使用本研究建立的针对CSFV E2基因的荧光定量PCR对其进行检测,同时与常规PCR方法和针对CSFV 5' UTR的荧光定量PCR方法[15]检测结果进行比较。
1.2.6 PRRSV重组病毒的检测 前期研究中,本实验室构建了表达猪瘟病毒(C株)E2蛋白的PRRSV重组病毒vA-C-E2[14],用本研究建立的检测CSFV E2基因的荧光定量PCR方法和检测PRRSV N基因的荧光定量PCR方法[13]对重组病毒vA-C-E2进行检测,并对结果进行比较分析。
2 结果
2.1 阳性标准品的制备以E2-BZ-F和E2-BZ-R为引物,CSFV RNA反转录的cDNA 为模板的PCR扩增产物约1000 bp,与预期大小一致。回收PCR产物并构建重组质粒pE2,测序结果显示与目的片段序列完全一致。测定重组质粒浓度后换算成拷贝数,进行10倍系列稀释至10 copies/μL,将准备好的标准品于-20℃保存。
2.2 反应条件的优化通过对不同浓度的探针和引物进行组合,经过多次重复后,结果显示当探针浓度为0.2 pmol/μL,引物浓度为0.3 pmol/μL,退火温度为60℃时,能够获得最低的Ct值和相对较高的荧光增加值。因此最优反应体系(20 μL)为:Premix Ex Taq10μL、上下游引物(10pmol/μL)各0.6μL、探针(10 pmol/μL)0.4 μL、模板2 μL、灭菌ddH2O 6.4 μL。反应条件:95℃预变性1 min,95℃变性5 s,60℃退火30 s,40个循环。
2.3 特异性试验使用优化好的反应体系对本实验室保存的CSFV、PRV、PCV2、PRRSV和表达猪瘟病毒E2蛋白的重组PRRSV(vA-C-E2)等毒株同时进行荧光定量PCR检测,结果显示只有CSFV 和重组病毒vA-C-E2呈阳性,PRV、PCV2和PRRSV均无典型扩增曲线,阴性对照也未出现扩增(图1)。
2.4 敏感性试验使用优化好的反应体系对10倍系列稀释的阳性标准品进行检测,结果显示当阳性标准品浓度为10 copies/μL时Ct值仍然能够检出,因此本试验建立的荧光定量PCR检测方法最低能够检测到10 copies/μL。与常规PCR方法进行比较,荧光定量PCR灵敏度比常规PCR高约100倍。
2.5 重复性试验使用优化好的反应体系和条件对7个不同浓度(1×102copies/μL~1×108copies/μL)的阳性标准品重复检测3次,比较同一浓度不同重复的Ct值,并计算其标准差及变异系数。结果显示,该方法在1×102~1×108copies/μL范围内线性相关系数为0.997。不同重复同一浓度的Ct值标准差为0.018~0.220,变异系数为0.089%~0.750%,说明本研究建立的荧光定量PCR具有很好的重复性和稳定性(图2)。
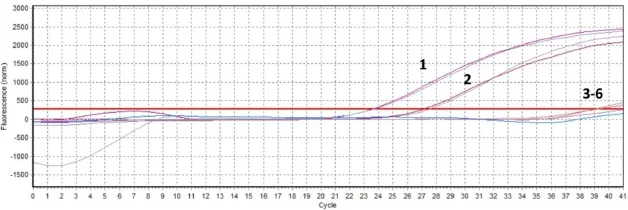
图1 荧光定量PCR特异性检测结果Fig.1 The speci ficity of the fl uorescent quantitative PCR

图2 荧光定量PCR的标准曲线及检测敏感性分析Fig.2 Standard curve and the sensitivity analysis of the fl uorescent quantitative PCR
2.6 临床样品的检测使用本研究建立的荧光定量PCR和常规PCR分别对CSFV感染猪场中的临床样本进行检测。在20头猪的血清、鼻拭子和肛拭子样品中,普通PCR检出10头猪血清、鼻拭子和肛拭子均呈阳性的样品。针对CSFV E2蛋白的荧光定量PCR检出了所有普通PCR结果判断为阳性的样品,另有6份血清样品、8份鼻拭子、6份肛拭子被普通PCR检测为阴性,而本荧光定量方法检测结果为阳性,说明本研究建立的荧光定量PCR检测更加灵敏(表1)。在对猪瘟病毒RNA拷贝数的检测中,与针对CSFV 5' UTR的荧光定量PCR方法相比,本研究建立的荧光定量PCR检测灵敏度相似。在检测vA-C-E2病毒RNA拷贝数的实验中,本研究建立的针对CSFV E2蛋白的荧光定量PCR与针对PRRSV N蛋白的荧光定量PCR检测结果一致,而针对CSFV 5' UTR的荧光定量PCR方法则未检测到数值,符合预期(表2),说明此方法可以用于vA-C-E2疫苗候选株的检测及与自然感染的鉴定诊断等。
3 讨论
目前,对于CSFV的检测主要利用免疫荧光、ELISA、RT-PCR等,但是这些方法分别存在费时、费力,特异性敏感性低,容易出现污染,难以判断结果等缺点,应用存在一定的局限性。荧光定量PCR方法因其具有快速高效、特异灵敏、通量高等优点,一直备受关注。荧光定量PCR分为相对定量(染料法)和绝对定量(探针法)两种,本研究选择CSFV的E2基因保守区序列来设计探针和引物,成功建立了一种可定量检测CSFV的TaqMan实时荧光定量PCR检测方法,该方法具有特异性强,敏感性高,重复性好,检测时间短,速度快的优点。检测结果显示,该方法可用于CSFV毒株的检测和定量,并且在检测本实验室构建的重组PRRSV疫苗候选株vA-C-E2中,与针对PRRSV N蛋白的荧光定量PCR方法的检测灵敏度相似,可用于vA-C-E2的体外和体内检测。

表1 临床样品检测结果分析比较Table 1 Comparison of clinical samples detection using conventional PCR and RT-qPCR

表2 三种荧光定量PCR方法对vA-C-E2和CSFV石门株的检测结果比较Table 2 Comparison of three qPCR methods for detecting vA-C-E2 and CSFV Shimen strain
