天然免疫DNA模式识别受体的抗感染研究进展
2018-11-23周荣云朱美芹朱建中
周荣云,何 珊,朱美芹,朱建中
(1. 扬州大学兽医学院,扬州225009;2. 扬州大学比较医学研究中心,扬州225009;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州225009;4. 农业与农产品安全国际联合研究实验室,扬州225009)

朱建中,扬州大学兽医学院教授,博士生导师。 多年来一直从事人和动物天然免疫受体识别、信号通路、免疫调控和抗感染研究。以第一或通信作者在Immunity、EMBO J、Cancer Res、J Immunol、J Biol Chem、 Mol Immunol等杂志发表论文16篇,累计影响因子70分;发表论文引用达1080次。申请发明专利11项。 2016年获聘江苏省特聘教授,2018年度担任江苏省双创团队领军人才。目前承担2项国家自然科学基金和1项国家重点研发项目课题。
天然免疫系统是机体抵抗病原感染的第一道防线,利用细胞内各种模式识别受体(pattern recognition receptors,PRRs)识别非自身病原微生物产物,如核酸、蛋白、糖类和脂类等,即病原相关分子模式(pathogen associated molecular patterns,PAMPs),产生相应免疫应答抑制病原在宿主体内的复制增殖,并减轻细胞、组织的损伤。模式识别受体包括Toll样受体(toll-like receptors,TLRs)、视黄酸诱导基因(retinoic acidinducible gene,RIG)-I样受体(RIG-Ⅰ-like helicase receptors,RLRs)和核苷酸结合寡聚化结构域(nucleotide bindingolig omerization domain,NOD)样受体(NOD-like receptors,NLRs)、C型凝集素样受体(C-type lectin like receptors,CLRs)以及DNA受体等。其中,Toll样受体最早被发现且研究最深入[1],存在于多种细胞内,包括定位在细胞膜上的TLR1、TLR2、TLR4、TLR5、TLR6以及定位在胞浆内体膜上的TLR3、TLR7、TLR8和TLR9[2]。RIG-Ⅰ样受体是一类能够识别胞质RNA成份的受体,包括识别单链RNA、5'ppp-dsRNA的RIG-Ⅰ,识别长双链RNA、poly(I:C)的MDA5,以及无信号活性的LGP2[3]。NOD样受体家族能够检测多种细菌成分,是一类C端有亮氨酸重复序列,N端有介导蛋白质相互作用的CARD或pyrin等结构域的蛋白,主要包括NOD1、NOD2、NLRP3等[4]。C型凝集素样受体CLRs是一类主要与糖类结合的蛋白,含有大约120个氨基酸序列的钙依赖型的糖类识别区域(carbohydrate recognition domain,CRD),包抱Ⅰ型的DEC205、MMR,Ⅱ型的Dectin-1、Dectin-2、DNGR-1等受体。DNA识别受体是较晚发现的PRRs,包括DAI、DDX41、IFI16、AIM2、DHX9、DHX36、DDX60、DNA-PK、MRE11等,主要存在于胞质和内体膜上。其中,TLR9是最早被鉴定的DNA受体,主要识别富含未甲基化CpG DNA[5]。2013年,陈志坚团队首次发现了一种新的核苷转移酶——环鸟苷-腺苷二磷酸合成酶(cyclic guanosine monophosphate-adenosine monophosphate synthase,cGAS)[6],识别DNA后能合成第二信使环鸟苷腺苷二磷酸(cyclic guanosine-adenosine diphosphate,cGAMP),诱导下游信号通路。cGAS作为一种重要的细胞质DNA感受器,主要介导I型干扰素的活化。另一种重要的DNA感受器是PYHIN家族(pyrin and HIN domain-containing protein)的γ干扰素诱导蛋白16(γ-interferon-inducible protein 16,IFI16),存在于胞质和胞核内,静默状态下主要位于细胞核[7-8]。研究显示IFI16在调节转录,调控细胞生长、凋亡及分化,自身免疫,病毒抑制,炎性复合体形成等多方面发挥着重要作用[9]。
病毒感染机体后,模式识别受体与相应配体结合,激活下游接头分子,包括线粒体抗病毒信号接头蛋白(mitochondria antiviral signaling protein,MAVS)[10],干扰素刺激基因(stimulator of interferon genes,STING),髓样细胞分化因子88(myeloid differentiation factor 88,MyD88)等,进一步活化转录因子NF-κB和IRF3/7,从而诱导干扰素和炎性细胞因子的表达,最终模式识别受体介导的信号转导激活了机体的抗病毒防御机制,抑制病毒的入侵和复制。目前,DNA病毒如人的疱疹病毒、乳头瘤病毒、腺病毒、乙肝病毒、牛痘病毒、人巨细胞病毒、猪的圆环病毒、伪狂犬病病毒、非洲猪瘟病毒[11]等入侵机体引起天然免疫应答的机制尚不清楚。为了更好地解决DNA病毒对人类健康和畜牧生产造成的危害,DNA感受器的识别机制及其在抗病毒感染中发挥的作用正成为现在的研究热点。本文将主要讨论DNA识别受体的种类、细胞内定位及其对DNA的识别作用,并根据已有研究讨论DNA被识别后诱导了哪些信号通路,这些信号通路又是如何进行调节。此外,已知的DNA受体多种多样,而这些受体间是否存在相互作用,以及它们对病毒感染采取了怎样的防御策略都值得我们深入探讨。
1 DNA受体
病原微生物感染细胞所释放的DNA分子大部分位于胞浆中,并具有病原特异性,而哺乳动物细胞自身的DNA主要存在于细胞核内,两种DNA分子能被机体区别,从而有效识别外来DNA,激活免疫应答。但是,机体如何区分自我及非自我DNA的机制尚不清晰。已报道的DNA受体有数十种,分布在不同类型的细胞内,包括淋巴细胞巨噬细胞、树突状细胞和非专职免疫细胞(角质细胞、纤维细胞),但只有少数DNA受体的作用通过研究被揭示或发现。
Toll样受体9(TLR9)是第一个被报道的参与识别DNA的模式识别受体。TLR9主要在浆细胞样树突状细胞(plasmacytoid dendritic cell,pDC)及B细胞内表达,静息状态时定位在内质网膜上[12]。TLR9能特异性结合未甲基化的CpG DNA,活化的TLR9与CpG形成一种马蹄状的2∶2的复合物[13],并从内质网转位到内体-溶酶体,在内体蛋白酶水解酶剪切后具备信号转导功能[14]。
第二类DNA识别受体包括环鸟苷-腺苷二磷酸合成酶 (cyclic guanosine monophosphate-adenosine monophosphate synthase, cGAS),AIM2(absent in melanoma 2)等主要位于细胞质的受体,主要识别序列非依赖性的双链DNA(dsDNA)。其中,cGAS是最近发现的胞浆DNA受体[6],能识别各种形式的dsDNA。有研究显示cGAS同样能被DNA-RNA复合物活化[13]。除识别外源DNA外,cGAS也具有调节释放到胞浆中的自身DNA的功能[15]。cGAS具有酶活性,通过磷酸戊糖骨架与双链DNA结合后,形成2∶2的复合物[16],催化ATP和GTP生成第二信使cGAMP(cyclic GMP-AMP)。AIM2是PYHIN家族蛋白,由1个PYRIN结构域及1-2个HIN结构域构成[16],通过HIN结构域结合dsDNA,PYRIN结构域则招募下游接头蛋白ASC,从而激活caspase1,活化的caspase1参与IL-1β和IL-18的成熟、分泌[19-20]。
最后一类是定位在细胞核及胞浆内的DNA受体,主要包括干扰素诱导蛋白16(IFI16)、RNA聚合酶III(RNA Pol III)和MRN复合物(Mre11-Rad50-Nbs1 complex)。与其他DNA受体相似,这类受体在识别DNA,激活天然免疫过程中也发挥着重要作用。此外,这些受体能参与调节转录与DNA损伤修复等环节。IFI16也属于PYHIN蛋白家族,静默状态下主要分布在核内,乙酰化后能聚集在胞质中[21]。IFI16识别DNA的方式与AIM2类似[22],结合DNA后形成丝状寡聚物,激活下游信号通路。有报道显示,IFI16不但能识别多种病毒dsDNA,还能被ssDNA活化[23],而DNA链越长(一般需大于150 bp),IFI16结合的亲和力越好。尽管IFI16主要在细胞核内表达,但它不识别细胞自身的DNA,这种区分病原与细胞DNA的机制尚不清楚,可能与IFI16能识别裸露DNA的长度有关,而宿主细胞DNA通常与组蛋白结合,阻止了IFI16的接触[24]。RNA聚合酶III是一种由多基因编码的寡聚蛋白,在胞质和胞核内均有分布,主要参与一些小RNA的转录、合成及加工。与其他DNA受体直接识别途径不同的是,RNA聚合酶III与胞质poly(dA∶dT)结合,并将其转录为5'-PPP dsRNA,这种RNA被RIG-1识别后通过RIG-1-MAVS信号通路途径介导干扰素的表达[25]。RNA聚合酶III存在于很多细胞内并发挥多种生物学功能,但只在人的细胞系内对poly(dA:dT)产生应答,因此,RNA聚合酶III介导的DNA识别途径仍需进一步认证。
2 DNA识别信号通路
模式识别受体介导的DNA识别最终启动了机体天然免疫系统的应答,并引发一系列连锁的免疫效应反应,包括I型干扰素和炎性细胞因子的表达、细胞凋亡等。研究表明这些丰富的DNA受体是通过多种信号途径来支持机体的免疫防御。TLR9识别CpG DNA后形成二聚体,在跨膜蛋白UNC93B和高尔基体介导下从内质网膜转位到内体室内,接着招募下游接头蛋白MyD88。MyD88与TRAF6、IRAK4形成复合物激活转录因子NF-κB;与TRAF6、IRAK4、IRAK1结合并磷酸化转录因子IRF7,磷酸化的IRF7(pIRF7)和活化的NF-κB转位到细胞核内,分别上调I型干扰素和炎性细胞因子的表达[22](图1)。此外,RNA聚合酶III介导的信号转导也具有重要的生理意义。识别富含AT的双链DNA中poly(dA:dT)后,RNA聚合酶III在核内将其转录为RNA,并在5'端进行三磷酸修饰后被转移到胞质中。5'-PPP RNA作为特异性配体被模式识别受体RIG-1结合,RIG-1招募接头蛋白MAVS,MAVS发生共聚化并通过TRAF6、TRAF2/5分别激活转录因子NF-κB和IRF3,进而分别诱导核内炎性细胞因子和干扰素的转录和表达[26](图2)。除RNA聚合酶III,胞质DNA受体DAI也能直接识别poly(dA∶dT)[27],并通过RIG-1-MAVS途径转导信号,但DAI具有细胞特异性,因此RNA聚合酶III可能是这种DNA应答路径的补充。

图1 CpG DNA激发的TLR9信号识别通路Fig.1 TLR9 signaling pathway triggered by CpG DNA

图2 RNA聚合酶III介导的信号转导Fig.2 RNA polymerase III signaling pathway
自2013年发现DNA受体cGAS后,大量研究证实cGAS-cGAMP-STING信号途径是机体最经典的DNA应答途径(图3)。cGAS能结合各种形式的dsDNA,包括DNA病毒、反转录病毒、胞内寄生菌等释放的DNA,催化ATP、GTP合成第二信使环形二核苷酸cGAMP,这种二核苷酸与菌体产生的环形二核苷酸(cyclic dinucleotides,CDNs)不同,是通过2'-5'磷酸二酯键连接。cGAS的这种酶特性与寡腺苷酸合成酶(oligoadenylate synthetase,OAS)相似[28]。生成的cGAMP可经缝隙连接扩散至相邻细胞,将信号侧向传递[29],并与内质网膜蛋白STING结合,STING形成二聚体后转位到高尔基体膜及核周附近,在泛素连接酶TRIM32、TRIM56和下游TBK1介导下分别发生泛素化和磷酸化[30-32],活化的STING磷酸化TBK1。一方面,磷酸化的TBK1
3 cGAS-STING信号通路的调节
DNA刺激机体诱导干扰素的表达是通过多种DNA信号转导途径,而免疫系统的过度应答会造成一些自身免疫疾病,如系统性红疮狼斑(systemic lupus erythematosus, SLE)、艾卡迪综合征(Aicardi-Goutieres syndrome,AGS)。因此,合理调控以cGAS-STING为代表的免疫信号通路对机体健康非常重要。
首先,cGAS是识别DNA、传递信号的发起点,为避免其过度活化,一般通过翻译后修饰改变蛋白的化学特性和结构特征来调节其活性,包括磷酸化、乙酰化、泛素化、糖基化等。研究发现,在胞质内羧肽酶CCP5、CCP6 缺失的细胞内,cGAS的272位谷氨酸(Glu)经微管蛋白酪氨酸连接酶样酶6(tubulin tyrosineligase-like 6,TTLL6)作用发生聚戊二酰化,聚戊二酰化的谷氨酸链能阻止cGAS和dsDNA的结合;而TTLL4能单戊二酰化cGAS蛋白302位Glu,从而抑制cGAS的酶活性[34]。病毒感染后,TTLL4、TTLL6的表达和cGAS的谷氨酰化水平会显著降低,从而快速产生免疫应答。这种可逆性的修饰作用可能是改变cGAS活性的反馈调节机制(图3)。除了谷氨酰化,cGAS能被Akt磷酸化,Akt是一种靠近cGAS催化基序的残基。在病毒入侵后,感染Akt被活化并磷酸化人cGAS的305位丝氨酸(Ser)或鼠cGAS的291位Ser[35]。磷酸化的cGAS合成cGAMP的酶活性受抑制,导致免疫应答受损(图3)。此外,还有一种翻译后修饰叫小泛素样修饰(SUMOylation),能在病毒感染早期抑制cGAS的降解。有报道一种去小泛素样酶SENP2在感染后期能通过泛素-蛋白酶体途径和分子伴侣介导的自噬途径分别促进cGAS和STING的降解[36](图3)。除了翻译后修饰,自噬也参与了cGAS的信号调控。在免疫应答过程中,cGAS和自噬调节因子Beclin1相互作用,Beclin1释放 Rubicon,激活自噬通路,同时抑制cGAS的酶活性[37](图3),并通过自噬消除胞质内DNA。cGAS的活性不仅受机体自身调控,还受到病原分子的影响,后者通过抑制cGAS以实现免疫逃避。(pTBK1)与转录因子IRF3接触,使其磷酸化并形成二聚体,激活的IRF3进入细胞核启动I型干扰素的转录与表达。另一方面,pTBK1也能经TRAF6活化转录因子NF-κB,进而上调细胞炎性因子的表达。在cGAS-STING信号通路中,STING作为接头蛋白发挥了重要的信号中转站的作用,但研究显示STING也能直接识别细菌环形二核苷酸CDN(包括cAMP和cGMP)并诱导干扰素对病原入侵的应答[33],STING的这种功能可能是机体用于应对病原免疫逃避的一种策略。
其他DNA受体所介导的信号途径大多彼此相通,例如DAI、IFI16、DDX46等受体也可通过接头蛋白STING传递信号(图3);而AIM2、胞质内IFI16则能招募ASC,激活炎性复合体通路,诱发细胞焦亡(图4)。这些受体相互联系形成复杂的DNA应答信号通路网。
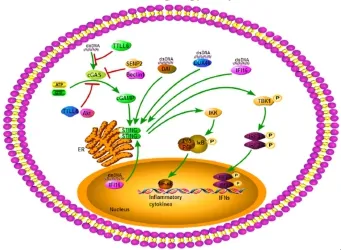
图3 DNA激发的cGAS-STING信号传导途径及其调控Fig.3 cGAS-STING signaling pathway
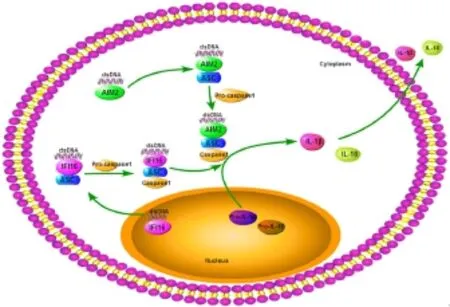
图4 AIM2介导的炎性小体活化通路Fig.4 AIM2 signaling pathway
其次,STING介导了多种DNA受体的信号转导,在天然免疫过程中发挥着重要作用,因而受到许多信号分子的调节。2009年,Zhong及其团队研究发现泛素连接酶RNF5介导的K48连接的泛素化能降解STING蛋白,第150位赖氨酸是RNF5泛素作用位点[38],接着又找到另一种泛素连接酶RNF26能作用在STING同一位点,保护蛋白的稳定[39]。除了泛素化,STING也能被磷酸化,从而减弱免疫信号。STING与相应配体(cAMP、cGMP或cGAMP)结合后转位到高尔基体膜上,ULK1磷酸化STING第366位丝氨酸,阻断IRF3与STING的连接[40],进而抑制IRF3的活化,但不影响NF-κB通路。这表明两条通路应该相互独立,可能是机体应对病原免疫逃避的一种策略。此外,另一种有趣的调控方式是通过NOD样受体——NLRC3直接与STING结合来减弱STING对TBK1的招募,抑制下游信号通路[41]。与cGAS相似,STING的活性也能被病毒蛋白抑制,例如丙肝病毒的非结构蛋白4B(NS4B)、人乳头瘤病毒蛋白E7、腺病毒的E1A蛋白以及kaposi肉瘤相关孢疹病毒的vIRF1[42-44]。
4 受体间的相互作用
目前已发现十余种DNA识别受体,但是细胞内为什么会存在这么多受体?这些受体之间是否存在相互关系,又是如何彼此影响,形成DNA识别信号通路网络?这些问题的解决对我们深入认识DNA病毒感染具有重要的意义,能帮助我们构建更有效的疾病防御方法。作为最重要的两种DNA受体,cGAS和IFI16的相互关系已经成为目前的研究热点。相较于cGAS较完善的DNA识别机制,IFI16的DNA识别研究还很缺乏,与依赖于STING的信号通路的关系也尚不清楚。已知cGAS对不同种类双链(dsDNA)的亲和力差异很大[45],且不能识别单链(ssDNA)[46]。但IFI16既能识别dsDNA,又能与ssDNA结合,说明两种受体可能互为补充。 2014年,Hansen等[47]发现cGAS、IFI16和STING在抗单核增生性李斯特菌感染人巨噬细胞中发挥着重要作用,三种基因被沉默后,检测到下游TBK1的磷酸化水平降低,同时IFN诱导表达下调。共聚焦显示IFI16与cGAS在DNA刺激后能在细胞质中共定位,激活STING,结果表明IFI16能放大依赖于cGASSTING的信号活性。随后,研究证实弗朗西斯菌感染细胞后,IFI16与cGAS能协同诱导干扰素的表达[48]。同样,在HSV病毒感染的人包皮成纤维细胞内,IFI16发挥主要病毒识别作用,病毒基因组DNA可在胞核四周与IFI16形成灶点,而cGAS通过促进IFI16蛋白的稳定表达,参与病毒感染的应答。抑制胞内cGAS的表达后,IFI16蛋白会逐渐降解,半衰期变短,但IFI16并不影响cGAS的活性。对比研究发现DNA转染刺激时,cGAS和IFI16分别在早期和晚期发挥DNA应答作用[49]。此外,最近在人巨噬细胞和角质细胞中的研究均从不同的角度揭示了两种DNA受体在信号通路活化过程中的协同作用:在巨噬细胞中,IFI16和cGAS均参与DNA病毒的识别,而IFI16能调节STING早期的活性,影响STING的二聚化和磷酸化,同时参与招募TBK1。当IFI16表达被干扰后,cGAS合成cGAMP的能力减弱[50];同样在角质细胞内,IFI16和cGAS对DNA诱导的免疫应答的完全活化是必不可少的;不同的是,在DNA介导下,IFI16能与cGAS形成一种复合物,但不影响第二信使cGAMP的产生。当STING识别cGAMP或其他环二核苷酸时,IFI16能促进STING的磷酸化和转位[51]。以上数据均反映出在病原感染过程中,宿主DNA受体cGAS和IFI16可以相互影响,共同识别胞质DNA,激活以产生I型干扰素为主的天然免疫应答(图3)。
5 DNA识别信号通路对抗感染的作用
针对病毒感染和病毒的免疫逃逸,机体主要采取充分利用免疫受体介导的信号通路的防御策略。DNA病毒、反转录病毒、胞内寄生菌、寄生虫等均能释放外源DNA,宿主因此进化出不同的DNA受体进行特异性识别,或协同识别相应配体。据报道,疱疹病毒感染细胞后,释放的病毒基因组DNA能被cGAS、IFI16识别[52];胞质内线粒体DNA在病毒刺激下被释放,从而激活cGAS-STING通路[53];感染的细胞内,病毒粒子能包裹STING,将其转运至相邻细胞内,从而抑制HSV的扩散[54],相似的是,cGAMP也能被病毒粒子转运到未感染细胞内,加速抗病毒免疫应答[55]。通过构建受体缺失的动物模型或稳定细胞系,发现动物和细胞更易被病毒感染,且产生免疫应答的能力减弱或丧失。此外,胞内寄生菌感染同样能驱动干扰素活化,如:AIM2在树突细胞中能识别布鲁氏菌释放的DNA,诱导IL-1β分泌,以抑制细菌感染[56];结核分支杆菌DNA被cGAS结合后,通过STING-TBK1信号的活化诱导细胞产生自噬[57];李斯特单核增生菌的基因组被DDX41受体识别,能激活免疫应答[58]。另外,据报道寄生虫在其生长的某些阶段也能进入细胞,从而被DNA受体识别,触发免疫应答。例如:刚地弓形虫、克氏锥虫能被TLR9识别[59-60];恶性疟原虫、伯氏疟原虫感染的红细胞能明显上调依赖于STING的干扰素的表达,尽管还未证实其识别受体[61]。大量数据表明,依赖于STING的干扰素的活化在抗病原感染过程中发挥着极其重要的作用。
6 总结
近年来,随着人们对病原DNA作为一种重要PAMP,诱导机体产生天然免疫应答机制的研究越来越重视,更多的DNA受体被发现,这些受体所介导的信号通路也逐渐被揭示。其中,以cGAS、IFI16为代表的DNA受体对细菌和病毒感染所产生的应答是机体免疫防御的重要组成部分。本文主要阐述了最近在DNA识别信号通路研究上所取得的一些认识和进步,包括不同DNA受体在配体识别机制和信号传导途径上的差异,机体对信号通路如何进行调控,受体在特定细胞内对病原的识别是否有相互作用,以及受体在不同细胞内发挥怎样的抗菌、抗病毒作用等。随着研究的深入,仍有一些关键问题需要被解决。比如,胞质DNA受体为什么能识别细胞核内病毒?如何区分外源DNA和自身DNA?这些受体介导的DNA刺激应答如何影响细胞凋亡等生理过程?感染的不同阶段,信号如何进行调节?对DNA刺激免疫应答的进一步研究对我们研制病毒疫苗、控制感染和自身免疫疾病治疗都具有指导意义。
