黑豆皮花色苷酯化修饰及其降解与抗氧化特性
2018-11-19蒋新龙蒋益花
蒋新龙 蒋益花
(浙江树人大学生物与环境工程学院,杭州 310015)
黑豆皮富含花色苷类色素,其主要成分是飞燕草素-3-葡萄糖苷和矢车菊素-3-葡萄糖苷[1]。花色苷是2-苯基-苯并吡喃阳离子结构的衍生物,属于植物多酚中类黄酮类化合物[2],有很强的抗氧化活性,具有预防心血管类疾病、糖尿病和抗肿瘤等医疗价值[3-4]。但花色苷亲脂性较差,其稳定性还受到pH、存储温度、光照、氧气、金属离子等诸多因素的影响[5-7],从而限制了其使用范围。本实验以黑豆皮花色苷为研究对象,以酯化率为衡量指标,用丁二酸酐对黑豆皮花色苷进行酯化修饰,并对其光热降解作动力学分析和抗氧化稳定性分析,为提高黑豆皮色素的稳定性提供新途径,为进一步开发利用黑豆皮花色苷提供参考。
1 材料与方法
1.1 材料与仪器
供试黑豆品种为“黑豆1号”,种皮由安徽黑粮农业种植推广专业合作社提供。取其种皮,烘干,过60目筛,备用。所用试剂为分析纯,所用水为蒸馏水。
BRUKER TENSOR 27傅里叶红外光谱仪;UV-9100紫外可见光谱仪;UV-2450PC紫外可见分光光度计;pHS-3B型精密pH计;RE-52旋转蒸发仪。
1.2 方法
1.2.1 黑豆皮花色苷的制备
根据文献[8]方法制备,得粉末状深黑色黑豆皮花色苷(black soybean anthocyanin,简称BSA,下同)。
1.2.2 酯化修饰花色苷的制备
1.2.2.1 酯化修饰工艺路线[9]
根据孙华玲等[9]制备方法并稍做改动:黑豆皮色素→无水乙醇溶解→调节一定pH值→加入丁二酸酐→水浴加热→除去乙醇和过量丁二酸酐→洗涤干燥→黑豆皮色素酯化产物(esterification modification of black soybean anthocyanin,简称 MBSA,下同)。
1.2.2.2 酯化修饰工艺优化
为使修饰反应尽可能获得最大收率,因此以酯化率(E)作为修饰色素的评价指标。酯化率参照文献[6]中的方法测定,按照式(1)进行计算。

式中:E为酯化率/%;Cl为修饰后色素的色价;ml为修饰后色素质量/g;C为原色素的色价;m为原色素质量/g。
在使用正交优化之前,应先进行单因素实验,确立合理实验的各因素和水平。
单因素平行实验:称取0.100 g黑豆皮色素,按照1.2.2.1方法对酯化修饰过程中的无水乙醇:色素的液料比、pH、酯化温度、时间、丁二酸酐:色素的配比五因素分别进行水平筛选及优化。设置丁二酸酐与黑豆皮花色苷的配比6 g·g-1,pH 为 3.0±0.1,60 ℃,3 h,考察乙醇与色素液料比(10、20、30、40、50、60 mL·g-1)对酯化率的影响;设置乙醇与黑豆皮花色苷的液料比30 mL·g-1,丁二酸酐与黑豆皮花色苷的配比 6 g·g-1,60 ℃,3 h,考察 pH(1.0、2.0、3.0、4.0、5.0、6.0、7.0)对酯化率的影响;设置乙醇与黑豆皮花色苷的液料比30 mL·g-1,丁二酸酐与黑豆皮花色苷的配比 6 g·g-1,pH 为 3.0±0.1,3 h,考察酯化温度(40、50、60、70、80 ℃)对酯化率的影响;设置乙醇与黑豆皮花色苷的液料比30 mL·g-1,丁二酸酐与黑豆皮花色苷的配比 6 g·g-1,pH 为3.0 ±0.1,60 ℃,考察反应时间(2、3、4、5、6、7 h)对酯化率的影响;设置乙醇与黑豆皮花色苷的液料比30 mL·g-1,pH 为3.0 ±0.1,60 ℃,4 h,考察丁二酸酐与色素配比(2、4、6、8、l0、12 g·g-1)对酯化率的影响。
正交实验:根据无水乙醇与黑豆皮花色苷的液料比、丁二酸酐与黑豆皮花色苷的配比、反应pH值、反应温度、反应时间5个单因素实验结果,确定丁二酸酐与色素配比、反应温度、反应时间3个关键因素进行三因素三水平正交实验。酯化修饰工艺的最终衡量标准是酯化率,以酯化率最大时的条件为最优酯化修饰条件。
1.2.3 红外光谱分析
德国布鲁克BRUKER TENSOR 27傅里叶红外光谱仪。参数设置:DTGS-KBr检测器;分辨率4 cm-1,扫描60 次,光谱采集范围为 4 000 cm-1~1 000 cm-1。分别取花色苷色素与酯化修饰色素粉末少量,与KBr混合,研磨均匀后压片,放入红外光谱仪中测定,比较酯化前后的结构变化。
1.2.4 花色苷降解实验
将酯化前后花色苷溶于75%乙醇,用pH=3.0的柠檬酸-磷酸氢二钠缓冲溶液稀释至吸光度0.2 ~0.8,进行花色苷降解实验。
热降解实验:将所制备的酯化修饰花色苷溶液,分别置于50、60、70、80、90 ℃恒温水浴10 h,每隔2 h测定吸光度值,以未酯化修饰花色苷溶液作空白对照,重复3次。
光降解实验:将所制备的酯化修饰花色苷溶液,分别置于24℃恒温室内自然光(平均光强4 000 lx)、强日光(平均光强85 000 lx)和避光条件下进行对照试验,每隔2 d测定吸光度值,以未酯化修饰花色苷溶液作空白对照,重复3次。
1.2.5 热降解动力学参数分析
假设酯化前后花色苷的热降解反应与许多学者研究结果相符[10],符合一级反应动力学,则可根据下式计算热降解反应速率常数(k)、热降解活化能(E0)、热降解半衰期(t1/2)等参数。
k、E0由 Arrhenius方程确定[8,10]:

式中:t为反应时间;c0为色素加热前的最初浓度;c为色素加热后的终浓度;k0为频率常数;E0为活化能/kJ· mol-1;R 为气体常数 (8.314 × 10-3kJ·mol-1·K-1);T 为绝对温度/K。
根据朗伯比尔定律,浓度C与溶液的吸光值A成正比,故式(1)可表示为ln(A/A0)=-kt。热降解半衰期 t1/2=0.693/k。
1.2.6 光降解动力学参数分析
方法同1.2.4。计算降解反应速率常数(k)和降解半衰期(t1/2)。
1.2.7 抗氧化能力实验
DPPH·法是用以评价天然抗氧化剂抗氧化活性的一种快速、简便、灵敏可行的方法[11]。以DPPH·清除活性作为抗氧化活性检测指标。根据文献[11]方法并加以改进来测定计算对DPPH·的清除率Y:用无水乙醇配制2×10-4mol/L的DPPH·溶液。在10 mL具塞试管中加入2 mL DPPH·溶液(2×10-4mol/L)和2 mL一定浓度的色素溶液,总体积4 mL。混合均匀,黑暗下室温避光反应30 min后,以无水乙醇调零点,于光径1 cm比色皿中测定DPPH·混合溶液在517 nm处的吸光度。

式中:Ai为2 mL DPPH·溶液+2 mL色素溶液的吸光度;Aj为2 mL色素溶液+2 mL无水乙醇的吸光度;Ac为2 mL DPPH·溶液+2 mL无水乙醇的吸光度。
分别测定花色苷处理前后对DPPH·的清除率Y%,再按式(4)计算对DPPH·的清除率Y的保存率(%):

式中:Y为处理后对DPPH·的清除率/%;Y0为处理前对DPPH·的清除率/%。
将所制备的酯化花色苷溶液,置于自然光中放置10 d,每隔2 d取样测定1次,计算对DPPH·的清除率及其保存率,并以未酯化花色苷溶液作空白对照,比较其抗氧化能力。
1.3 统计方法及分析软件
指标均重复测定3次并取平均值,利用Origin8软件作图;应用SPSS20.0软件进行数据统计,并用Duncan多重比较(SSR法)检验各处理平均数之间的差异显著性(P <0.05)。
2 结果与分析
2.1 单因素实验
2.1.1 乙醇与色素液料比对酯化率的影响
由图1可看出,在一定的液料比范围内,酯化率随液料比的增加而增大,当液料比达到30 mL·g-1时,酯化率达到最大值。在一定反应条件下,当丁二酸酐与黑豆皮花色苷用量固定时,随着液料比的增加,有利于反应物接触,提高反应效率。如液料比进一步增加,丁二酸酐和黑豆皮花色苷浓度随之减少,酯化反应速率也随之减少。当液料比达到30 mL·g-1时,酯化率与其他几个水平差异显著(P<0.05),所以后续实验黑豆皮色素与乙醇的液料比选择30 mL·g-1。
2.1.2 pH 对酯化率的影响
由图1可看出,pH值对黑豆皮花色素的影响较大,pH 3.0时酯化率最大,且与其他几个水平差异显著(P<0.05)。随着pH的增加,酯化率也随之增加,当pH超过3.0时,酯化率逐渐减少,这与其他学者研究结果不同[9]。决定pH的关键因素主要是花色苷的稳定性和丁二酸酐水解反应的快慢。本研究调节pH时本身含水,丁二酸酐的水解反应不是限制条件,最主要考虑的是花色苷的稳定性,因为黑豆皮花色苷水解平衡点约为pH 3.5[8]。所以后续选择pH 3.0的95%乙醇进行实验。
2.1.3 酯化温度对酯化率的影响
图1可知,低于60℃时,升温可提高花色苷在溶剂中的溶解度和扩散系数,从而加速酯化反应;继续升温,花色苷在高温的酸性溶液中容易降解,含量反而会降低。本实验所选酯化温度的3个水平为50、60、70 ℃。
2.1.4 反应时间对酯化率的影响
由图1可看出,2~4 h内随着时间的增加酯化率增大较明显;超过4 h,酯化率提高差异不明显。考虑能源成本,本实验所选反应时间的3个水平为3、4、5 h。
2.1.5 丁二酸酐与色素配比对酯化率的影响
由图1可知,丁二酸酐与黑豆皮花色苷的配比小于6 g·g-1时,随着丁二酸酐与黑豆皮花色苷的配比的增加,酯化率也随着增加,但是当比例超过6 g·g-1时,酯化率逐渐减少。故反应体系中不宜添加太多的丁二酸酐,本实验所选丁二酸酐与黑豆皮花色苷配比3 个水平为4、6、8 g·g-1。

图1 酯化修饰黑豆皮花色苷单因素实验结果
2.2 正交优化实验
根据单因素实验,确定液料比30 mL·g-1、pH 3.0为固定值,以丁二酸酐与色素配比、反应温度、反应时间3个关键因素进行3因子3水平正交实验,结果见表1。由表1极差R分析,可判定影响酯化率的因素主次依次排列为:反应温度(A)>丁二酸酐与色素配比(C)>反应时间(B),由表2方差分析可知,反应温度对酯化率的影响显著,其他对酯化率的影响则都不显著。直观分析,实验的最优水平组合为A2B2C3;根据每个因素K1、K2、K3,实验的最优水平组合为A2B2C2。Duncan法分析结果,反应温度50、60、70℃相互之间都有显著差异;反应温度50℃与60、70℃之间有显著差异,但60℃与70℃之间无显著差异;反应时间3 h与4、5 h相互之间有显著差异,但4 h与5 h之间无显著差异;丁二酸酐与色素配比 4 g·g-1与 6、8 g·g-1之间有显著差异,但6 g·g-1与8 g·g-1之间无显著差异。综合考虑制备成本,确定最佳工艺条件为A2B2C2,即反应温度60℃,反应时间4 h,丁二酸酐与色素配比6 g·g-1。根据预测最优条件进行验证实验,所得酯化率的平均值为46.70%,实验结果与预测值无显著差异。

表1 正交实验结果

表2 方差分析表
2.3 红外结构表征
图2为黑豆皮色素和酯化产物的红外光谱图。二者红外分析图具有相似的轮廓。对比酯化前后的花色苷谱图,不难发现,谱图最大的差异在1 716 cm-1(酯羰基CO的伸缩振动峰)和1 201 cm-1(C—O—C的基团的伸缩振动峰),其他官能团的特征吸收峰并没有明显的变化。一般来说,判断酯基存在的主要特征吸收就是CO和C—O—C的伸缩振动峰[12],因此,可以判定花色苷经过酯化修饰后,分子中含有大量的酯基,酯化反应只是在原来的花色苷分子上增加了新的酯基团。

图2 黑豆皮色素和酯化产物的红外图谱
2.4 花色苷降解动力学参数分析
2.4.1 花色苷热降解动力学参数分析
根据1.2.5方法,图3为酯化修饰前后 pH 3.0时花色苷色素液热稳定性A~t的对应实验数据。图3显示,随着温度升高,花色苷的热稳定性都降低,说明花色苷对热表现出不稳定的特性,与许多学者研究结果相吻合[13]。
根据-Ln(A/A0)-t进行线性回归,表3结果表明线性关系良好(相关系数R>0.98),酯化修饰前后花色苷热降解均符合动力学一级反应规律,与许多学者研究结果相符[14]。在相同条件下,酯化修饰花色苷的降解反应速率都比未酯化修饰的要低,且两者有显著差异(P<0.05)。说明丁二酸酐酯化修饰能提高黑豆皮花色苷的稳定性。
反应活化能是决定反应速率的重要因素,在一定温度下,活化能越大,反应越慢。根据Arrhenius方程,用花色苷降解的lnk对1/T进行线性回归,可得到复相关系数R(R>0.98)和活化能。表3显示,在一定温度下,以活化能计,MBSA>BSA,说明酯化修饰花色苷的热稳定性较好,有利于色素在热处理条件下的应用及保存。

图3 加热时间对花色苷降解的影响
半衰期是衡量花色苷热稳定性的一个重要参数,即花色苷降解50%所需的时间。从半衰期来看,花色苷溶液随温度升高,花色苷的热稳定性都降低。在较低温度50、60℃时,酯化修饰前后的花色苷热降解的半衰期有极显著差异(P<0.01),但在90℃条件下差异不显著。这是由于黑豆皮花色苷色素受热后,其结构向查耳酮转变,导致生色结构2-苯并吡喃盐和醌式假碱减少。所以加工利用过程中可以根据实际需要选择适宜的处理条件,避免长时间、高温加热,以防止花色苷的降解。

表3 花色苷热降解动力学及降解参数
2.4.2 花色苷光降解动力学参数分析
图4显示,酯化修饰前后花色苷的光稳定性不同。相同条件下,MBSA-暗处>BSA-暗处>MBSA-自然光>BSA-自然光>MBSA-强光>BSA-强光。光照强度越高,时间越长,花色苷降解程度越高。酯化修饰花色苷的光稳定性优于未酯化修饰花色苷。
不同花色苷色素液光稳定性根据-ln(A/A0)-t作图并进行线性回归,表4表明线性关系良好(R>0.98),花色苷光降解符合动力学一级反应规律,与许多学者研究结果相符[14]。表4也显示,光照强度小的稳定性好,表现为降解速率小、半衰期长。在强日光条件下,酯化修饰前后的花色苷半衰期差异不显著(P>0.05)但在自然光和避光条件下差异显著(P<0.05)。酯化修饰处理后能提高花色苷光稳定性,有利于色素的应用及保存。
2.5 抗氧化能力测定
图5显示,酯化修饰后较酯化修饰前对DPPH·清除率略有降低。随着保存时间的延长,二者对DPPH的清除率均下降且下降趋势相似,但酯化花色苷清除率下降速度略低于未酯化花色苷。因此,酯化修饰处理后能提高花色苷抗氧化稳定性。
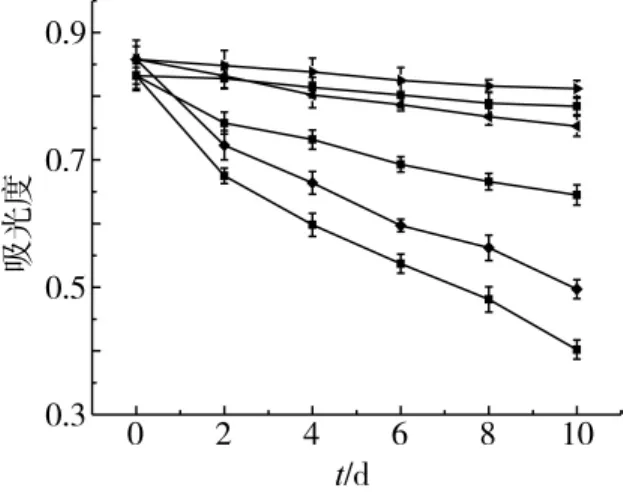
图4 光照时间对花色苷降解的影响

图5 时间对DPPH·清除率及其保存率的影响
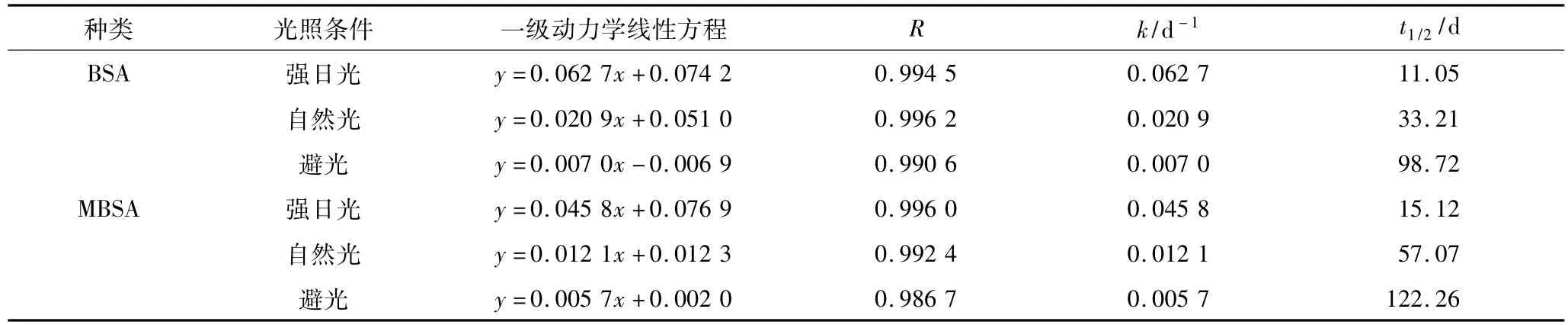
表4 不同花色苷光降解动力学及参数
3 讨论
黑豆皮花色苷主要成分是飞燕草素-3-葡萄糖苷和矢车菊素-3-葡萄糖苷,含多个酚羟基,亲脂性较差。本研究以黑豆皮花色苷为原料,丁二酸酐为酰化剂,在花色苷的酚羟基上引入酰基进行酯化修饰。研究表明:无水乙醇:色素30 mL·g-1溶解黑豆皮花色苷,在pH 3.0的介质中,丁二酸酐:色素6 g·g-1,酯化温度60℃,时间4 h,完成酯化修饰过程,所得酯化率为46.70%。红外图谱表明,用丁二酸酐对黑豆皮花色苷进行酯化修饰的花色苷并未破坏原色素的基本结构,只是在原来的花色苷分子上增加了新的酯基团。
本研究的热降解实验结果表明,在同一条件下,酯化修饰前后花色苷的降解反应速率、活化能、半衰期等参数有明显差异,丁二酸酐酯化修饰能提高黑豆皮花色苷的稳定性,与许多学者研究结果相符[15-16]。Yoshida 等[17]认为,酰基化花色苷是在分子内形成了“三明治(sandwich)”结构。酰化花色苷的有机酸与糖链相连,这些糖链像一条带子将有机酸置于 2 - 苯基苯并吡喃骨架的表面[18],Dougall[19]认为,酰基化后产生的这种结构会阻碍花色苷分子的转化,从而提高其稳定性。酯化产物的热稳定性好,主要由于酯基团的包裹作用提高了色素的热稳定性[20]。
本研究的光降解实验结果同样表明,酯化修饰处理后能提高花色苷光稳定性,表现为降解速率小、半衰期长,有利于色素的应用及保存。这还是和酯化花色苷“三明治”结构和形成有机酸-糖链堆积于2-苯基苯并吡喃骨架表面的作用有关[18]。基态的花色苷吸收光能后转变为激发态的花色苷,激发态的花色苷再发生水解等降解反应[21]。Attoe等[22]认为,光诱导花色苷降解主要是存在分子态氧的原因。酯化修饰处理尽管能通过有机酸-糖链堆积于2-苯基苯并吡喃骨架表面形成“三明治”结构,但阻挡不了分子态氧的作用。因此,不管是否酯化修饰处理,花色苷在食品中应用时,都应采用真空包装以提高产品稳定性。
本研究的抗氧化实验结果表明,对DPPH·清除率而言,酯化修饰后略有降低,这是因为丁二酸酐修饰使苯环上羟基数量减少,与张媛媛等[23]研究结果相符,但酯化修饰处理后能提高花色苷抗氧化稳定性,这还是由于酯化花色苷“三明治”结构的形成有关[18]。
4 结论
采用正交优化丁二酸酐酯化修饰黑豆皮花色苷工艺并测定其抗氧化活性。在单因素实验的基础上,运用响应面设计的理论与方法,确定了最佳酯化工艺:无水乙醇:色素30 mL·g-1,丁二酸酐:色素6 g·g-1,pH 3.0,酯化温度 60 ℃,时间 4 h。在此条件下,黑豆皮花色苷酯化率为为46.70%。
丁二酸酐酯化修饰黑豆皮花色苷的光热降解动力学都符合动力学一级反应规律,且线性关系良好(R>0.98)。以活化能计,MBSA>BSA。从半衰期来看,在较低温度50、60℃时,酯化修饰前后的花色苷热降解的半衰期有极显著差异(P<0.01)。添加丁二酸酐对黑豆皮花色苷在90℃条件下酯化修饰不显著。在自然光和避光条件下,酯化修饰前后的花色苷半衰期差异显著(P<0.05),但在强日光条件下差异不显著(P>0.05)。酯化修饰处理后能提高花色苷光热稳定性,有利于色素在光热处理条件下的应用及保存。酯化修饰处理后,黑豆皮花色苷清除DPPH·自由基能力略降低,但能提高花色苷抗氧化稳定性。
