C1轴手性3-醛基联萘酚荧光探针对胺类化合物的手性识别研究
2018-11-07刘大亮韦思平
刘大亮, 张 春, 韦思平, 王 平, 尤 强, 王 力*
(西南医科大学药学院药物化学教研室,四川泸州 646000)
应用对映选择性荧光传感器测定手性化合物对映异构体组成,是手性化合物实时测定技术中的一种重要方法,能快速测定化合物光学异构体比例,确定化合物构型[1]。尤其针对如手性胺、氨基酸、氨基醇等在生物体内中广泛存在的手性活性物质,其对映选择性识别,在生物科学、医学都有很大的应用价值[2]。因此,设计和合成具有良好底物普适性和灵敏性的新型荧光传感器也成为超分子化学研究领域的重要课题[3]。其中,基于联萘酚结构的荧光传感器,由于其强手性诱导作用、便于基团修饰等优点而得到了人们的广泛关注,并且累积了大量的优秀成果[4]。

图1 具有C1对称轴的对映体荧光传感器Fig.1 C1-symmetric enantiomeric fluorescent sensor
从已有文献来看,对具有C2对称轴的联萘酚衍生物作为手性催化剂和荧光传感器已进行了深入研究[5],然而尽管C1对称轴的联萘酚衍生物作为不对称催化剂也显示出相当大的潜力[6],但其作为手性荧光传感器研究却相对有限。Tang等[7]合成了具有C1对称轴的联萘酚荧光传感器(图1,化合物1),能够选择性识别色氨酸,并且对L-色氨酸识别效果好于D-色氨酸。2016年Xu等[8]报道了不需要金属离子参与识别的新型联萘酚荧光传感器(图1,化合物2),在没有Zn2+的条件下,该荧光传感器能在410 nm波长下选择性地识别1,2-环己二胺,并能够确定两种手性二胺的对映体构成,这是目前在该类研究中唯一成功的案例。

图2 手性荧光传感器R-3以及手性1,2-二苯基乙二胺(S,S)-4和(R,R)-4Fig.2 Enantioselective fluorescent sensor R-3 recognition with chiral 1,2-diphenylethylenediamine
2014年,Huang[9]等人开发出基于C2对称轴的3,3′-二醛-1,1′-联萘酚荧光传感器,该传感器在Zn2+存在下可对多种手性底物进行识别,在λ>500 nm处均表现出良好的识别效果,然而该配体不能对映选择性识别1,2-二苯基乙二胺,而这类二胺是Salen配体催化剂的重要的手性中间体[10]。因此,我们猜想具有C1对称轴的联萘酚衍生物能否比具有C2对称轴的3,3′-二醛-1,1′-联-2-萘酚(图2)对特定的手性化合物具有更好的识别效果。本研究以(R)联萘酚为底物,通过双羟基保护、醛基化、盐酸水解等步骤最终合成具有C1对称轴的(R)-2,2′-二羟基-3-甲酰-1,1′-联萘(R-3)。该化合物是合成联萘酚类化合物的重要中间体,但直接作为荧光传感器的研究尚未见报道。实验结果显示,R-3作为一种荧光传感器,能与某些二胺类化合物以及氨基酸作用呈现出明显的荧光增强信号,并对不同构型的胺类化合物具有一定的对映选择性。
1 实验部分
1.1 仪器与试剂
1H NMR、13C NMR使用德国Bruker公司生产的型号为Ascend 400 M核磁共振波谱仪测定,样品添加四甲基硅烷(Tetramethyl Silane,TMS)内标。荧光光谱使用日本Hitachi F-7000型荧光光谱仪在25 ℃ 下测定。在对映选择性荧光识别研究中,所用溶剂均为色谱纯或光谱纯,其中甲醇、乙醇、二氯甲烷、乙腈、N,N二甲基甲酰胺(DMF)、四氢呋喃(THF)、二甲基亚砜(DMSO)均购自北京百灵威有限公司。
(R)-(+)-1,1′-联-2-萘酚(R-BINOL)、(S)-(-)-1,1′-联-2-萘酚(S-BINOL)、NaH、氯甲基甲醚(MOMCl)、Zn(Ac)2·H2O、三氟甲磺酸锌(Zn(OTf)2)、ZnCl2、MgSO4、1,2-二苯基乙二胺(4)、1,2-环己二胺(5)、丙氨酸(6)、缬氨酸(7)为分析纯,四甲基乙二胺(TMEDA),正丁基锂(n-BuLi,1.6 mol/L in hexanes)溶液等均购自Sigma-Aldrich,如无特殊说明,均为直接使用。
1.2 R-3以及S-3合成与表征
R-3((R)-2,2′-二羟基-3-甲酰-1,1′-联萘)的制备:氮气保护下,将氯甲基甲醚保护的2.6 gR-BINOL(7 mmol)的THF溶液冷却至-78 ℃,并将1.26 mL TMEDA(8.36 mmol)以及n-BuLi溶液(2.93 mmol)依次缓慢滴入该溶液中,混合物升温至0 ℃搅拌30 min后,再次冷却至-78 ℃,将0.63 mL DMF(8.57 mmol)的THF(30 mL)溶液缓慢滴加进反应体系并继续搅拌30 min,升温至0 ℃搅拌30 min,得到黄色溶液用饱和NH4Cl水溶液(50 mL)猝灭。在加入1 mol/L HCl(30 mL)后,用乙醚(15 mL×3)萃取,合并有机相。有机相经饱和NaHCO3(50 mL)和盐水洗涤,无水MgSO4干燥。除去溶剂后的粗品用硅胶柱色谱法纯化,洗脱剂为石油醚/乙酸乙酯=20∶1~10∶1。1H NMR(400 MHz,CDCl3):δ5.21(s,1H),7.12(d,1H),7.29~7.47(m,6H),7.91~8.03(m,3H),8.37(s,1H);13C NMR(100 MHz,CDCl3):δ196.6,154.3,151.4,139.1,137.6,133.3,131.2,130.4,130.0,129.2,128.3,127.8,126.7,125.0,124.9,124.4,123.5,122.1,117.7,115.0,113.1。
S-3((S)-2,2′-二羟基-3-甲酰-1,1′-联萘)的制备,以S-BINOL为原料,制备方法同上。R-3及S-3合成步骤如下:

1.3 希夫碱8和9的合成与表征
将化合物R-3(78.5 mg,0.25 mmol)和(S,S)-4(79.5 mg,0.38 mmol)置于50 mL圆底烧瓶中,加入二氯甲烷16 mL和甲醇8 mL,加热回流24 h后冷却至室温,得到淡黄色悬浊液,减压蒸馏得到淡黄色固体,将固体置于10 mL圆底烧瓶中,加入8 mL甲醇,搅拌过夜后抽滤,并用甲醇洗涤多次,然后真空干燥得到85.5 mg产品希夫碱8,产率62%。1H NMR(400 MHz,CDCl3):δ4.40(s,1H),4.77(s,1H),7.07~7.31(m,17H),7.87~8.01(m,4H),8.71(s,1H),13.30(s,1H)。希夫碱9的制备采用R-3和(R,R)-4为原料,合成方法与上述制备方法相同,产率73%。1H NMR(400 MHz,CDCl3):δ4.40(s,1H),4.71(s,1H),7.11~7.39(m,17H),7.74~8.01(m,4H),8.62(s,1H),13.23(s,1H)。
希夫碱8和9的合成步骤如下:

1.4 荧光测量样品的制备
R-3与1,2-二苯基乙二胺的相互作用:配制R-3溶液(2.0×10-3mol/L甲醇)和Zn2+溶液(2.0×10-3mol/L甲醇),现配现用。在荧光识别研究中,将40 μLR-3溶液(2.0×10-3mol/L甲醇)和40 μL Zn2+溶液(2.0×10-3mol/L甲醇)与不同体积比的1,2-二苯基乙二胺溶液(2×10-3mol/L甲醇)在5 mL 带塞试管中混合,混合物在室温下静置3至3.5 h后,用甲醇定容至2 mL,用荧光分光光度计测试样品。R-3与1,2-二环己二胺的相互作用方法与之类似。
R-3与丙氨酸的相互作用:现配现用R-3(2.0×10-3mol/L甲醇)溶液、Zn2+(2.0×10-3mol/L甲醇)溶液和丙氨酸(2.0×10-3mol/L甲醇/水,V/V=1∶9)溶液,荧光识别研究中,在5 mL带塞试管里将40 μLR-3(2.0×10-3mol/L甲醇)溶液和40 μL Zn2+溶液(2.0×10-3mol/L甲醇)混合在不同体积的丙氨酸(2.0×10-3mol/L甲醇/水,V/V=1∶9)中,混合物均在室温下静置3至3.5 h后,用甲醇定容至2 mL,然后用荧光分光光度计测试样品。R-3与缬氨酸的相互作用方法与之类似。
2 结果与讨论
2.1 识别实验条件筛选

图3 R-3荧光发射光谱(4.0×10-5 mol/L甲醇溶液,激发波长为438 nm,狭缝宽度均为5 nm)Fig.3 The fluorescence spectrum of R-3 in methanol solution (4.0×10-5 mol/L,λex=438 nm,slits=5/5 nm)
预试验表明,仅有R-3的甲醇溶液中,当在438 nm处激发时,荧光发射光谱最大峰值出现在505 nm左右,且强度较低(图3),而R-3在Zn2+存在下与1,2-二苯基乙二胺作用后,在438 nm处激发时,荧光发射光谱在λ=560 nm处出现新的信号增强峰。1,2-二苯基乙二胺在R-3-Zn2+甲醇溶液的荧光光谱中,配合物的激发波长为是438 nm,发射波长是560 nm,斯托克斯位移122 nm。于是考察了锌盐对该反应的影响,分别使用Zn(Ac)2、Zn(OTf)2、ZnCl2作为Zn2+源进行荧光扫描,结果表明锌盐阴离子部分对该反应体系没有影响。实验中选择Zn(Ac)2。然后我们考察了溶剂对该反应的影响,对甲醇、THF、乙腈、DMF、DMSO、乙醇和二氯甲烷等多种溶剂进行考察后发现,R-3 在甲醇、DMF、DMSO和乙醇中与1,2-二苯基乙二胺作用效果均比较好。综合溶剂沸点、经济性和选择性的考虑,最终选择甲醇作为实验溶剂。
由于体系仅在添加Zn2+后在λ=560 nm处产生新的红移荧光信号,且考虑到Zn2+浓度变化可能导致荧光强度变化,我们考察了Zn2+浓度对该识别体系的影响(图(4a))。实验结果显示,当R-3的浓度为4.0×10-5mol/L,(1S,2S)-4以及(1R,2R)-4为5.6×10-5mol/L时,添加4.0×10-5mol/L Zn2+体系荧光增强最大且选择性最好,所以采用添加4.0×10-5mol/L Zn2+进行后续实验。通过绘制荧光强度随作用时间的变化曲线发现,配体和二胺的作用时间对该体系的荧光增强也有影响(图(4b)),体系的荧光强度在3 h左右基本达到稳定。
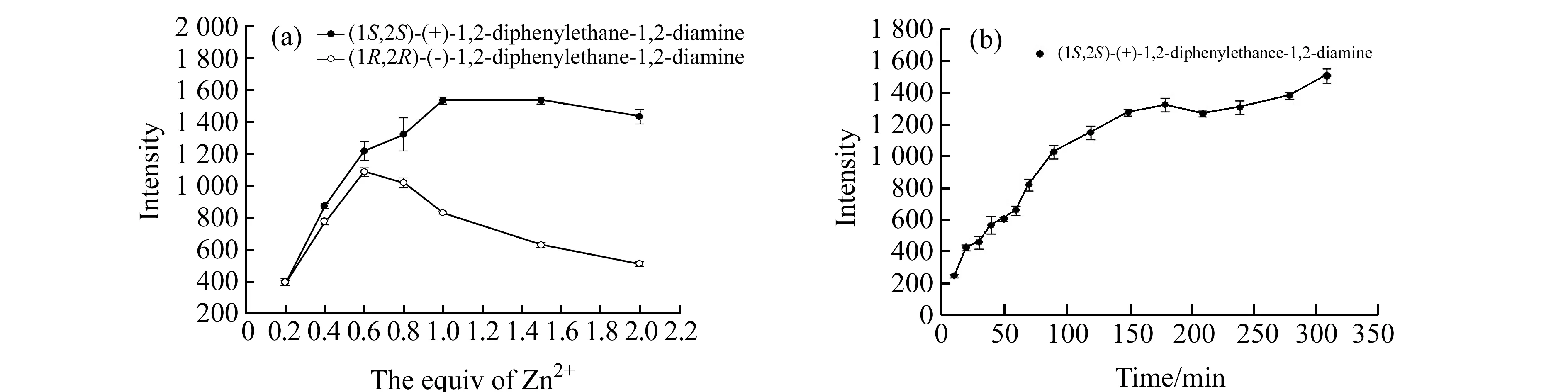
图4 (a)Zn2+浓度对体系荧光强度影响;(b)R-3(4.0×10-5 mol/L,甲醇溶液)和(1S,2S)-4(4.0×10-5 mol/L,甲醇溶液)作用时间对荧光强度的影响Fig.4 (a)The effect of Zn2+ concentration on the fluorescent recognition;(b)The effect of interaction time on the fluorescence enhancement in methanolR-3(4.0×10-5 mol/L),(1S,2S)-4 or (1R,2R)-4(5.6×10-5 mol/L),and Zn2+(4.0×10-5 mol/L) in methanol solution,λex=438 nm,slits=5/5 nm,1 cm.
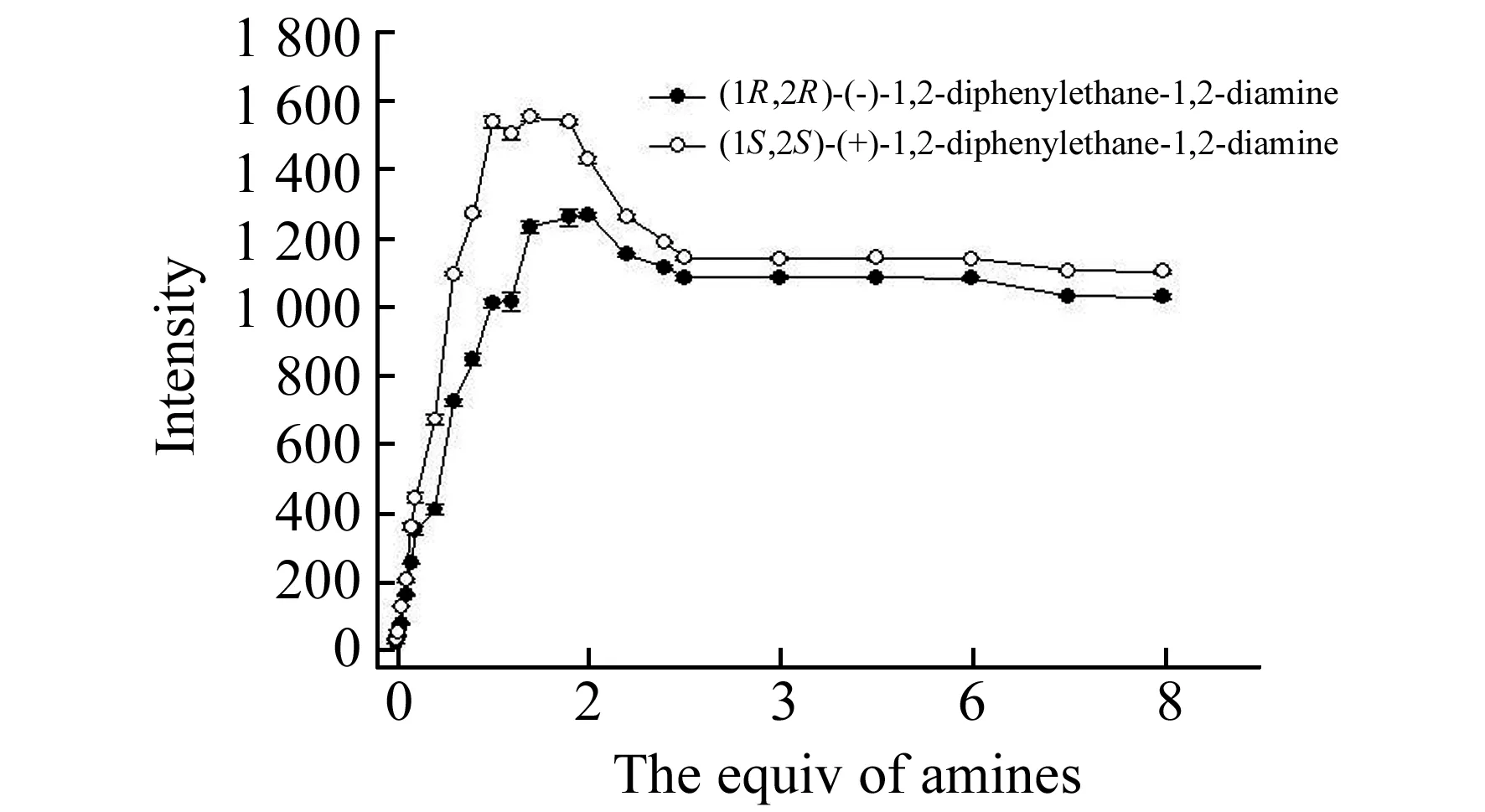
图5 1,2-二苯基乙二胺浓度对荧光强度的影响Fig.5 The influence of the diamines concentration on the fluorescent recognitionR-3 (4.0×10-5 mol/L) and Zn2+ (4.0×10-5 mol/L) in methanol solution(4.0×10-5mol/L),λex=438 nm,slits=5/5 nm,3 h.
通过绘制(S,S)-4以及(R,R)-4的荧光滴定曲线(λemi=560 nm),我们考察了1,2-二苯基乙二胺摩尔浓度对体系选择性的影响(图5)。结果表明加入的手性1,2-二苯基乙二胺摩尔浓度大小会影响传感器对其的对映选择性,在4.0×10-5mol/LR-3溶液中当加入5.6×10-5mol/L的1,2-二苯基乙二胺(1.4倍当量)时其对映选择性最佳,而随着其摩尔浓度的继续增加,体系的荧光强度和对映选择性均相应降低,曲线变化趋于平稳。

图6 R-3(a)与S-3(b)对映选择识别1,2-二苯基乙二胺Fig.6 The confirmation of the enantioselective recognition of ligand 3 against diamines(a)R-3 and Zn2+ in methanol solution(4.0×10-5 mol/L),λex=438 nm,slits=5/5 nm,5.6×10-5 mol/L amine in methanol,1 cm,3 h;(b) S-3 and Zn2+ in methanol solution (4.0×10-5 mol/L),λex=438 nm,slits=5/5 nm,5.6×10-5 mol/L amine in methanol,1 cm,3 h.
2.2 对映选择性荧光响应的确认
为了确认该变化与3-醛基联萘酚的手性诱导作用有关,我们制备了其对映体(S)-3,研究其对(S,S)-和(R,R)-4的荧光响应(图6)。R-3、Zn2+分别和(1S,2S)-(+)-1,2-二苯基乙二胺和(1R,2R)-(-)-1,2-二苯基乙二胺作用后的最大荧光强度为1 600和1 200,而S-3、Zn2+分别和(1S,2S)-(+)-1,2-二苯基乙二胺以及(1R,2R)-(-)-1,2-二苯基乙二胺的最大荧光强度为1 200 和1 600,基本呈镜像关系,进一步证明实验结果的正确性。该结果表明,3-醛基手性联萘酚配体确实可以对不同构型的二胺进行识别,当使用(R)-3-醛基联萘酚时,一定浓度范围内,荧光增强幅度较大的为(1S,2S)-(+)-1,2-二苯基乙二胺,增强幅度较小的为(1R,2R)-(-)-1,2-二苯基乙二胺;使用(S)-3-醛基联萘酚时,则刚好相反。
2.3 结合常数计算
随着1,2-二苯基乙二胺浓度增大,R-3浓度为4.0×10-5mol/L,在λ=560 nm处荧光发射强度逐渐增强(图7(a)和7(b)),这也符合Benesi-Hilderand方程的线性表达[11]。通过计算R-3和(1R,2R)-4以及(1S,2S)-4的结合常数为KR=1.17×104L/mol,KS=0.82×104L/mol,KR/KS值为1.432。利用同样方法也可计算R-3分别和(1S,2S)-1,2-环己二胺(1S,2S)-5)/(1R,2R)-1,2-环己二胺(1R,2R)-5,以及其他手性氨基酸类化合物,如丙氨酸(L-6/D-6)、缬氨酸(L-7/D-7)结合常数。
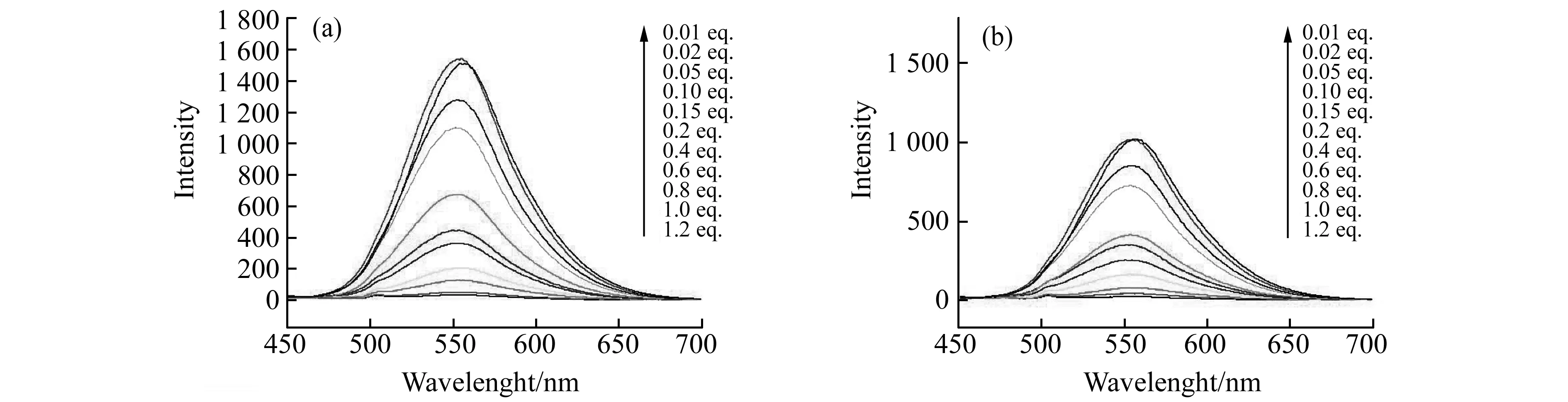
图7 1,2-二苯基乙二胺浓度对R-3荧光增强的影响Fig.7 The effect of 1,2-diphenylethylen diamine concentration on the R-3 fluorescence enhancement(R-3)(4.0×10-3 mol/L),Zn2+(4.0×10-5 mol/L);(a)(1S,2S)-4)(4.0×10-7-4.8×10-5 mol/L);(b)(1R,2R)-4(4.0×10-7-4.8×10-5 mol/L;λex=438 nm,slits=5/5 nm,1 cm,3.5 h,methanol solution.
2.4 识别机理研究
我们认为该体系荧光增强可能是由于荧光传感器R-3和1,2-二苯基乙二胺作用生成的希夫碱与Zn2+形成配合物导致的。为此,分别合成化合物8和9两种构型的1,2-二苯基乙二胺与R-3形成的希夫碱(图8),并测试其荧光响应情况。在相同浓度下的8和9溶液中,当添加了Zn2+后,在560 nm处两者荧光均增强,而未添加Zn2+的样品中没有发现荧光增强现象。此外,化合物8-Zn2+较化合物9-Zn2+表现出更大的荧光增强,这与R-3对1,2-二苯基乙二胺的手性识别实验结果一致。

图8 希夫碱8和9在甲醇(4.0×10-5 mol/L)中的荧光响应Fig.8 The fluorescence response of 8 and 9 in methanol solution (4.0×10-5 mol/L) in presence or absence of Zn2+λex=438 nm,slits=5/5 nm.1 cm,3.5 h.
3 结论
3-甲酰基-1,1′-联-2-萘酚可以作为一种荧光传感器,对手性二胺和氨基酸进行对映选择性识别。在Zn2+存在下,该传感器对手性二胺和手性氨基酸都可以表现出极大的荧光增强,且最大发射波长红移至560 nm处,表现出适度的对映体选择性。该方法简便快捷、灵敏度高。通过添加Zn2+和胺类化合物形成稳定的希夫碱金属配合物,可能是该体系能够表现出对映选择性荧光增强的原因。
