食品用萜类化合物的生物合成研究进展
2018-11-05陈卓静祁勇刚柳志杰
宗 朕,程 磊,陈卓静,王 磊,汪 超,祁勇刚,柳志杰*
(湖北工业大学 工业发酵湖北省协同创新中心,湖北 武汉 430068)
1 萜类化合物生物合成系统研究的意义
萜类化合物是广泛存在于动物、植物、微生物中的一大类天然化合物,以异戊二烯为基本骨架,在各种合成酶、修饰酶作用下生成,又称为类异戊二烯(isoprenoid)。根据结构中异戊二烯数目,可将其分为半萜、单萜、倍半萜、二萜、三萜、四萜及多萜。在萜类化合物的合成过程中,由于合成所需的萜类合酶(terpene synthases,TPS)以及修饰酶的多样性[1-2],使得最终生成的萜类化合物结构繁多,种类丰富,具有多样的生物活性及理化性质,在医药[3-6]、农药[7-8]、食品、日化用品[9-10]、能源[11]等多个领域拥有广泛的应用及广阔的发展前景,萜类化合物在食品中的应用见表1。
在半萜类化合物中,异戊醇和异戊烯醇在食品中应用较为广泛,异戊醇可用于食品香料的配制[12],异戊烯醇可用于食品香料柠檬醛[13]的合成。
在单萜类化合物中,薄荷醇、紫苏醇、月桂烯和芳樟醇作为植物精油中的主要成份,是植物花、果实香味的主要来源,因此常用于食品香精香料[14-15]。
倍半萜中α-金合欢烯可作为食品香精[12]。在二萜中,甜菊糖苷作为一种天然的甜味剂在食品行业中应用广泛[16]。在三萜中,人参皂苷作为食药两用类化合物,在保健食品、医药中应用广泛。

表1 各类型萜类化合物在食品及其他领域中的应用Table1 Application of various terpenoids in food and other fields
四萜和多萜类化合物在食品中应用较多,如四萜中的番茄红素和虾青素均具有很强的抗氧化活性[17-18],可作为功能食品的功能成分;多萜中的视黄醇对维持人体正常发育以及正常视觉功能具有重要作用,维生素K对正常凝血及骨骼代谢具有重要作用,因此两者常用作食品营养强化剂。
综上所述,萜类化合物在食品领域具有广泛和重要的应用,对人体健康及日常生活都有重要的影响。目前萜类化合物的合成方法主要有:植物提取法、化学合成法及生物合成法。相比于其他两种方法,生物合成法生产不受原料限制、过程绿色环保、产物单一、产量有较大的提升空间,有更大的发展潜力,实现萜类化合物的大规模生物合成对人类的健康、环保、可持续发展具有重要的意义。
2 萜类化合物的生物合成
萜类化合物从其前体物质到结构、功能各异的终产物的生物合成过程包括了三个阶段(见图1):第一阶段为中间体异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)的合成;第二阶段为香叶基焦磷酸(geranyl pyrophosphate,GPP)、法呢基焦磷酸(farnesyl pyrophosphate,FPP)、香叶基香叶基焦磷酸(geranylgeranyl pyrophosphate,GGPP)等直接前体物质的合成;第三阶段为萜类化合物碳骨架的形成及修饰。
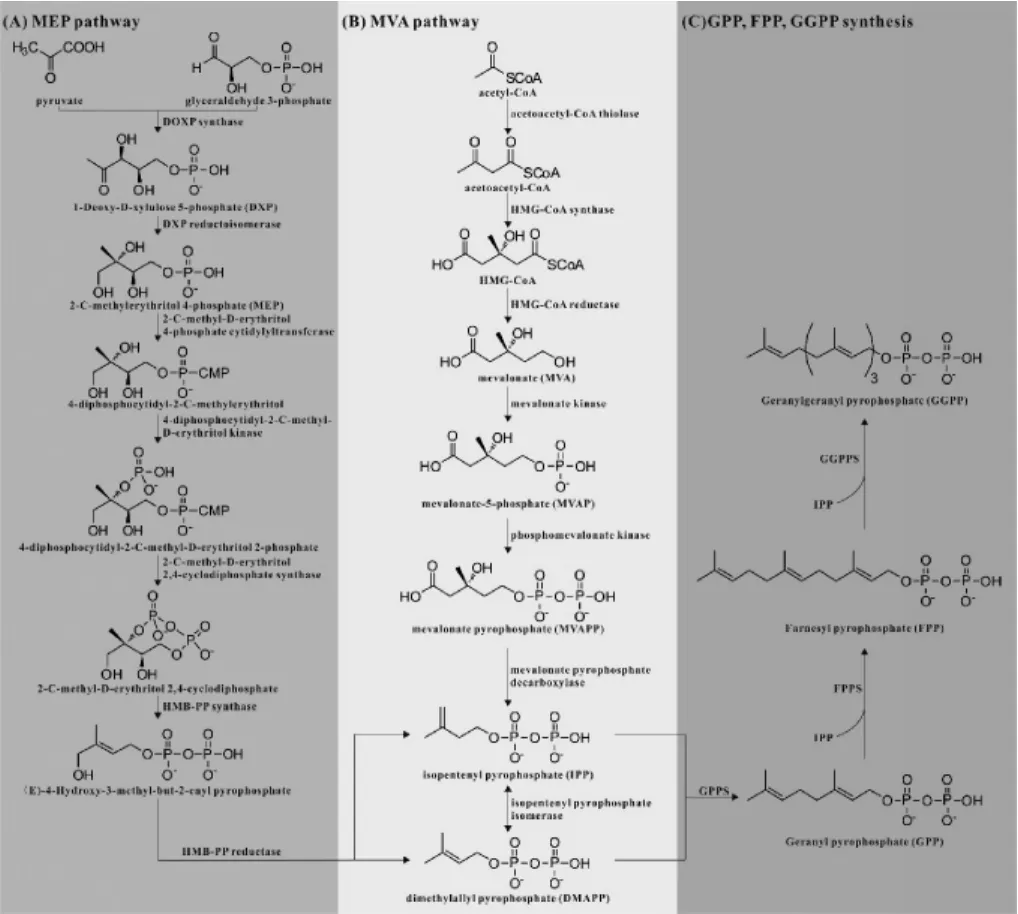
图1 萜类化合物生物合成途径Fig.1 Biosynthesis pathways of terpenoids
2.1 萜类化合物中间体IPP和DMAPP的生物合成途径
目前已发现的萜类化合物中间体IPP和DMAPP的生物合成途径有两种:2-甲基-D-赤藓糖醇-4-磷酸(2-methy-D-erythrito-4-phosphate,MEP)途径和甲羟戊酸(mevalonic acid,MVA)途径。两种途径的差异在于前体物质、酶以及反应所在的亚细胞空间位置[19],但最终都生成了萜类化合物的中间体IPP和DMAPP,而且两途径的产物还可以通过质体膜进行交换[20]。
2.1.1 MEP途径
MEP途径是在20世纪末发现的一条萜类化合物中间体生物合成途径,主要存在于细菌、藻类和植物质体中,该途径以丙酮酸和甘油醛-3-磷酸为前体合成萜类化合物中间体IPP和DMAPP,其过程见图1(A)。
在MEP途径中,前体物质一分子丙酮酸和一分子甘油醛-3-磷酸在1-脱氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose 5-phosphate synthase,DXS)催化下生成1-脱氧-D-木酮糖-5-磷酸,该步骤是MEP途径中第一个限速步骤,DXS也是该途径中的限速酶之一[22]。之后1-脱氧-D-木酮糖-5-磷酸在1-脱氧-D-木酮糖-5-磷酸还原异构酶催化下生成MEP,该步反应是1-脱氧-D-木酮糖-5-磷酸流向的分支点,也是MEP代谢途径调控的重要靶点,是MEP途径的限速步骤,1-脱氧-D-木酮糖-5-磷酸还原异构酶也是MEP途径中关键酶之一[23]。MEP再在2-甲基-D-赤藓醇-4-磷酸胞苷酰转移酶催化下生成4-二磷酸胞苷-2-C-甲基赤藓醇;之后4-二磷酸胞苷-2-C-甲基赤藓醇在4-焦磷酸胞苷-2-C-甲基赤藓糖醇激酶催化下生成4-二磷酸胞苷-2-C-甲基-D-赤藓醇-2-磷酸,生成的4-二磷酸胞苷-2-C-甲基-D-赤藓醇-2-磷酸在2-甲基赤藓糖-2,4-环二磷酸合酶催化下生成2-C-甲基-D-赤藓醇2,4-环二磷酸,下一步,2-C-甲基-D-赤藓醇2,4-环二磷酸在4-羟基-3-甲基-2-(E)-丁烯基-4-二磷酸合酶催化下生成4-羟基-3-甲基-2-(E)-丁烯基-4-二磷酸,最终4-羟基-3-甲基-2-(E)-丁烯基-4-二磷酸在4-羟基-3-甲基-2-(E)-丁烯基-4-二磷酸还原酶催化下转化为IPP和DMAPP。
2.1.2 甲羟戊酸途径
甲羟戊酸(mevalonate,MVA)途径是发现较早的萜类化合物中间体生物合成途径,主要存在于真核生物细胞质中,其以乙酰辅酶A为前体合成萜类化合物中间体IPP和DMAPP,其过程见图1(B)。
在MVA途径中,首先是两分子乙酰辅酶A在乙酰辅酶A硫解酶催化下生成乙酰乙酰辅酶A,然后乙酰乙酰辅酶A与一分子乙酰辅酶A在3-羟基-3-甲基戊二酰辅酶A合成酶催化下生成3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)。之后HMG-CoA在3-羟基-3-甲基戊二酰辅酶A还原酶催化下生成MVA,该步反应是不可逆过程,所参与的3-羟基-3-甲基戊二酰辅酶A还原酶是MVA途径中第一个限速酶[21],对细胞质中萜类化合物的代谢起着重要的调控作用。MVA再在甲羟戊酸激酶催化下生成甲羟戊酸-5-磷酸(mevalonate-5-phosphate,MVAP),之后MVAP在磷酸甲羟戊酸激酶催化下生成甲羟戊酸-5-焦磷酸(mevalonate-5-pyrophosphate,MVAPP),最后MVAPP在甲羟戊酸焦磷酸脱羧酶催化下生成IPP。IPP在异戊烯焦磷酸异构酶催化下生成其双键异构体DMAPP。
2.2 萜类化合物直接前体GPP、FPP、GGPP的生物合成
GPP、FPP、GGPP是不同分子数目的IPP与DMAPP在不同异戊烯焦磷酸合成酶作用下生成的[23],因此三者具有不同大小的分子量,作为不同类型萜类化合物的直接前体,用于不同类型萜类化合物的合成。GPP是一分子IPP与一分子DMAPP在香叶基焦磷酸合酶催化下缩合形成,用于单萜类化合物的合成;FPP是GPP与一分子IPP在法呢基焦磷酸合酶催化下形成,用于倍半萜和三萜的合成;GGPP是FPP与一分子IPP在香叶基香叶基焦磷酸合酶的催化作用下生成,用于二萜和四萜类化合物的合成(图1C)。
2.3 萜类化合物碳骨架的形成与修饰
GPP、FPP、GGPP在TPS催化下形成萜类化合物碳骨架或最终萜类化合物,其中单萜、倍半萜和部分二萜可以分别以GPP、FPP、GGPP为前体在TPS催化下直接合成,但部分二萜、三萜、四萜及多萜以GPP、FPP、GGPP为前体在TPS催化下形成的是最终萜类化合物的碳骨架,还需在各种修饰酶的作用下对碳骨架进一步修饰,如环氧化、羟基化、异构化、糖基化等[24],形成具有不同结构功能的萜类化合物。3利用生物合成法生产食品用萜类化合物
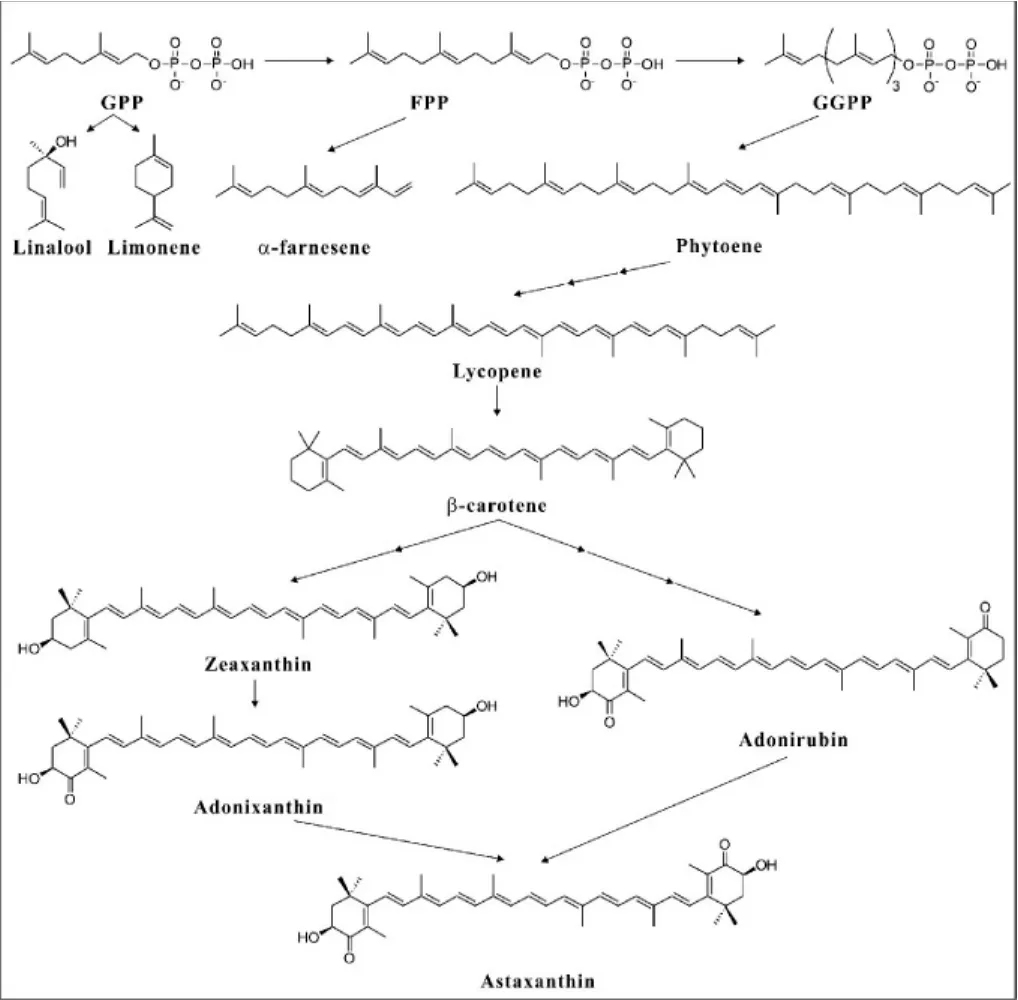
图2 食品用萜类化合物合成过程Fig.2 Synthetic process of terpenoids for food
在萜类化合物的合成方法中,生物合成法因其所具有的特点而成为萜类化合物工业化大规模生产应用中最具潜力的方法。目前,人们研究最多的是运用基因工程、代谢工程以及合成生物学的方法,以微生物作为底盘细胞来生产萜类化合物,在原核微生物中主要是大肠杆菌,真核微生物中主要是酿酒酵母和近几年备受关注的解酯耶氏酵母。此外,在毕赤酵母[25]、红法夫酵母[26]、马克斯克鲁维酵母[27]、谷氨酸棒状杆菌[28]、恶臭假单胞菌[29]中也有研究。主要用于合成的食品用萜类化合物有芳樟醇、柠檬烯、α-金合欢烯、番茄红素、β-胡萝卜素、玉米黄质、虾青素等,这些物质生物合成过程见图2。
3.1 原核微生物
大肠杆菌(Escherichiacoli)作为原核微生物中模式菌株,已对其有深入的研究,目前已作为底盘细胞用于多种食品用萜类化合物的合成。
利用E.coli内源的MEP途径提供萜类合成所需的前体化合物,通过异源表达各萜类合酶编码基因,可以实现E.coli对各种萜类的合成。THANASOMBOON R等[30]通过向E.coli中转入编码GPPS和LIS的基因,使芳樟醇在大肠杆菌中的合成量接近90 mg/L。为了增加E.coli中目标物质的产量,第一个策略是增加目标产物前体的供应。在不引入外源前体合成途径的前提下,通过过表达MEP途径中限速酶(DXS、IDI、GPPS、FPPS)编码基因增加中间体和直接前体的供应以增加目的产物的产量。ZHOU Y等[31]通过敲除E.coli中编码葡萄糖-6-磷酸脱氢酶的基因zwf,过表达MEP途径中各限速酶(idi、dxs、ispDF)基因,使工程菌株番茄红素产量达到6.85~7.55 mg/g菌体干质量。为了进一步增加目标产物的产量,仅依靠内源途径来供应前体,这依然是不足的,越来越多的研究在E.coli中引入了异源MVA途径并过表达该途径中限速酶(tHMGR、IDI)编码基因来提供更多的前体,使萜类化合物的产量进一步提高。ALONSOGUTIERREZ J等[32]在E.coli中构建异源MVA途径并异源表达LS的编码基因,在以葡萄糖为碳源的培养条件下,最终柠檬烯的产量达到435 mg/L。KIM EM等[33]通过在E.coli中引入异源MVA途径,过表达GPPS和来自冬青栋的MS编码基因,使得E.coli月桂烯产量达到(1.67±0.029)mg/L,再利用原位分离和以甘油作为碳源等手段对培养条件进行优化,使月桂烯最终产量达到(58.19±12.13)mg/L。SHENHJ等[34]利用可调的基因间隔区(thetunableintergenic regions,TIGRs)协调酿酒酵母(S.cerevisiae)中MVA途径基因在E.coli中的异源表达,使用IPP/FPP响应启动子动态调节TIGR介导的MVA途径,防止有毒性代谢物的积累。通过代谢调控,在5L的发酵条件下,玉米黄质的产量达到722.46 mg/L。ZHU FY等[35]通过在E.coli中引入异源MVA途径和密码子优化后的番茄红素合成基因crtE、crtB、crtI,并过表达idi基因,使得在100 L培养条件下,E.coli合成番茄红素的产量达到34.3 mg/g菌体干质量。WANG CL等[36]在E.coli中引入异源MVA途径和密码子优化后的α-金合欢烯合成酶基因,并过表达内源MEP途径中限速酶FPPS编码基因IspA,使E.coli生产α-金合欢烯的产量达到380 mg/L。
第二个策略是截断或抑制与目的产物利用共同前体的竞争途径,使前体更多地用于目标产物的合成,如:敲除E.coli中gdh、zwf、iclR等基因。TAWORNSAMRETKIT I等[37]基于约束建模法中的通量分析法对合成E.coli[30]中芳樟醇合成的代谢网络进行分析,并利用单基因敲除分析法来提高芳樟醇的产量,在分析后发现与未敲除gdh基因菌株相比,敲除gdh基因后,该合成E.coli中芳樟醇的产量提高了14倍。CHENY Y等[38]利用CIChE整合表达载体将番茄红素合成基因整合到E.coli基因组中,并利用三氯生诱导异源基因拷贝数的增加,再通过过表达基因appY,替换其天然启动子为T5,敲除E.coli中iclR基因等方法对E.coli合成番茄红素的产量进行优化,使番茄红素的产量达到33.43 mg/g菌体干质量。
3.2 真核微生物
与原核微生物相比,真核微生物中拥有内源MVA途径,在前体供应上有天然的优势,且从安全方面讲,酿酒酵母、解酯耶氏酵母(Yarrowia lipolytica)也比E.coli有更高的安全性,故利用真核微生物,特别是酵母来生产食品用萜类化合物有更多的研究。
在真核微生物中,为增加异源萜类化合物的合成,第一个策略是过表达MVA途径中限速酶(HMGR、IDI、GPPS、FPPS、GGPPS)编码基因以增加MVA途径提供的前体,可以通过使用强启动子引导基因转录、增加基因拷贝数的手段实现基因过表达。第二个策略是对代谢途径中关键酶进行修饰以增加酶的催化活力和稳定性,最终提高目标产物的产量,可以通过定点突变、定向进化、蛋白融合的手段来实现。第三个策略是通过抑制竞争途径中基因的表达、外源增加竞争途径的合成产物来减少竞争途径对共同前体的利用,使共同前体更多地用于目标产物的合成。目前,越来越多的研究采用多策略协同实施来尽可能提高目的产物的产量。
3.2.1 酿酒酵母
酿酒酵母(Saccharomyces cerevisiae)作为酵母中的模式菌株,广泛应用于各种化合物的异源合成,在芳樟醇、β-胡萝卜素、番茄红素等食品用萜类的合成中有研究。
AMIRIP等[39]在S.cerevisiae中异源表达LIS的编码基因,通过过表达tHMG1,替换启动子为阻遏型启动子MET3抑制ERG9表达的方法增加了FPP向芳樟醇合成的通量,使S.cerevisiae中芳樟醇产量达到95μg/L。DENGY等[40]在S.cerevisiae中将异源芳樟醇合酶与内源FPPS以融合蛋白的形式表达,通过优化肽接头长度、蛋白连接方式以及培养条件,最终LIS与FPPS的N末端相连且以(GGGGS)3连接的融合蛋白使菌株芳樟醇产量最高,达到(240.64±5.31)μg/L。SUN Y X等[41]利用逆代谢工程的方法对S.cerevisiae异源合成β-胡萝卜素进行了研究。通过实验发现,单独过表达MVA途径中基因不能高效提高β-胡萝卜素的合成,通过外源添加不饱和脂肪酸,增加了(acetyl-CoA)合成β-胡萝卜素的通量,最终在添加60 mg/L棕榈油酸时,S.cerevisiae异源合成β-胡萝卜素的产量达到2.83 mg/g菌体干质量。XIEW P等[42]利用定向进化和代谢工程的手段构建番茄红素高产S.cerevisiae菌株。首先在S.cerevisiae中异源表达经修饰的双功能酶CrtYB,通过定向进化的方法去除了该酶中的番茄红素环化酶功能域,乃保留八氢番茄红素合成酶的功能。第二步,将修饰后的CrtYB与来自发夫酵母的CrtE、CrtI以及酿酒酵母的tHMG1基因共表达。第三步,再通过定向进化对CrtE进行修饰和改变各Crt基因的拷贝数创造多个途径变体对产量进行优化。最终通过补料分批发酵,番茄红素产量达到1.61 g/L。
3.2.2 解酯耶氏酵母
解酯耶氏酵母属于非传统酵母,是油脂酵母中的模式菌株,近几年针对解酯耶氏酵母在合成生物学中的研究越来越多,在食品用萜类,尤其是疏水性萜类的异源合成中也得到了广泛的利用。
CAOX等[43]首先在Y.lipolytica中过表达异源LIS编码基因,实现了芳樟醇的异源合成。之后在对LIS与MVA途径中酶的编码基因(HMG1、ERG8、ERG10、ERG12、ERG19、IDI1)分别共过表达的研究发现:LIS编码基因与IDI1共过表达时芳樟醇产量最高。接下来将LIS、IDI1与定点突变后的ERG20F88W-N119W共过表达使芳樟醇产量进一步提高。最后通过以柠檬酸和丙酮酸作为碳源的摇瓶培养,使Y.lipolytica芳樟醇产量达到(6.96±0.29)mg/L。CAOX等[44]在Y.lipolytica中异源表达密码子优化后的LS和橙花基焦磷酸合酶1(neryl diphosphate synthase 1,NDPS1)的编码基因,实现了Y.lipolytica中柠檬烯的生产。通过过表达MVA途径中HMGR和MK的编码基因tHMG1和ERG12,向培养基中添加适量丙酮酸和十二烷对培养条件的优化,使得柠檬烯在解酯耶氏酵母中的产量达到23.56 mg/L。YANGX等[45]将密码子优化后的α-金合欢烯合酶基因(optFS)在Y.lipolytica中异源表达,实现了Y.lipolytica中α-金合欢烯的合成。通过将optFS与ERG20以融合蛋白的形式表达,过表达tHMG1、IDI、ERG20的手段提高了α-金合欢烯的产量,最后通过补料分批发酵使Y.lipolytica中α-金合欢烯产量达到(259.98±2.15)mg/L。MATTHÄUSF等[46]将的来自菠萝泛菌的crtB和crtI基因经密码子优化后在Y.lipolytica中异源表达,并过表达类异戊二烯合成途径中限速酶基因(GGS1、HMG1),以增加番茄红素合成中前体的供应。随后,通过敲除内源代谢中β-氧化第一步涉及基因(POX1、POX2、POX3、POX4、POX5、POX6)和编码甘油醛-3-磷酸脱氢酶基因(GUT2)的方法增加胞内脂质体的含量,以提高胞内番茄红素的积累。最后,补料分批发酵使Y.lipolytica中番茄红素的产量达到16 mg/g菌体干质量。GAO SL等[47]敲除了DNA连接蛋白ku70的核心,提高了Y.lipolytica整合DNA长片段的效率,通过异源表达基因carRp和carB,实现了β-胡萝卜素在Y.lipolytica中的合成。之后进行了β-胡萝卜素合成所需的内源基因(ERG10、ERG13、tHMGR、ERG12、ERG8、ERG19、IDI、ERG20、GGS1)和外源基因(carRP、carB、carRP)在Y.lipolytica中的多拷贝整合试验,发现在将多拷贝carRp、tHMGR整合到Y.lipolytica基因组中时,β-胡萝卜素产量最高。最后通过补料分批发酵中对培养条件的优化,使β-胡萝卜素在Y.lipolytica的产量达到4 g/L。
4 展望
目前,虽然有多种食品用萜类化合物实现了微生物的生物合成,但由于受合成量较低、复杂萜类化合物不能实现终产物的合成、工程菌株性状不稳定等因素的制约,无法实现实际产业化的应用。针对存在的问题,一方面,随着利用基因工程、代谢工程的手段对萜类化合物生物合成途径更深入的研究,能够进一步阐明复杂萜类化合物代谢途经,鉴定其中涉及的酶及相关基因,对目标物质的代谢进行更加精确、适当的调控,以提高产量,实现复杂萜类化合物完整合成。另一方面,通过基因组测序等手段,不断增加对模式菌株性状、功能的认识,根据不同微生物的特点来匹配其最适合生产的化合物,对微生物资源进一步挖掘和最适的改造,使之服务于食品用萜类的低成本、规模化合成。
