代谢工程改造酿酒酵母生产2,3-丁二醇的研究进展
2018-11-05刘德安王长丽葛菁萍
刘德安,王长丽,丁 昊,葛菁萍,2*
(1.黑龙江大学生命科学学院 微生物学黑龙江省高校重点实验室,黑龙江 哈尔滨 150080;2.农业微生物技术教育工程研究中心,黑龙江 哈尔滨 150500)
随着当今社会经济的蓬勃发展,能源短缺逐渐成为人类发展进程的绊脚石,所以开发绿色新能源,减缓石油危机迫在眉睫[1]。基于酿酒酵母(Saccharomyces cerevisiae)全基因组测序的完成,利用代谢工程手段对S.cerevisiae进行遗传学改造,为实现生物燃料如乙醇、2,3-丁二醇(2,3-butanediol,2,3-BD)的工业化生产提供了保障[2]。此方法的兴起不但能在保护生态环境的同时发展经济,实现能源结构的绿色转型,更是响应“十一五”发展规划、推动节能减排号召的一种有效手段。
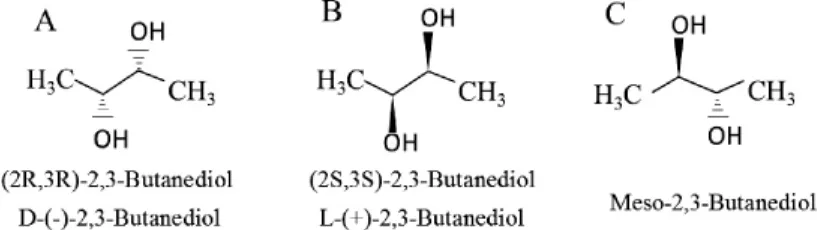
继乙醇之后,2,3-BD是一种性价比较高的新兴能源化合物,广泛应用于航空航天、食品、医药等领域。2,3-BD脱羧化反应合成乙偶姻(acetoin)和双乙酰(2,3-butanedione),可以作为食品风味添加剂等[3]。20世纪中期,以石油为原料化学法合成2,3-BD一直占据主导地位。直到20世纪后期,特别是21世纪以来,石油危机、粮食短缺和环境污染等问题的日益加剧,使得生物法合成2,3-BD又重新吸引了国内外学者的目光,对其的研究再次成为了关注的热点[4]。2,3-BD的结构式如下:
自然界存在许多天然合成2,3-BD的微生物(见表1),如肺炎克雷伯氏菌(Klebsiella pneumonia)[5]、产酸克雷伯氏菌(Klebsiellaoxytoca)[6]、产气肠杆菌(Enterobacter aerogenes)[7]、多粘类芽孢杆菌(Paenibacillus polymyxa)[8]、S.cerevisiae[9],这些微生物能应用代谢工程策略提高2,3-BD的生产性能。因此,有研究利用敲除副产物合成途径的关键酶编码基因的手段来提高2,3-BD的产量[10-12]。SANGPROO M等[13]在K.oxytoca细胞内敲除副产物合成途径中的乙醛脱氢酶(acetaldehyde dehydrogenase,ALDA)、乙醇脱氢酶(alcohol dehydrogenase,ADH),最终使工程菌株的2,3-BD产量达到114 g/L。利用代谢工程手段虽然能有效地提高细菌2,3-BD的产量,但诸如克雷伯氏菌属(Klebsiella sp.)和肠杆菌属(Enterobacter sp.)等细菌大都是条件致病菌,违反了绿色安全工业化生产的标准[13]。因此,利用公认安全无毒(generally regarded assafe,GRAS)微生物S.cerevisiae改造合成2,3-BD的代谢途径成为新的研究热点[14]。
近代以来随着代谢工程原理与技术的不断深入研究,关于S.cerevisiae产2,3-BD代谢途径改造的深入探索,改造方法和手段的不断创新,2,3-BD的生产得到了大幅度增加。本研究总结了近年来利用代谢工程原理和方法对S.cerevisiae代谢网络进行重新设计和合理改造的三种策略。并展望未来S.cerevisiae的重点研究方向。

表1 产2,3-BD的微生物Table1 2,3-butanediol-producing microorganism
1 微生物中2,3-BD的代谢途径
在细菌的2,3-BD代谢途径中(见图1A),糖类物质经糖酵解途径(embden meyerhof pathway,EMP)变为丙酮酸,丙酮酸经α-乙酰乳酸合成酶(α-acetolactatesynthase,ALS)、α-乙酰乳酸脱羧酶(α-acetolactatedecarboxylase,ALDC)和乙偶姻还原酶(acetoin reductase,AR)或称2,3-BD脱氢酶(2,3-butanediol dehydrogenase,BDH)3个关键酶共同催化后合成α-乙酰乳酸、乙偶姻和2,3-BD[19]。这一系列反应是酸性发酵过程,所以会伴随着甲酸、丁二酸、乙酸、苹果酸等酸性副产物的生成。
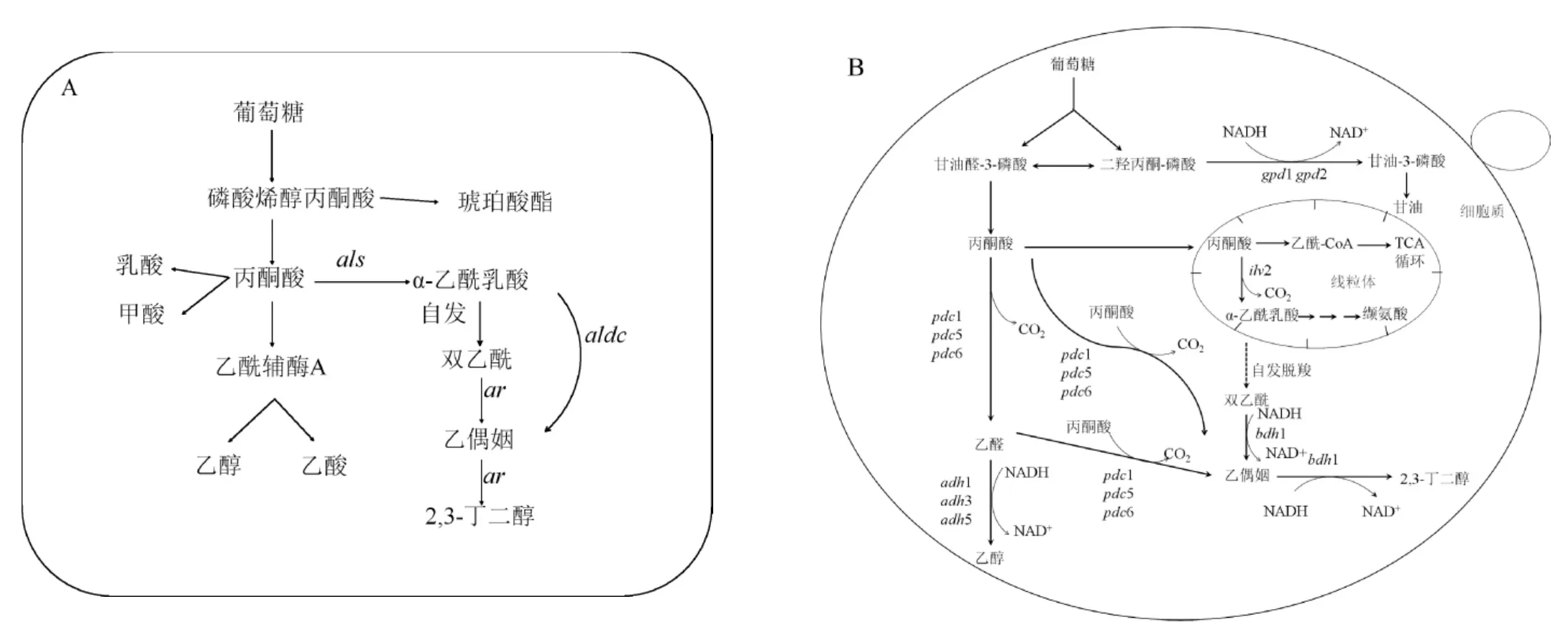
图1 细菌(A)和酿酒酵母(B)中的2,3-BD代谢途径Fig.1 Metabolic pathway of 2,3-butanediol in bacteria(A)and Saccharomyces cerevisiae(B)
S.cerevisiae自身的2,3-BD代谢途径(见图1B)不完整,S.cerevisiae胞内有两条2,3-BD合成途径,第一条途径是丙酮酸被α-乙酰乳酸合成酶催化生成为α-乙酰乳酸,α-乙酰乳酸通过自身氧化脱羧生成双乙酰,在BDH1的催化下生成乙偶姻;第二条途径是丙酮酸经丙酮酸脱羧酶(pyruvatedecarboxylase,PDC)催化生成乙醛,乙醛在乙醇脱氢酶(alcohol dehydrogenase,ADH)的作用下生成乙醇,或者丙酮酸在PDC的作用下直接生成乙偶姻;最后,乙偶姻在BDH1的催化作用下生成终产物2,3-BD。与细菌合成2,3-BD的合成途径相比,S.cerevisiae中没有ALDC,不能通过酶促反应合成乙偶姻,但是在氧气存在的条件下,S.cerevisiae中α-乙酰乳酸自发脱羧生成双乙酰,在BDH1的催化作用下将双乙酰还原为2,3-BD。
2 酿酒酵母合成2,3-BD的代谢途径改造策略
之前,国内外学者一直利用传统的诱变育种技术(如物理诱变、化学诱变)来提高菌种的产量和性能,但这种方式具有随机性强、可塑性弱且工作量大等弊端。因此,基于全基因组的系统代谢工程和辅酶调控策略对关键代谢节点进行合理的遗传改造逐渐吸引了学者眼球。通过优化S.cerevisiae合成2,3-BD的途径,阻断乙醇、甘油两条主要的竞争代谢支路进而强化生物合成2,3-BD,有望快速获得遗传稳定性好、发酵水平显著提高的S.cerevisiae。
2.1 过表达关键酶基因
GONZÁLEZE等[20]研究发现,在酵母细胞代谢过程中丙酮酸脱羧酶可以将乙醛和丙酮酸转化成乙偶姻,但碳代谢流向微弱,乃有痕量的2,3-BD产生。因此,有必要对2,3-BD生物合成途径中关键酶进行过表达,并减少S.cerevisiae中分支代谢产物,用于提高2,3-BD的产量。
S.cerevisiae中存在两条代谢通路,丙酮酸可以通过乙醛或α-乙酰乳酸两条代谢路径生成乙偶姻。因此,可以参考细菌2,3-BD的改造策略,如图2A所不。LIANJ等[21]通过过表达丙酮酸甲酸裂解酶(pyruvate formate-lyase,PLFA)基因(pfl A,pfl B)、乙醛脱氢酶基因(mhp F)来增强乙醛的代谢途径,同时敲除adh1、adh3和adh5基因抑制或减弱通往乙醇的代谢流,敲除自身2,3-BD生物合成的基因(ilv2),防止受自身代谢影响,引导代谢通路最终由产乙醇代谢转向产2,3-BD,进而提高S.cerevisiae产2,3-BD的水平,通过分批补料发酵,2,3-BD的产量达到0.307 g/L,是野生型S.cerevisiae 2,3-BD产量的7.3倍,乙醇产量降低7.7%;BRACKMAN G等[22]通过异源过表达来自枯草芽孢杆菌(Bacillussubtilis)的乙酰脱氢酶基因E1组分的aco A、aco B来提高乙酰-CoA与乙醛合成乙偶姻的能力(见图2B),在敲除adh1、adh3、adh5和ilv2基因的基础上,过表达pfl A、pfl B、aco A、aco B及内源性的bdh1基因,构建工程菌株进行分批补料发酵,2,3-BD产量达到0.341 g/L。由此说明乙醛途径基因的过表达对增强S.cerevisiae的2,3-BD产量无显著效果。
因此,最近的研究集中在α-乙酰乳酸合成途径上。由于α-乙酰乳酸的自发氧化脱羧是S.cerevisiae 2,3-BD合成途径中的限速步骤。为解决这一问题,在S.cerevisiae中异源表达胞质als和aldc基因,可使α-乙酰乳酸直接将α-乙酰乳酸转化为乙偶姻,最终合成2,3-BD[23]。由图2C可知,KIM SR等[24]在S.cerevisiae中异源表达B.subtilis中的als和aldc基因并且过表达bdh1基因,通过分批补料发酵,2,3-BD产量达到0.69 g/L,是野生型S.cerevisiae 2,3-BD产量的115倍。综上所述,异源过表达α-乙酰乳酸合成途径中的2,3-BD关键酶基因更能直接的提高2,3-BD产量。
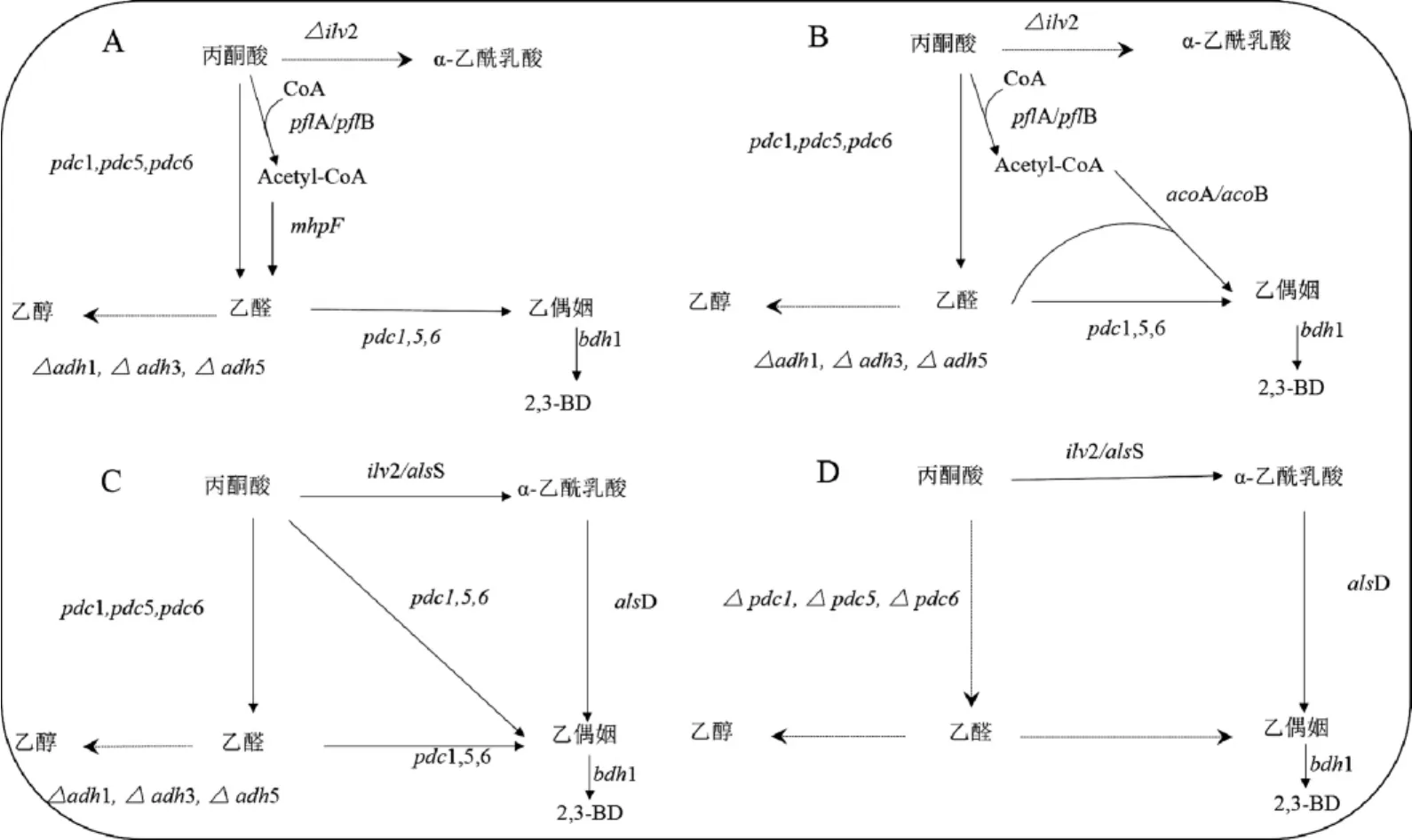
图2 酿酒酵母中基因过表达与基因敲除策略Fig.2 Strategies of gene overexpression and gene knockout in Saccharomyces cerevisiae
2.2 敲除adh和pdc基因减少副产物形成
研究者发现,虽然过表达各种2,3-BD生物合成途径中的关键酶基因能提高2,3-BD的产量,但2,3-BD产量的提高程度并不理想[24]。大量乙醇的积累严重制约着代谢流向2,3-BD,因此,在这种情况下,阻断或弱化乙醇的代谢流进而加大2,3-BD产量是至关重要的。由图1B可知,S.cerevisiae代谢途径中的PDC能将丙酮酸转化为乙醛,并在ADH作用下进一步还原成乙醇。因此,采用敲除adh基因(图2C)或pdc基因(图2D)两种代谢工程策略,将乙醇代谢通路阻断是切实可行的。
LEEJ等[25]敲除S.cerevisiae中的adh1、adh3、adh5基因后进行分批发酵,2,3-BD的产量达到2.29 g/L,与野生型S.cerevisiae相比,乙醇的产量降低31.25%,而2,3-BD的葡萄糖转化率显著提高,为0.113 g/g;KIM S等[26]在Adh-S.cerevisiae菌株基础上,异源过表达B.subtilis中的als S和als D基因和内源bdh1基因后进行分批补料发酵,2,3-BD产量达到了29.1 g/L。理论上讲,在抑制乙醇代谢流向并过表达2,3-BD合成途径后,菌株可以利用葡萄糖经丙酮酸、α-乙酰乳酸、乙偶姻合成2,3-BD,或经丙酮酸和乙醛转化成乙偶姻,最终合成2,3-BD(见图2C)。但弊端是Δadh1、Δadh3、Δadh5会积累大量的毒性物质乙醛,且还会生成一定量的乙醇[27]。
为了完全抑制乙醇的积累并高效地积累丙酮酸,科研工作者再次尝试以Pdc-S.cerevisiae菌株作为出发菌株(见图2D),从根本上解决乙醇大量积累的问题。由于Pdc-S.cerevisiae菌株不能合成乙醛,进而不能生成乙酰-CoA,而乙酰-CoA是三羧酸循环(tricarboxylic acid cyle,TCA)循环的关键物质,因此,菌株代谢生长受到严重抑制。在这种情况下,通过补充C2化合物(如乙醇、乙酸)可以缓解由乙酰-CoA缺失导致的细胞生长受抑制的情况,并显着增加2,3-BD的产量。此外,通过表达mth1A转录调节因子也可以达到缓解细胞抑制现象,KIM SJ等[16]敲除Pdc-S.cerevisiae菌株中的pdc、ilv2基因和过表达细菌的2,3-BD基因(als S、als D、bdh1)和mth1A基因后,在微需氧条件下补料分批发酵,2,3-BD产量为96.2 g/L,并且没有检测到乙醇和丙酮酸积累。
2.3 减缓酿酒酵母合成2,3-BD过程中辅因子平衡问题
在酵母细胞的生物转化过程中,常常包含了复杂的生化反应,且需要大量的辅因子参与调控,其中辅因子供给不足常常是影响代谢的关键因素。IDAY等[28]在Adh-S.cerevisiae或Pdc-S.cerevisiae菌株中引入2,3-BD代谢途径后,会导致葡萄糖流向2,3-BD的代谢过程的烟酰胺腺嘌吟二核甘酸(reduced form of nicotinamide-adenine dinucleotid,NADH)/NAD+比例不平衡。原因是S.cerevisiae在糖酵解途径中产生了2 mol NADH,但乃有1 mol NADH在2,3-BD途径中被氧化成NAD+。一般来说,S.cerevisiae可以通过乙醇和甘油的合成途径消耗掉多余的1mol NADH,从而维持胞内辅酶NADH/NAD+的平衡[29]。但工程菌株Adh-S.cerevisiae或Pdc-S.cerevisiae阻断了代谢过程中乙醇的合成支路。因此,若要维持辅酶NADH/NAD+平衡,细胞乃有通过大量积累甘油来实现胞内NAD+的再生。为了保证2,3-BD合成的同时,最大程度的减少甘油的积累,将碳通量引流向2,3-BD合成支路是接下来需要考虑的问题。EHSANIM等[30]提出了增加供氧的策略,在敲除ilv2基因并过表达als、aldc和bdh1基因的S.cerevisiae中增加溶氧量,甘油积累减少的同时,葡萄糖合成2,3-BD的理论产量比厌O2条件下高20%。这说明通过改变溶氧调节氧化还原平衡对于生产2,3-BD具有重要意义。
此外,科研工作者们还提出了另一种办法,通过外源添加替代电子受体的策略来缓解甘油的积累。如KAWAIS等[23]利用2-丁酮(2-butanone)作为外源添加电子受体用以缓解过量的NADH,甘油的产量降低了56%,2,3-BD的产率提高了1.5倍,达到了2,3-BD理论产率的90%。出于此目的,KIM S等[15]发现NADH氧化酶(NADH oxidase,NOX)可以将NADH氧化成NAD+,为了降低NADH的浓度,在过表达als、aldc、bdh1基因的Adh-S.cerevisiae工程菌株中外源表达乳酸乳球菌(Lactococcus lactis)中的NADH氧化酶,从而将C代谢甘油流向2,3-BD。通过分批补料发酵,2,3-BD产量达到73 g/L,与出发菌株相比,甘油的产量降低了65.3%,2,3-BD的产量提高了23.8%。
2.4 利用廉价原料合成2,3-BD
在S.cerevisiae中除过表达2,3-BD合成途径、敲除副产物途径提高2,3-BD产量外,也可以通过代谢工程手段使工程菌株具备利用廉价原料(木质纤维素(lignocellulose)和藻类(algae))生产2,3-BD的能力,进而提高2,3-BD产量。木质纤维素水解成葡萄糖和木糖后,葡萄糖能被S.cerevisiae利用,但木糖不能被利用[31]。因此,为了使S.cerevisiae能够利用木糖,首先要解决的问题是关于代谢过程中存在的糖抑制现象,即当环境中存在葡萄糖时葡萄糖会抑制木糖的代谢。BAEY H等[32]发现,在纤维素中存在一种两个葡萄糖通过β-1,4-糖苷键组成的纤维二糖不会受其他糖类代谢抑制。为了利用纤维二糖产2,3-BD,NAN H等[17]在Pdc-S.cerevisiae菌株中外源导入纤维糊精转运蛋白(cellodextrin transporter,CDT)基因和粗糙脉孢菌(Neurospora crassa)中的β-葡糖苷酶(β-glucosidase)基因(见图3),通过补料分批发酵,工程菌株的2,3-BD产量达到5.29 g/L,葡萄糖转化率为0.29 g/g,这表明了纤维素水解产物可以持续有效的进行2,3-BD的生产。其次要解决的问题是如何利用木糖生产2,3-BD,JO SE等[33]在过表达als、aldc和bdh1基因的Pdc-S.cerevisiae菌株中过表达木糖发酵酵母(Scheffersomyces stipitis)的木糖醇脱氢酶(xylitol dehydrogenase,XDH)基因和内源性木酮糖激酶(xylulose kinase,XK)基因,构成异源木糖同化途径(见图3),构建完成的工程菌株进行补料分批发酵,2,3-BD产量达到44 g/L。综上,S.cerevisiae可以通过代谢工程的技术利用木质纤维素产2,3-BD。
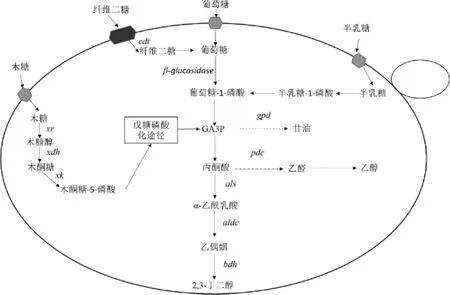
图3 酿酒酵母中纤维二糖和藻类生物质单糖的2,3-BD生物合成途径Fig.3 2,3-BD biosynthetic pathway of cellobiose and algal biomass monosaccharides in Saccharomyces cerevisiae
藻类作为另外一种可再生的生物质能源与纤维素生物质相比具有许多优点,如藻类的生产不会占用耕地,所需水资源少[34]。在海洋大型藻类中,红藻中的天竺葵(Pelargonium hortorum Bailey)最为丰富,其水解产物由葡萄糖和半乳糖组成。为了能够同时利用葡萄糖和半乳糖产2,3-BD,MITSUI K等[35]在过表达als、aldc和bdh1基因的Pdc-S.cerevisiae菌株中表达Mth1p基因后,菌株可以同时消耗葡萄糖和半乳糖,通过补料分批发酵,优化葡萄糖与半乳糖的比例,菌株的2,3-BD产量达到100 g/L,葡萄糖转化率为0.353 g/g。
3 总结与展望
21世纪以来,通过引用新型的代谢工程技术,工程菌株S.cerevisiae产2,3-BD的能力显著提升。此外,研究者建立了利用可再生能源来生产2,3-BD的方法[36]。S.cerevisiae利用可再生能源生产2,3-BD是有一定经济效益和具有可持续发展的前景[37]。展望未来,应从以下几个方面进行后续的研究。
(1)深入了解S.cerevisiae产2,3-丁二醇的代谢途径和分支代谢途径,利用基于全基因组的系统代谢工程和辅酶调控策略对关键代谢基因进行合理的遗传改造,例如,人工合成基因线路技术、启动子工程技术以及基因组编辑技术等优化2,3-BD的代谢途径。
(2)开发利用可再生能源产2,3-丁二醇,有些可再生能源木质纤维素(如菊芋(Helianthustuberosus(L.1753)))水解液中的毒性物质含量相对较少,并且水解液中含有丰富的营养物质,这有利于S.cerevisiae产2,3-丁二醇,通过优化木质纤维素的种类与水解方式以期得到更加适合S.cerevisiae生长和产2,3-BD的培养条件。
