海南不同林龄木麻黄海防林土壤微生物群落组成与酶活性的动态分析
2018-10-24徐志霞李小容蔡莲子刘胜欢刘武才
徐志霞,李小容,蔡莲子,李 颖,刘胜欢,刘武才,李 蕾
(热带岛屿生态学教育部重点实验室,海南师范大学 生命科学学院,海南 海口 571158)
木麻黄(Casuarinaequisetifolia)是20世纪50年代引进我国东南沿海的防护林树种,目前已在福建、广东、海南等地广泛种植,仅海南岛种植面积就达9万hm2,已成为维护滨海环境的重要生态屏障[1]。由于木麻黄纯林群落结构简单,经过数十年的种植后,逐渐出现了病虫害严重、自身更新困难、林地生产力下降、林分衰退等问题,导致其防护功能降低[2-3]。近年来的研究表明,林地养分循环失调、自身化感作用是木麻黄林地衰退的主要原因[4]。笔者前期已对木麻黄化感物质进行了系列研究[5-6],关于木麻黄土壤养分的研究,仅见叶功富等[7]进行的土壤养分与土壤酶关系的报道。土壤微生物和植物根系分泌的土壤酶活性高低,直接与土壤微生物和土壤理化性质相关。土壤微生物群落的多样性和丰度决定了土壤酶活性的高低,而土壤酶活性的高低则决定了林地土壤中碳氮的转化和存储[8-10]。因此,研究土壤酶活性与木麻黄林地土壤理化性质、土壤微生物之间的相互关系,对于探讨海南滨海木麻黄林地生态系统功能变化的机制,以及木麻黄林地衰退的主要原因有重要意义。前期本项目组已完成了不同林龄木麻黄林地土壤理化性质的测定与分析[11],本研究拟通过测定不同林龄土壤微生物和土壤酶活性的动态变化,探讨土壤酶活性与木麻黄林地土壤理化性质、土壤微生物三者间的关系,为沿海地区退化林地的生态恢复、现有防护林的更新改造及可持续发展提供科学依据。
1 材料与方法
1.1 研究区概况
研究样地位于海南省海口市桂林洋开发区海滨(N20°01′02″,E110°31′20″),该地木麻黄海防林多为单一树种,群落结构单一,林下土壤类型为滨海沙土。
样地按林龄的不同划分为幼龄林(5年生)、中龄林(15年生)和成熟林(30年生)3种木麻黄林地,以林地附近无木麻黄生长的裸地为对照。每一林龄的林地设置10 m×10 m样方3个,共9个样方,样地具体调查信息见表1。

表1 不同林龄木麻黄人工林样地的基本概况Table 1 Basic information of C.equisetifolia plantations at different stand ages
1.2 土壤样品采集
对样方内的土壤分别按照“S”形5点混合取样法取样,取样深度5~20 cm。将新鲜土样装入无菌袋置于冰盒中带回实验室,一部分于4 ℃保存,于一周内进行土壤酶活性测定;另一部分于-80 ℃冰箱中保存,用于土壤宏基因组DNA的提取。不同林龄木麻黄人工林林地土壤理化性质的测定结果见表2[11]。

表2 不同林龄木麻黄人工林林地的土壤理化性质和生化活性强度Table 2 Soil physico-chemical properties and biological activities of C.equisetifolia plantation sat different stand ages
1.3 测定项目与方法
1.3.1 土壤微生物群落多样性 将上述-80 ℃保存的土壤样品进行土壤宏基因组DNA提取,对检测合格的DNA样品进行高通量测序。土壤细菌的测序以454 GS FLX Titanium为测序平台,进行16S rDNA高变区定向测序,测序区域为V3~V5区,方向为V3区到V5区,目标区域长度560 bp。土壤真菌以Illumina Miseq PE250为测序平台,以ITS区域的SSU0817F引物(5′-TTAGCATGGAATAATRRAATAGGA-3′)和SSU1196R引物(5′-TCTGGACCTGGTGAGTTTCC-3′)进行PCR扩增。
利用Qiime平台对高通量测序所得数据进行统计注释,根据不同的相似度水平,对所有序列进行操作分类单位(operational taxonomic units,OTU)划分。其中OTU是在系统发生学或群体遗传学研究中,为了便于分析人为给某一个分类单元(品系、属、种、分组等)设置的同一标志。通常按照97%的相似水平将序列划分为不同的OUT,每个OUT被视为一个微生物物种。木麻黄林地土壤中的微生物多样性和不同微生物的相对丰度都是基于对OUT的分析得到的。
1.3.2 土壤微生物多样性指数 利用mothur version v.1.30.1软件进行土壤微生物多样性(α多样性)分析。
Chao1指数在生态学中常用来估计物种总数,其计算公式为:
Chao1=Sobs+n1(n1-1)/[2(n2+1)]。
式中:Chao1为估计的OTU数,Sobs为实际观测到的OTU数目,n1为只有1条序列的OTU数目,n2为只有2条序列的OTU数目。
Shannon指数(H)是用来估算样品中微生物多样性的指数之一,其计算公式为:
式中:ni为含有i条序列的OTU数目,N为所有的序列数。
1.3.3 土壤酶活性 采用3,5-二硝基水杨酸比色法测定土壤蔗糖酶活性,采用容量法测定土壤过氧化氢酶活性,采用对硝基苯磷酸二钠比色法测定土壤酸性磷酸酶活性,脲酶、过氧化物酶、多酚氧化酶活性均采用比色法测定,具体测定方法参见文献[12]。
1.4 数据分析
应用Excel 2003分析土壤酶活性数据;应用SPSS 16.0 软件完成数据的统计,并进行土壤酶活性单因素方差分析及土壤酶活性与土壤理化性质的通径分析,利用Canoco 4.5软件进行土壤微生物与土壤酶活性和理化性质的典范对应分析(CCA)。
2 结果与分析
2.1 不同林龄木麻黄林地土壤微生物主要菌属的组成和多样性
2.1.1 土壤微生物主要菌属组成 在属分类水平上,各林龄木麻黄林地土壤中相对丰度较高的微生物菌属组成如表3和表4所示。由表3可知,土壤细菌的种类和数量随林龄增加总体呈先增加后减少的趋势,以中龄林的相对丰度最高。酸杆菌_Gp1、酸杆菌_Gp3、分枝杆菌属(Mycobacterium)、链霉菌属(Streptomyces)、慢生根瘤菌属(Bradyrhizobium)、浮霉状菌属(Planctomyces)、Singulisphaera、Rhizomicrobium、芽孢杆菌属(Bacillus)等为3种林龄土壤细菌中均存在的优势菌属,而且其相对丰度多表现出与土壤细菌总体相同的变化趋势。特有菌属主要集中出现在中龄林,如鞘氨醇杆菌属(Sphingobacterium)、Soonwooa、Ignavibacterium、短波单胞菌属(Brevundimonas)、德沃斯氏菌属(Devosia)等,其中鞘氨醇杆菌属在中龄林中占绝对优势,该属在分类学上归属拟杆菌门、鞘氨醇杆菌纲、鞘氨醇杆菌目、鞘氨醇杆菌科,属内各菌株均能产生氧化酶。另外还有一些未能鉴定到属的菌群在各样地中的分布比例均较高,如酸微菌目、放线菌目、浮霉状菌科等。
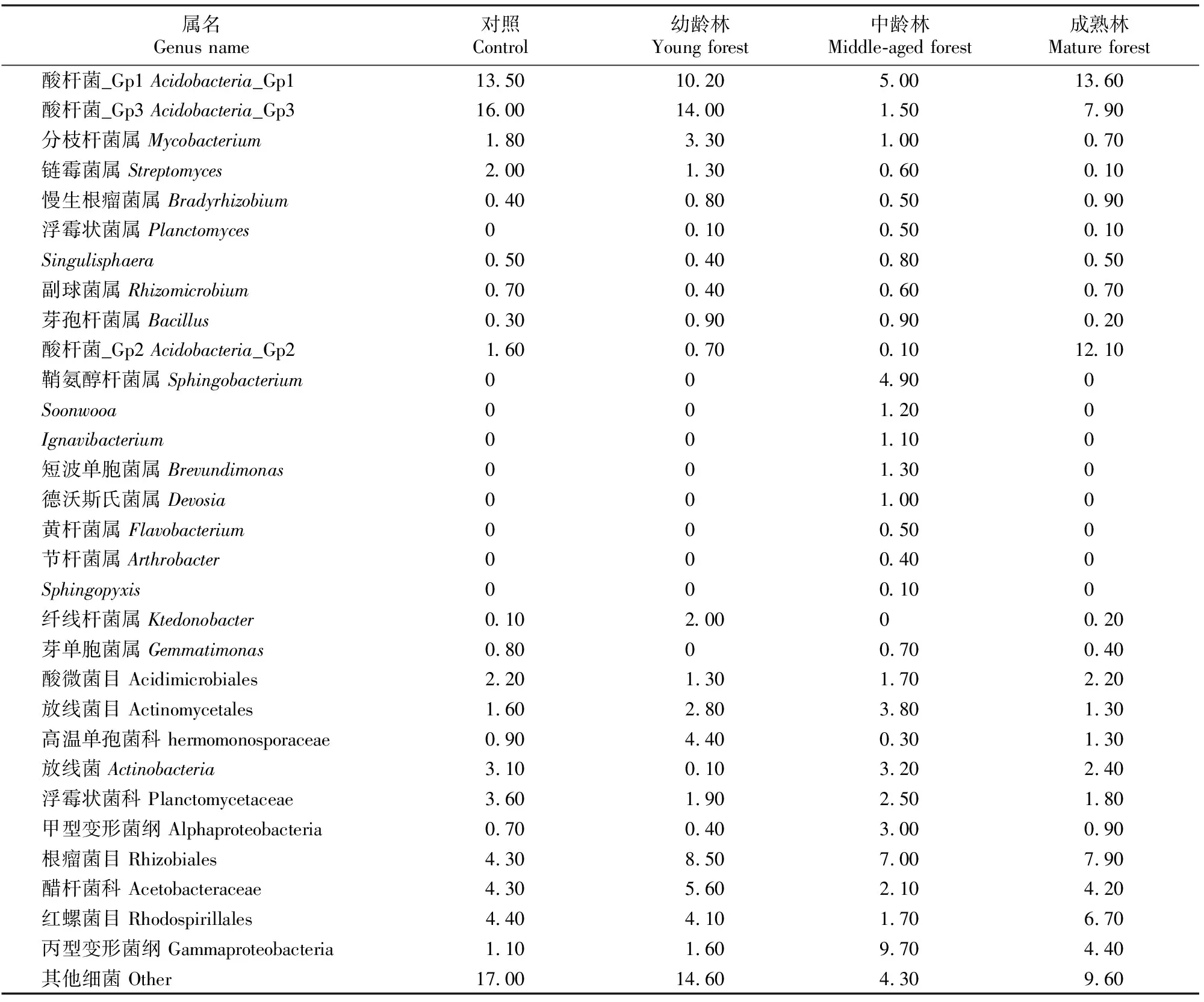
表3 不同林龄木麻黄林地土壤在属分类水平主要细菌类群的相对丰度Table 3 Relative abundance of soil bacteria community at genus level of C.equisetifolia plantations at different stand ages %
由表4可以看出,随林龄增加,木麻黄林地中的土壤真菌种类和相对丰度的变化趋势总体也与土壤细菌相同,区别在于对照裸地土壤真菌的相对丰度较高,但真菌种类较中龄林和成熟林少。4个样地共有菌属多归属于子囊菌门和担子菌门,主要有尚未能分类的子囊菌纲、发菌科、肉座菌属(Hypocrea)、长喙壳科、粪壳菌纲、伞菌纲等。其中对照裸地中相对丰度最高的为尚未能命名的伞菌纲,而在木麻黄林地中相对丰度最高的是发菌科一尚未分类的菌属,与总体变化趋势不同的是,其在成熟林中相对丰度最高,较幼龄林和中林龄分别高69.4%和157.3%;子囊菌纲中一尚未分类的菌属在幼龄林中相对丰度最高,较中龄林和成熟林分别高175.6%和77.1%。中龄林和成熟林中特有菌属较多,但丰度均相对较低,中龄林中特有且相对丰度较高的真菌属于豆马勃属(Pisolithus),成熟林中特有且相对丰度较高的真菌为Archaeorhizomyces。
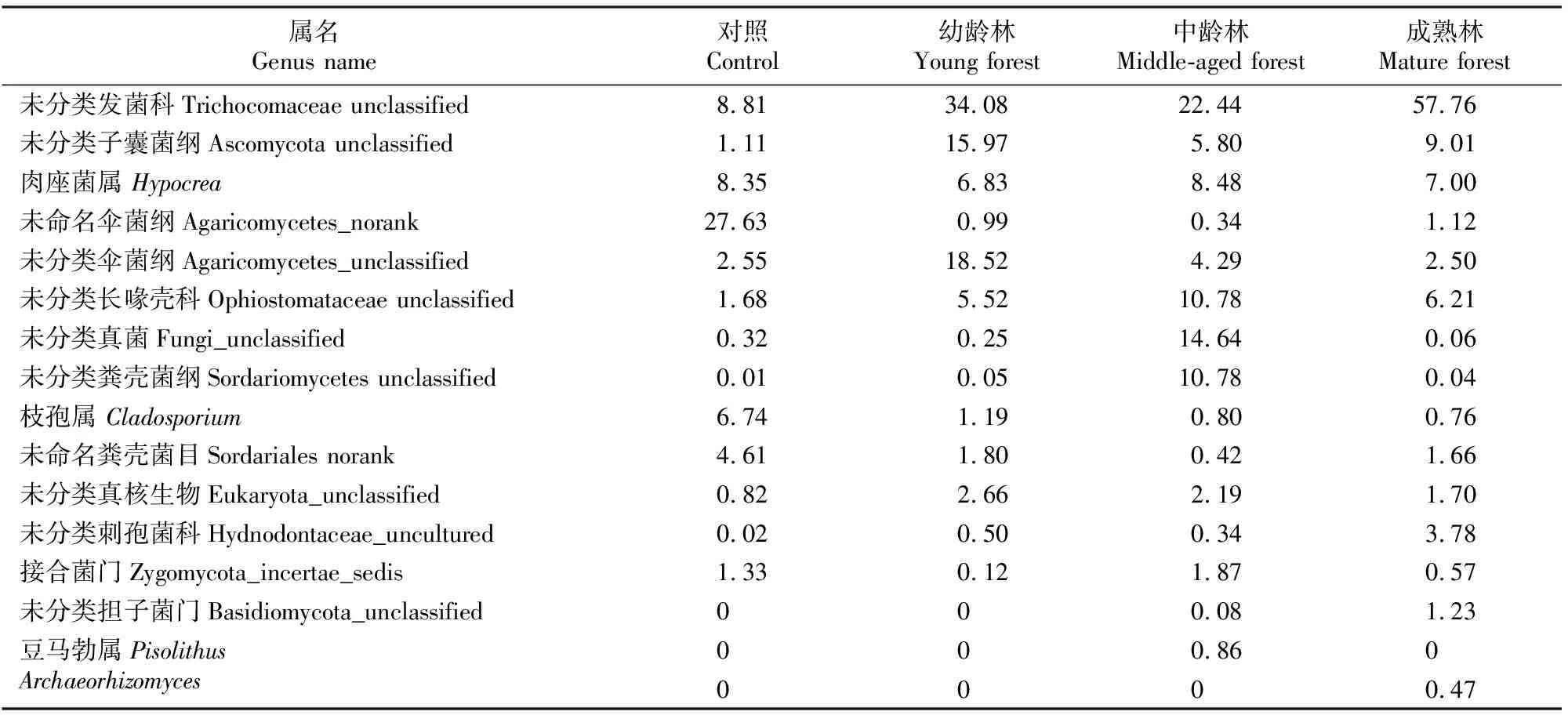
表4 不同林龄木麻黄林地土壤在属分类水平主要真菌类群的相对丰度Table 4 Relative abundance of soil fungi community at genus level of C.equisetifolia plantations at different stand ages %
2.1.2 土壤微生物多样性 为反映不同林龄木麻黄林地土壤微生物的多样性而进行了α多样性分析,其中Chao1指数可用来判断群落的物种丰富度,其值越大表明物种种类越多;Shannon指数可同时反映物种的丰富度和均匀度。由表5可见,随林龄的增加,木麻黄林地土壤细菌的Chao1指数和Shannon指数有较大变化,其中中龄林土壤细菌的Chao1指数均值最大,为4 363.851,而成熟林的均值最小,仅为43.400;同时Shannon指数均值也以中龄林最高、成熟林最低,说明在各林龄样地中,中龄林细菌群落的物种组成最丰富,均匀度也最高。土壤真菌群落的多样性不如细菌显著,其中中龄林和成熟林的Chao1指数均较高,但二者差值仅为1,表明中龄林和成熟林的土壤真菌物种总数较高且较为接近;Shannon指数则以中龄林较高,而成熟林最低,表明中龄林土壤真菌群落物种组成的均匀度较高且多样性最高,而成熟林的真菌群落多样性最低,其优势菌群所占比例较高。
比较不同林龄木麻黄林地土壤细菌和真菌的多样性指数(表5)可以看出,土壤细菌在各林地中的差异性较土壤真菌更为明显。在幼龄林和中龄林中,土壤细菌的多样性指数远高于真菌多样性指数,而在成熟林和对照林地中则未表现出明显差异,表明幼龄林和中龄林林地中的细菌丰富度远高于真菌,而成熟林林地中细菌和真菌群落结构的均匀度均显著降低,这可能是造成木麻黄成熟林林地养分循环不利的一个影响因素。
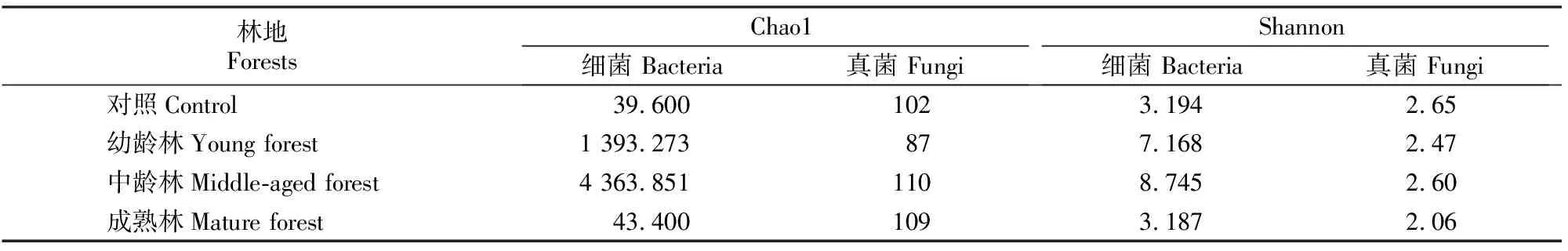
表5 不同林龄木麻黄林地土壤细菌和真菌的α多样性指数Table 5 α diversity indices of bacteria and fungi in soils of C. equisetifolia plantations at different stand ages
2.2 不同林龄木麻黄林地土壤酶活性的动态变化
为分析不同林龄木麻黄林地土壤的养分状况,测定土壤酶活性的变化,分析各林地土壤酶活性随林龄的变化趋势并进行单因素方差分析,结果见表6。
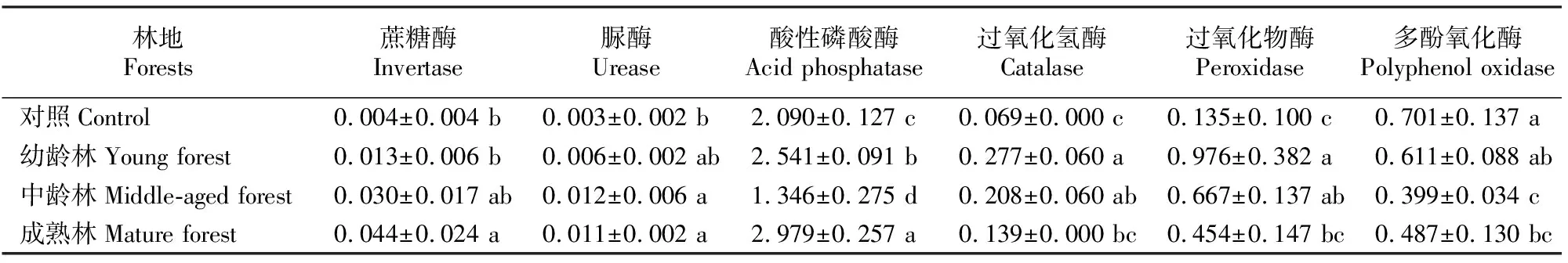
表6 不同林龄木麻黄林地的土壤酶活性Table 6 Soil enzyme activities of C. equisetifolia plantations at different stand ages mg/g
注:同列数据后标不同小写字母表示不同林龄林地间酶活性差异显著(P<0.05)。
Note: Different lowercase letters indicate significant difference among methods(P<0.05).
从表6可以看出,不同林龄木麻黄林地土壤中,蔗糖酶活性随林龄增加而增大,与幼龄林、中龄林相比,成熟林土壤蔗糖酶活性分别增加了238.5%和46.7%,可见蔗糖酶活性从幼龄林到中龄林增幅明显。脲酶活性表现出与蔗糖酶活性较为相似的变化趋势,从幼龄林的0.006 mg/g到中龄林的0.012 mg/g,增幅较大,而中龄林与成熟林间变化较小,差异不显著。酸性磷酸酶活性在对照和幼龄林、成熟林林地土壤中均保持较高水平,变化趋势表现为成熟林>幼龄林>对照>中龄林,且各林地间差异显著。中龄林土壤中酸性磷酸酶活性表现异常,较幼龄林和成熟林分别低了47.0%和54.8%,降幅明显。
过氧化氢酶和过氧化物酶活性均以木麻黄幼龄林最强,与幼龄林土壤相比,中龄林和成熟林过氧化氢酶活性分别降低了28.5%和45.2%,过氧化物酶活性则分别降低了31.6%和53.4%,均以成熟林的降幅更为明显。而多酚氧化酶活性则表现为所有林龄林地均低于裸地,且在中龄林中活性最低,与幼龄林存在显著性差异。
2.3 土壤酶活性与土壤理化性质的通径分析
木麻黄林地土壤酶活性与土壤理化性质间关系的通径分析结果见表7。表7显示,土壤pH(x3)对蔗糖酶的直接通径系数为-0.707,而土壤呼吸作用(x10)、体积质量(x2)通过pH对蔗糖酶的间接通径系数分别为0.553和-0.562;土壤pH对脲酶的直接通径系数为-0.733,土壤呼吸作用、体积质量通过pH对蔗糖酶的间接通径系数分别为0.573和-0.583,说明土壤pH是影响木麻黄林地蔗糖酶和脲酶活性的主要因素,而呼吸作用、体积质量对蔗糖酶、脲酶活性的影响均是通过pH间接起作用的。

表7 木麻黄林地土壤理化性质对土壤酶活性的直接通径系数和间接通径系数Table 7 Direct and indirect path coefficients of soil properties on soil enzyme activities of C.equisetifolia plantations
注:x1.含水率;x2.体积质量;x3.pH值;x4.有机质;x5.全钾;x6.全磷;x7.全氮;x8.铵态氮;x9.硝态氮;x10.呼吸作用;x11.氨化作用;x12.硝化作用;x13.固氮作用;有下划线的数据为直接通径系数,其他为间接通径系数。
Note:x1.Water content;x2.Bulk density;x3.pH;x4.Organic matter;x5.Total K;x6.Total P;x7.Total N;x8.Ammonia-N;x9.Nitrate-N;x10.Respiration;x11.Ammoniation;x12.Nitrification;x13.Nitrogen fixation.The underlined data are direct path coefficients,while the rest are indirect path coefficients.
图7显示,土壤有机质(x4)对酸性磷酸酶的直接通径系数为-1.005,全磷(x6)对酸性磷酸酶的直接通径系数为0.363,这两者对酸性磷酸酶的直接通径系数均较大,说明有机质和全磷的直接作用是影响酸性磷酸酶活性变化的主要方式,其中有机质的影响最大。而土壤含水率(x1)通过有机质对酸性磷酸酶的间接通径系数高达0.691,铵态氮(x8)通过全磷对其活性的间接通径系数为0.280,二者均明显高于其他因素的间接通径系数,表明这二者对酸性磷酸酶活性的影响由间接作用所导致。
全钾(x5)对过氧化氢酶、过氧化物酶的直接通径系数分别为0.796和0.875,说明全钾的直接作用最大;分析各个间接通径系数可以发现,全氮(x7)和硝化作用(x12)通过全钾对过氧化氢酶和过氧化物酶的间接作用均较大,呼吸作用(x10)对多酚氧化酶的负直接作用最大,其直接通径系数为-0.692,而土壤体积质量(x2)通过呼吸作用对多酚氧化酶活性的间接影响最大,其间接通径系数达到0.604。
综上所述,土壤呼吸作用、pH值、全钾、全磷、有机质是影响土壤酶活性的直接因素,而土壤蔗糖酶、脲酶、酸性磷酸酶、过氧化氢酶、过氧化物酶、多酚氧化酶各影响因素的剩余通径系数分别为0.707 11,0.680 4,0.466 9,0.604 9,0.484 7和0.721 8,剩余因子的值均较大,说明对土壤酶活性产生影响的因素不仅仅是以上所列出的土壤理化性质和生化活性,还有一些影响较大的因素未分析到,比如土壤微生物对土壤酶活性的影响等。
2.4 土壤微生物与土壤酶和理化性质的CCA分析
采用CCA分析法对不同林龄木麻黄林地土壤微生物与土壤酶和理化性质进行排序,以直观反映其相互关系。以林地细菌优势群落节杆菌属、分枝杆菌属、鞘氨醇杆菌属、黄杆菌属、浮霉状菌属、短波单胞菌属、慢生根瘤菌属、德沃斯氏菌属、Soonwooa、Ignavibacterium和硝化螺菌属(Nitrospira),以及真菌优势群落未分类子囊菌纲、未分类发菌科、肉座菌属、未分类长喙壳科、未命名粪壳菌目、未分类粪壳菌纲、未命名伞菌纲、未分类伞菌纲、未分类刺孢菌科、枝孢属(Cladosporium)为研究对象,以土壤蔗糖酶、脲酶、酸性磷酸酶、过氧化氢酶、过氧化物酶、多酚氧化酶和土壤含水率、体积质量、pH、有机质、全钾、全磷、全氮、铵态氮、硝态氮、呼吸作用、氨化作用、硝化作用、固氮作用为影响因子,探讨土壤细菌、真菌、土壤酶与土壤理化性质的相关性,结果见图1和图2。

Art.节杆菌属;Myc.分枝杆菌属;Sph.鞘氨醇杆菌属;Fla.黄杆菌属;Soo.Soonwooa;Ign.Ignavibacterium;Nit.硝化螺菌属;Pla.浮霉状菌属;Bre.短波单胞菌属;Bra.慢生根瘤菌属;Dev.德沃斯氏菌属;WC.含水率;BD.体积质量;pH.pH值;OM.有机质;TK.全钾;TP.全磷;TN.全氮;AN.铵态氮;NN.硝态氮;Res.呼吸作用;Amm.氨化作用;Nit.硝化作用;NiF.固氮作用;Inv.蔗糖酶;Ure.脲酶;Aph.酸性磷酸酶;Cat.过氧化氢酶;Per.过氧化物酶;Poly-o.多酚氧化酶。下图同Art.Arthrobacter;Myc.Mycobacterium;Sph.Sphingobacterium;Fla.Flavobacterium;Soo.Soonwooa;Ign.Ignavibacterium;Nit.Nitrospira;Pla.Planctomyces;Bre.Brevundimonas;Bra.Bradyrhizobium;Dev.Devosia;WC.Water content;BD.Bulk density;pH.pH value;OM.Organic matter;TK.Total K;TP.Total P;TN.Total N;AN.Ammonia-N;NN.Nitrate-N;Res.Respiration;Amm.Ammoniation;Nit.Nitrification;NiF.Nitrogen fixation;Inv.Invertase;Ure.Urease;Aph.Acid phosphatase;Cat.Catalase;Per.Peroxidase;Poly-o.Polyphenol oxidase.The same below图1 木麻黄林地土壤细菌群落与土壤酶及理化性质的CCA排序Fig.1 CCA ordination of soil bacteria community with soil enzyme and physic-chemical properties of C.equisetifolia plantations
由图1可见,木麻黄林地土壤铵态氮的射线最长,说明铵态氮对细菌群落的影响程度最大,其次是土壤固氮作用,而土壤体积质量的射线最短,对细菌群落的影响最小。土壤体积质量与硝化螺菌属的垂直距离最短,相关性最大;pH与硝化螺菌属的垂直距离最长,相关性最小。多酚氧化酶和铵态氮与分枝杆菌属的垂直距离最短,相关性最大;土壤固氮作用、氨化作用与分枝杆菌属的垂直距离最长,相关性最小。土壤体积质量与慢生根瘤菌属的垂直距离最短,相关性最大;全氮、氨化作用与慢生根瘤菌属的垂直距离最长,相关性最小。全钾与浮霉状菌属的垂直距离最短,相关性最大;固氮作用与浮霉状菌属的垂直距离最长,相关性最小。其他菌属与有机质、硝态氮的垂直距离最短,相关性最大。
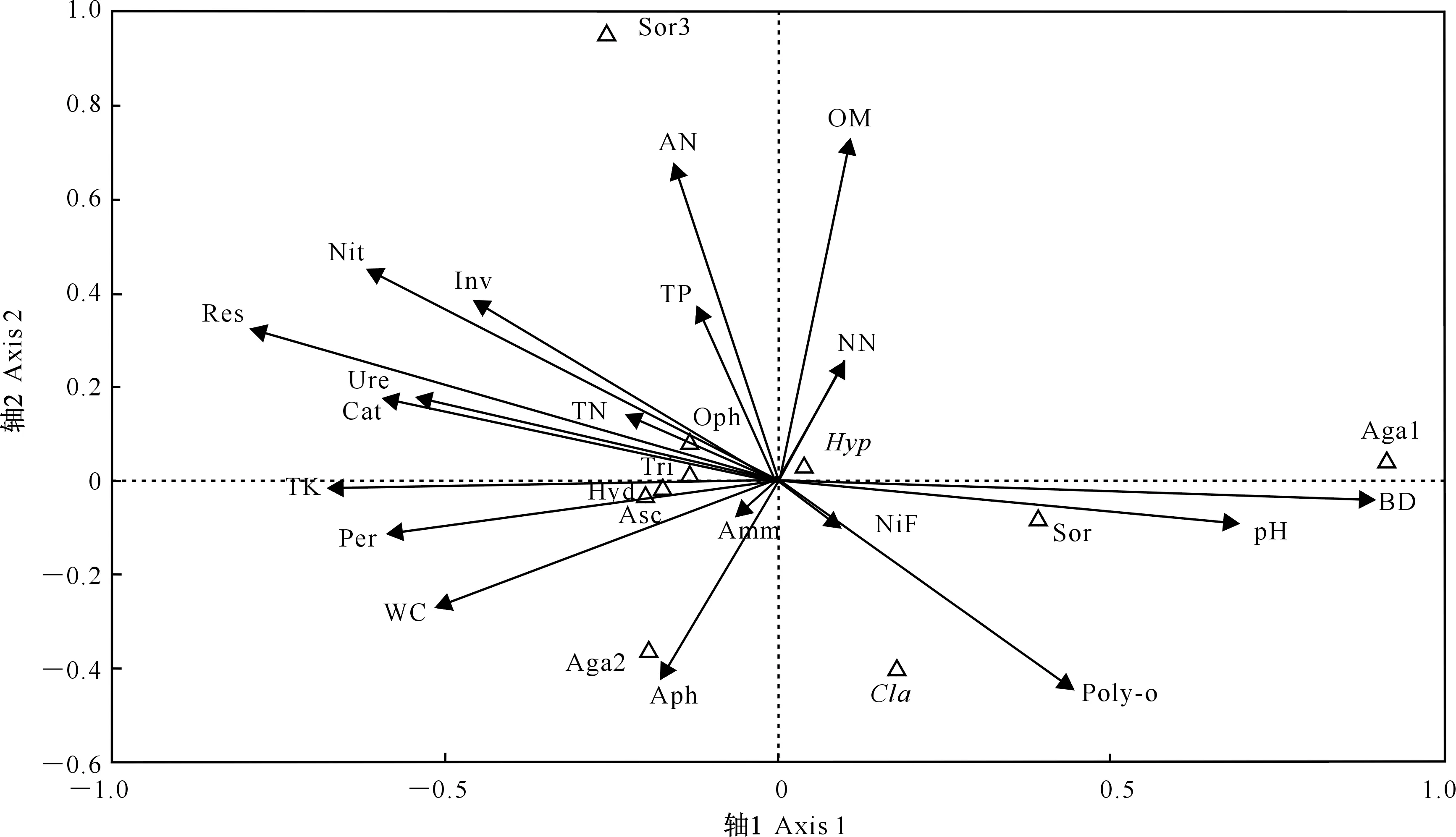
Asc.未分类子囊菌纲;Tri.未分类发菌科;Hyp.肉座菌属;Oph.未分类长喙壳科;Sor.未命名粪壳菌目;Sor3.未分类粪壳菌纲;Aga1.未命名伞菌纲;Aga2.未分类伞菌纲;Hyd.未分类刺孢菌科;Cla.枝孢属Asc.Ascomycota_unclassified;Tri.Trichocomaceae_unclassified;Hyp.Hypocrea;Oph.Ophiostomataceae_unclassified;Sor.Sordariales_norank;Sor3.Sordariomycetes_unclassified;Aga1.Agaricomycetes_norank;Aga2.Agaricomycetes_unclassified;Hyd.Hydnodontaceae_uncultured;Cla.Cladosporium图2 木麻黄林地土壤真菌群落与土壤酶及理化性质的CCA排序Fig.2 CCA ordination of soil fungi community with soil enzyme and physic-chemical properties of C.equisetifolia plantations
由图2可知,木麻黄林地土壤体积质量的射线最长,说明土壤体积质量对真菌群落的影响程度最大,其次是土壤呼吸作用;而土壤氨化作用的射线最短,表明其对真菌群落的影响程度最小。肉座菌属与土壤含水率的垂直距离最短,二者相关性最大;同时其与其他相关因素的垂直距离也较近,说明肉座菌属与土壤理化性质的相关性都比较大。未命名粪壳菌目与土壤pH的垂直距离最短,相关性最大;与有机质和硝态氮的垂直距离最长,相关性最小。枝孢属与全磷的垂直距离最短,相关性最大;与土壤含水率、过氧化物酶的垂直距离最长,相关性最小。未命名伞菌纲、未分类伞菌纲、未分类粪壳菌纲和未分类子囊菌纲分别与全钾、酸性磷酸酶、铵态氮及过氧化物酶的垂直距离最短,相关性最大;未分类刺孢菌科与过氧化物酶、全钾、体积质量的相关性最大,未分类发菌科与过氧化氢酶、pH的相关性最大,未分类长喙壳科与全氮的相关性最大。
3 讨 论
近年来,木麻黄林分质量下降,防护效能严重降低,困扰着亚热带及热带沿海防护林的建设,林地养分枯竭、土壤肥力循环受阻、养分循环失衡,是引起其生产力退化的一个重要原因[13-15]。酶是土壤有效肥力形成的关键决定因子[16],主要来源于土壤微生物和植物根系的分泌及动植物残体的分解,基于此,本研究探讨了不同林龄木麻黄林地土壤微生物的群落组成和多样性以及土壤酶活性的变化趋势,并分析了土壤酶、微生物以及土壤理化性质的相关关系。
土壤微生物群落多样性可以反映土壤环境变化、土壤健康状况以及土壤肥力水平,是反映土地生产力的一个重要指标[17],而土壤中90%以上的微生物由土壤细菌和真菌组成。本研究通过高通量测序测定了不同林龄木麻黄林地土壤细菌和真菌群落的菌属组成,发现不同林龄木麻黄林地土壤细菌和真菌的种类和丰度随林龄增加总体呈先增后减趋势,但对照裸地的真菌丰度要高于各林龄林地,而真菌种类依然低于中龄林和成熟林。土壤细菌中,酸杆菌_Gp1、酸杆菌_Gp3、分枝杆菌属、链霉菌属、纤线杆菌属、芽孢杆菌属为4类样地中共有的相对丰度较高的菌属,其中链霉菌、芽孢杆菌是土壤中重要的生防菌,能够通过产生代谢物抑制其他有害因子,改良土壤质量,其相对丰度在幼龄林和中龄林中较高,而在成熟林降幅明显,分别由中龄林的0.6%和0.9%降低到成熟林的0.1%和0.2%。可见,这一类生防菌分布的减少可能是导致成熟林地力衰退的一个重要原因。
木麻黄是一种固氮植物。李钦禄等[18]的研究认为,木麻黄本身的氮转移率不高,自身的固氮作用即能满足植株生长需要,这与木麻黄林地中存在种类众多的固氮微生物有一定关系。本研究中一些用于氮素循环和分解作用等功能的细菌,如具有固氮作用的慢生根瘤菌属、德沃斯氏菌属、节杆菌属等,除慢生根瘤菌属在3种林龄中均有分布外,德沃斯氏菌属、节杆菌属均为中龄林特有的相对丰度较高的菌属,其相对丰度分别为1.0%和0.4%。另外一些相对丰度较低的固氮菌,如中生根瘤菌属(Mesorhizobium)、根瘤菌属(Rhizobium)、硝化螺菌属也可在中龄林中检测到。由此可见,成熟林中固氮微生物的分布减少,土壤固氮作用降低,也可能是成熟林地力衰退的一个原因。
而就土壤真菌而言,对照裸地中相对丰度最高的为伞菌纲,木麻黄林地中相对丰度最高的是发菌科一尚未分类的菌属。发菌科属于子囊菌门、不整囊菌纲、散囊菌目(曲霉目),其相对丰度在成熟林中最高,幼龄林次之。发菌科真菌能够产生分解土壤或凋落物中纤维素、半纤维素、蔗糖、淀粉等的蔗糖酶、纤维素酶等,提高土壤的肥力[19]。本研究中土壤蔗糖酶活性在成熟林中最高,可能与成熟林中大量分布的发菌科真菌有关。通过分析土壤微生物群落组成的多样性,发现成熟林中细菌和真菌群落结构的丰富度及均匀度均低于幼龄林和中龄林,其中细菌的差异性更为明显,表明木麻黄林地在林分生长发育的后期,群落结构尤其是细菌的群落结构失去平衡,这可能是造成林地养分循环不利的一个影响因素。

过氧化氢酶可减轻过氧化氢对植物的毒害,其活性随木麻黄林龄增大而逐渐降低,表明过氧化氢含量可能随着林龄增长而逐渐在土壤中累积,同时土壤中有机物不能及时转化为醌类,这可能是木麻黄林地地力衰退的一个原因。多酚氧化酶能氧化土壤中的酚类物质生成醌,过氧化物酶能酶促土壤中的有机物质(如酚、胺类等)氧化生成醌,二者均是腐殖质合成过程中的重要氧化酶。前期研究结果表明,木麻黄林地不同林龄土壤、根、凋落物和特有微生物发酵液的萃取产物中,2,4-二叔丁基苯酚等多酚类物质多在成熟林中出现,且相对含量较高。这些物质的出现可能表明,由于土壤中过氧化物酶和多酚氧化酶活性低,不能分解植株来源或微生物来源的酚类物质,从而导致酚类物质增多并在土壤中积累,进而产生对自身有毒害作用的化感物质。而多酚氧化酶活性在木麻黄成熟林中有所恢复,这与杉木人工林中多酚氧化酶活性的变化趋势一致,有学者认为多酚氧化酶活性增高可能会引起杉木林分生产力下降[23]。
通径分析结果表明,土壤呼吸作用、pH值、全钾、全磷、有机质是影响木麻黄林地土壤酶活性的直接因素,其中pH值是蔗糖酶、脲酶活性的直接影响因子。王涵等[24]研究表明,酸化能够激活土壤蔗糖酶活性。本研究中,pH值随林龄增长而逐渐降低,同时蔗糖酶、脲酶活性升高,表明木麻黄林地的酸性土壤有利于蔗糖、尿素的有效性转化。土壤过氧化氢酶、过氧化物酶活性与全钾含量呈正相关,这与戴伟等[25]提出的“过氧化氢酶活性与土壤全氮及有机质含量显著相关”的结论不一致,但与孙慧等[26]的余姚滨海盐碱地“土壤过氧化氢酶活性受土壤全钾影响最大”的结果一致。多酚氧化酶活性则受到呼吸作用的负相关作用最大。
由不同林龄木麻黄林地土壤微生物与土壤酶、理化性质之间的CCA分析结果可知,铵态氮对细菌群落的影响程度最大,而土壤体积质量对其影响最小;对真菌群落影响程度最大的是土壤体积质量,影响程度最小的则是土壤氨化作用。其中细菌群落中各菌属与土壤氮循环相关因素的相关性比较紧密,这与Liu等[27]的研究结果相一致,即认为土壤中碳、氮等营养元素对细菌多样性有显著影响。而真菌群落中的优势菌属未分类发菌科与过氧化氢酶、pH的相关性最大。由此可见,土壤微生物、土壤酶及理化性质之间的相关关系是三者协同作用的结果。
4 结 论
土壤微生物群落组成、土壤酶活性及土壤理化性质间存在密切的关系,三者间互为因果,构成了复杂的网络关系。从土壤微生物的群落结构和多样性来看,链霉菌、芽孢杆菌等生防菌以及固氮微生物等在成熟林中的分布减少,以及细菌和真菌的群落结构在成熟林中的不均匀分布,均有可能导致木麻黄林地地力衰退。而从土壤酶活性随林龄的变化趋势来看,与土壤肥力相关的蔗糖酶、脲酶、酸性磷酸酶活性随林龄增长而逐渐升高,表明木麻黄林地的土壤肥力状况尚可,但值得注意的是,与土壤中代谢产物如过氧化氢、酚酸类物质转化相关的氧化还原酶类的活性随林龄增长而逐渐降低,这可能导致此类代谢产物不能及时降解利用而积累在土壤中,进而造成了木麻黄自身化感现象的出现。
