左卡尼汀对多西他赛在NCI-H520细胞中抗肿瘤作用影响的研究
2018-10-24钱兴运郎娟娟陶若琳吴春暖
钱兴运,郎娟娟,陶若琳,吴春暖,王 晨
(天津医科大学肿瘤医院药学部,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津市恶性肿瘤临床医学研究中心,天津300060)
多西他赛(docetaxel,DTX)是治疗非小细胞肺癌(non-small cell lung cancer,NSCLC)最有效的药物之一[1],其能通过在肿瘤细胞有丝分裂期间形成无功能的微管束来抑制肺癌细胞的增殖[2]。DTX联合铂类药物的治疗方案是治疗晚期NSCLC的一线治疗方案[3],在许多国家DTX也被批准单独作为二线治疗药物用于晚期NSCLC的治疗[4]。尽管DTX在NSCLC的治疗中扮演着重要角色,但是DTX同时也会产生诸如窦性心动过缓等多种心脏毒副作用[5]。
左卡尼汀(L-carnitine,L-CNT)是一种内源性氨基酸,对哺乳动物的能量代谢至关重要。已有研究表明L-CNT及其衍生物能够阻止ROS的形成,清除自由基,并防止细胞发生氧化应激[6]。近年来,很多研究也表明L-CNT在应对化疗药物引起的心脏毒性和周围神经毒性方面有一定作用[7]。还有研究表明,L-CNT能够抑制表柔比星等药物在肺腺癌中的抗肿瘤作用[8-9],然而在胃癌细胞中,L-CNT却能增强5-氟尿嘧啶的抗肿瘤作用[10]。因此,L-CNT对不同化疗药物在不同肿瘤细胞中的影响是不同的。因此,本实验旨在研究联合给药时,L-CNT对DTX抑制人肺癌细胞NCI-H520增殖作用的影响,并初步探索其作用机制。
1 材料与方法
1.1 细胞系 人肺癌NCI-H520细胞(天津肿瘤研究所生物技术实验室)。
1.2 仪器和试剂 细胞恒温培养箱;IX70倒置光学显微镜;FACS流式细胞仪;左卡尼汀注射液;多西他赛注射液;胎牛血清和RPMI-1640培养基;Annexin V-FITC/PI双染凋亡试剂盒;兔抗人Bcl-2,Bax,P21和 P53抗体;四甲基偶氮唑蓝(MTT);PI粉末;RNA 酶(RNase A)。
1.3 方法
1.3.1 细胞培养 将从液氮中取出的NCI-H520细胞复苏后,接种于含10%胎牛血清的RPMI-1640培养基中,置于含5%CO2的37℃恒温培养箱中培养。细胞贴壁生长,待细胞生长密度达到培养皿的80%左右时,用0.25%含EDTA的胰蛋白酶消化细胞,待细胞收缩变圆时,用培养液终止消化,进行传代或稀释成合适浓度进行实验。
1.3.2 实验分组 对照组:未被药物处理过的细胞;L-CNT 组:只加 L-CNT(80 μg·mL-1)作用 24 h的细胞;DTX 组:只加 DTX(40 μg·mL-1)作用 24 h的细胞;联合用药组:同时加入 L-CNT(80 μg·mL-1)和 DTX(40 μg·mL-1)作用 24 h 的细胞。每项实验独立平行重复3次。
1.3.3 不同浓度的DTX对NCI-H520细胞增殖的影响 将终浓度为6×104个·mL-1的细胞悬液接种于96孔板中,每孔100 μL,恒温培养24 h。分别设空白对照组,阴性对照组和不同浓度的药物实验组,每组设5个复孔。空白对照组只加培养液,阴性对照组为培养液和细胞,药物试验组为包含不同浓度DTX的培养液和NCI-H520细胞。待细胞贴壁后,将原培养液吸出,采用逐级稀释的方法,将药物终浓度稀释成 0.25、2.5、5、10、25、50、100、200 μg·mL-1,每孔加入体积为200 μL的含药培养液,培养24 h后,每孔加入 20 μL MTT 溶液(5 mg·mL-1),恒温孵育4 h,弃掉孔内液体,每孔加入150 μL的DMSO溶液,低速震荡15 min,在490 nm波长处测定吸光度,采用SPSS17.0统计软件计算24 h的IC50值(40 μg·mL-1)作为后续实验的 DTX 浓度。
1.3.4 MTT实验 以 6×104个·mL-1的终浓度将NCI-H520细胞悬液接种于96孔板中,每孔100 μL,恒温培养24 h。根据“1.3.3”的实验结果,最终选用DTX 的浓度为其 IC50值(40 μg·mL-1),根据临床给药后的血药浓度,确定L-CNT的浓度为80 μg·mL-1,实验分组如“1.3.2”所述,并且每个组设置6个复孔,其余实验步骤同“1.3.3”。
1.3.5 细胞凋亡 实验以1×105个·mL-1的终浓度将NCI-H520细胞悬液接种于6孔板中,待贴壁后,每孔加入终体积为2 mL的含药培养液。实验分组同“1.3.2”,药物浓度如“1.3.4”所述。恒温培养24 h后,收集细胞悬液,用预冷的PBS洗涤细胞两次,1 200 r·min-1离心 5 min,弃上清,100 μL 1×Binding Buffer重悬细胞,每管加入5 μL Annexin V-FITC和5 μL PI染料,避光条件下,4℃固定 30 min后,采用流式细胞仪测定细胞凋亡率。
1.3.6 细胞周期 实验以1×105个·mL-1的终浓度将NCI-H520细胞悬液接种于6孔板中,待贴壁后,每孔加入终体积为2 mL的含药培养液。实验分组同“1.3.2”,药物浓度如“1.3.4”所述。恒温培养24 h后,收集细胞悬液,用预冷的PBS洗涤细胞两次,用75%的乙醇重悬细胞,4℃过夜。1 500 r·min-1离心5 min,弃掉上清,并用PBS洗涤1次,用200 μL PBS重悬细胞,每管加10 mg·mL-1PI染料1 μL和10 mg·mL-1RNase A 溶液 1 μL,避光条件下,4℃固定30 min后,采用流式细胞仪测定周期。
1.3.7 蛋白质免疫印迹实验 以1×105个·mL-1的终浓度将NCI-H520细胞悬液接种于6孔板中,待贴壁后,每孔加入终体积为2 mL的含药培养液。实验分组同“1.3.2”,药物浓度如“1.3.4”所述。收集细胞悬液,使用SDS裂解液提取总蛋白,测定蛋白浓度,并确定上样体积。配制12%十二烷基硫酸钠聚丙烯酰胺凝胶sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE),每组上样量为 20μg,采用80 V恒压电泳,200 mA恒流转膜,5%脱脂奶粉封闭 1 h。一抗 P21(1∶1 000),P53(1∶1 000),BAX(1∶1 000),BCL-2(1∶1 000),内参 β-actin(1∶2 000),4 ℃摇床过夜。二抗 P21(1∶2 000),P53(1 ∶2 000),BAX(1∶2 000),BCL-2(1∶2 000),内参β-actin(1∶4 000),摇床室温孵育 1 h,在暗室用化学发光(enhanced chemiluminescence,ECL)显色曝光。将曝光结果进行灰度分析,比较各组目标蛋白表达量的变化。
1.4 统计学分析 本实验采用GraphPad Prim 5和SPSS来对实验数据进行分析,所有实验独立重复进行3次,实验结果以±s的形式表示,两两比较采用独立样本t检验进行分析,多组间比较采用单因素方差分析,P<0.05为结果具有统计学意义。
2 结果
2.1 L-CNT能够增强DTX对NCI-H520细胞增殖的抑制作用 MTT的结果表明,DTX对NCI-H520细胞的抑制作用具有浓度依赖性,随着药物浓度的增加,抑制作用增强(图1F)。在显微镜下观察各组细胞生长情况,对照组和L-CNT细胞组细胞贴壁状态良好,细胞密度大,胞膜完整,细胞间连接紧密(图1A和1B);DTX组细胞密度降低(图1 C);联合用药组细胞密度进一步降低,细胞间隙变大(图1 D)。MTT结果显示,L-CNT对NCI-H520细胞的增殖无明显影响,与L-CNT单药组相比,L-CNT+DTX组细胞增殖率显著降低,具有统计学差异(P<0.05);DTX能够抑制NCI-H520细胞的增殖(P<0.05);与DTX单药组相比,L-CNT+DTX组的细胞增殖率进一步降低,且具有统计学差异(P<0.05)(图1 E)。结果表明,L-CNT能够增强DTX对NCI-H520细胞增殖的抑制作用。
2.2 DTX在24 h不诱导细胞发生凋亡 细胞凋亡的结果显示,24 h时,L-CNT组,DTX组和L-CNT+DTX组的细胞凋亡率与对照组相比,无统计学差异(图2 A和2B),结果表明,L-CNT,DTX以及联合用药在24 h均不诱导NCI-H520细胞发生凋亡,结合“2.1”的实验结果,表明DTX对NCI-H520细胞在24 h主要表现为抑制增殖的药理作用。
2.3 L-CNT能够增强DTX诱导的G2/M期阻滞 细胞周期的结果显示,L-CNT对细胞周期没有显著影响,与L-CNT组相比,L-CNT+DTX组G2/M期细胞的比显著升高,G1/G0期细胞显著减少,均具有统计学差异(P<0.01);DTX能够诱导细胞发生G2/M期阻滞(P<0.01);与 DTX 组相比,L-CNT+DTX 组 G2/M期细胞比例进一步升高,G1/G0期细胞比例降低,且均具有统计学差异(P<0.05)。结果表明,L-CNT能够增强DTX诱导的G2/M期阻滞(图3)。
2.4 L-CNT能增加P21和P53蛋白的表达 Western blot结果显示,同L-CNT组相比,L-CNT+DTX组细胞周期相关蛋白P21和P53的表达明显增高(P<0.05);DTX能够诱导P21和P53蛋白表达升高(P<0.05);同DTX组相比,L-CNT+DTX组P21和P53蛋白的表达量进一步增高(P<0.05)。而各实验组凋亡相关蛋白BAX和BCL-2的表达量没有发生变化(图4),说明L-CNT增强DTX抑制NCI-H520细胞增殖的能力可能是通过增强周期相关蛋白P21和P53的表达来实现的。
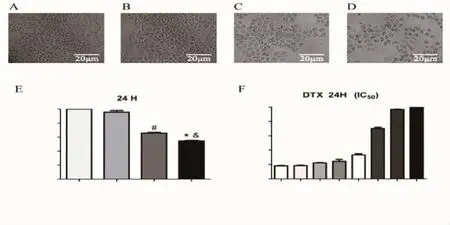
图1 L-CNT和DTX单药以及联合用药对NCI-H520细胞增殖的作用Fig 1 The effects of L-CNT,DTX or combination drugs on NCI-H520 cell proliferation
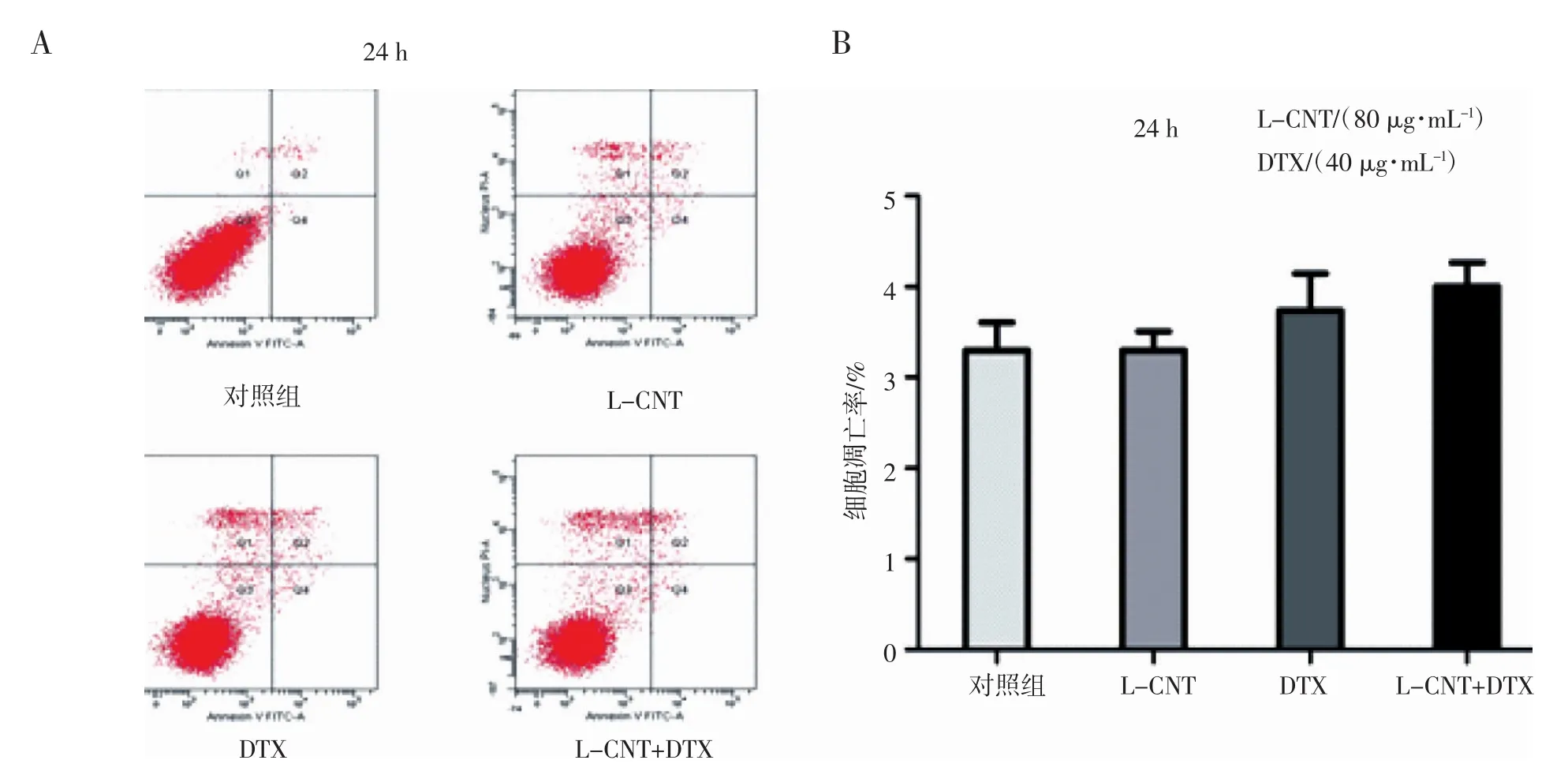
图2 L-CNT和DTX单药以及联合用药对NCI-H520细胞凋亡的影响Fig 2 The effects of L-CNT,DTX or combination drugs on NCI-H520 cell apoptosis
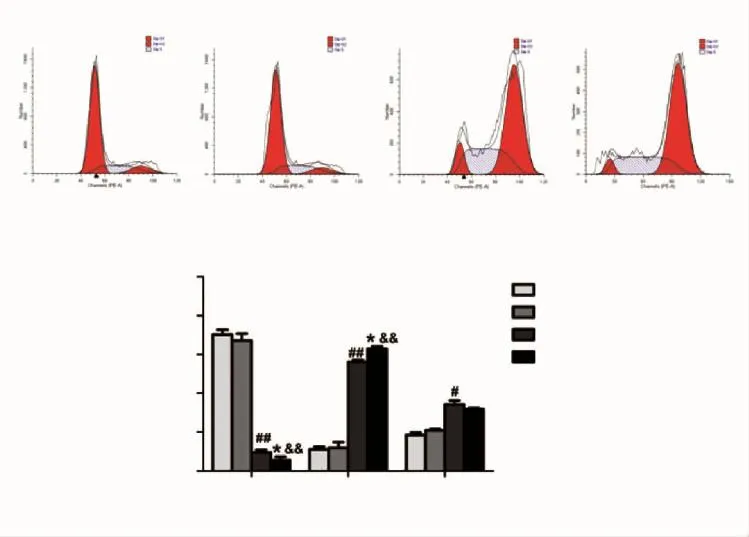
图3 L-CNT和DTX单药以及联合用药对NCI-H520细胞周期的影响Fig 3 The effects of L-CNT,DTX or combination drugs on NCI-H520 cell cycle
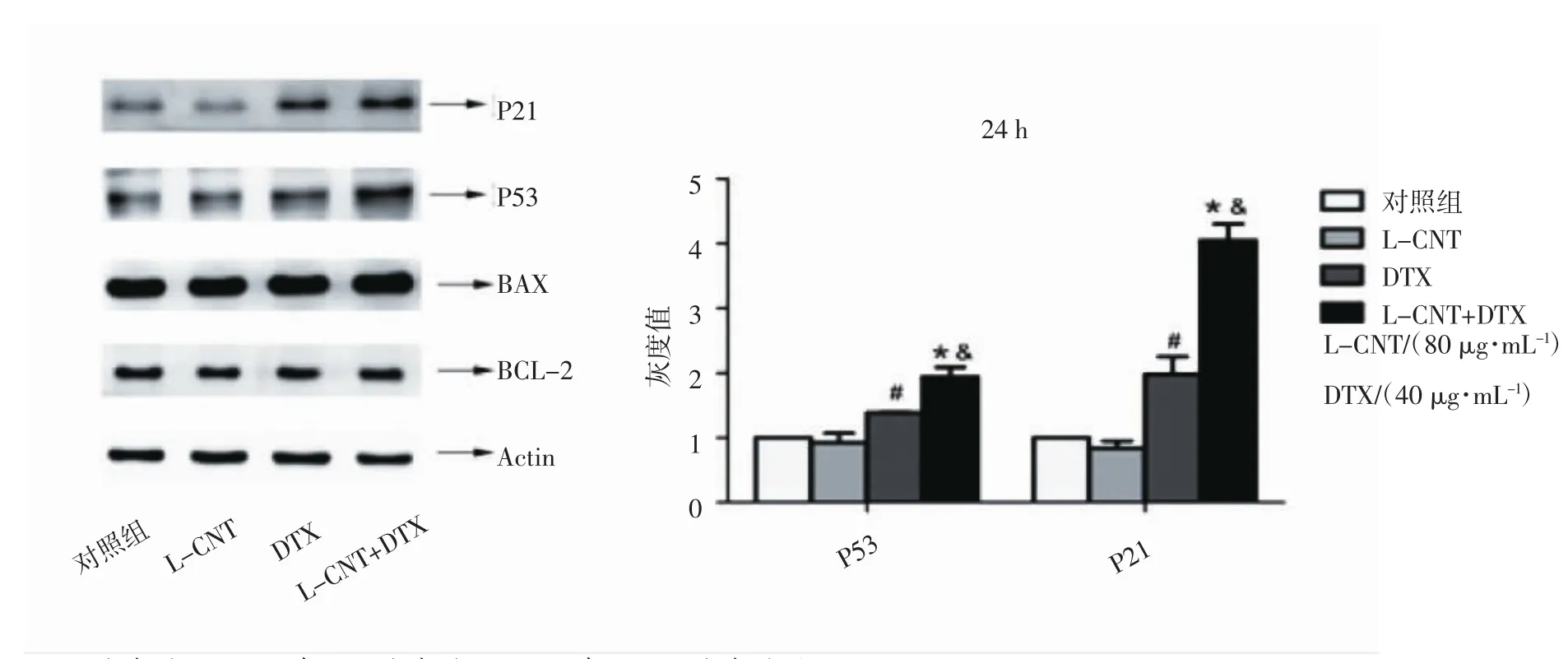
图4 L-CNT和DTX单药以及联合用药对NCI-H520细胞蛋白表达的影响Fig 4 The effects of L-CNT,DTX or combination drugs on the expression of proteins in NCI-H520 cells
3 讨论
DTX属于第二代紫杉烷类抗肿瘤药物,其能通过在肿瘤细胞有丝分裂期间,增强微管蛋白的聚合作用并抑制其解聚,进而形成无功能的微管束,将肿瘤细胞增殖阻滞于G2/M期来抑制肺癌细胞的增殖。L-CNT及其衍生物能够阻止ROS的形成,清除自由基,并防止细胞发生氧化应激,从而发挥细胞保护作用。
细胞周期受多种细胞通路调控,其中P53-P21通路发挥重要作用。P53是一种重要的肿瘤抑制基因[11],参与诱导细胞周期阻滞,进行DNA修复等以响应各种细胞应激反应,包括DNA损伤,致癌应激,端粒功能障碍和缺氧等[12-13]。在细胞周期的调节中,P53主要负责监测G0/G1和G2/M期的修正点,以起到调节周期的作用[14]。此外,它还能调节下游P21基因的表达[15],并在细胞增殖中起重要作用。P21是P53的下游基因,其编码的P21Cip/Wafl蛋白是具有广泛激酶抑制活性的细胞周期抑制蛋白。P21Cip/Wafl与cyclinD,CyclinE和CDK2一起在细胞周期抑制中发挥作用[16-18],P21的表达能够诱导G1期,G2/M期或S期阻滞[19],进而发挥抑制细胞增殖的效应。
由本实验的结果,我们观察到,DTX与L-CNT联合应用后,周期相关蛋白P53与P21表达升高,细胞G2/M期阻滞增强。这可能是L-CNT的加入,使NCI-H520细胞中P53的蛋白表达量增加,进而诱导下游的P21蛋白表达升高,激活P53-P21通路发挥细胞周期抑制作用;有研究表明,DTX诱导细胞凋亡的发生晚于其诱导的细胞周期阻滞[20],本研究的结果也表明DTX在NCI-H520细胞中的抗肿瘤作用,在24 h时,只表现为对细胞增殖的抑制作用,而不诱导细胞发生凋亡,因此,关于L-CNT对DTX诱导的细胞凋亡的影响还有待进一步研究。此外,本文只针对L-CNT和DTX同时给药24 h进行了研究,而对于L-CNT和DTX的给药顺序是否会对其作用产生影响,仍有待于进一步研究。肿瘤病理错综复杂,不同病理分型的肿瘤对于化疗药物的敏感性不同,而L-CNT与不同的化疗药物联合应用所产生的相互作用也不尽相同,因此,在使用左卡尼汀预防或降低心脏毒性的同时,如何更合理地与抗肿瘤药物联合应用,值得进一步研究。
