不同miR-146a表达条件下Treg细胞体内回输对小鼠心脏移植免疫排斥反应的影响
2018-10-24曹际森王多伟
于 洋 ,曹际森 ,王多伟 ,戚 峰
(1.天津医科大学总医院普通外科,天津300052;2.天津港口医院外科,天津300456;3.天津市第三中心医院肝胆外科,天津300170)
研究发现,调节T细胞负责维持体内免疫稳态和免疫耐受[1],随着对其功能研究的不断深入,相关人员已将其应用于抑制器官移植的免疫耐受。近年来相关研究表明miRNA通过调控免疫相关基因的表达影响免疫系统的发育及功能[2],其中miR-146a是目前研究较为广泛的miRNA之一,它在不同物种间的序列高度保守,并且在器官移植免疫排斥过程中发挥着重要的作用[3]。大量研究发现miR-146a在Treg细胞的抑制功能的发挥上起着重要的调控作用[4-5]。在此基础上,本研究的主要目的是探讨Treg细胞体内回输对小鼠心脏移植免疫排斥反应的影响以及进一步调控miR-146a的表达对Treg细胞抑制功能的影响。
1 材料和方法
1.1 实验材料 实验选用6~8周龄雄性C57,Balb/c小鼠(购于中国医学科学院放射医学研究所实验动物中心,体质量20~25 g),饲养于天津医科大学总医院实验动物中心。
1.2 实验方法
1.2.1 Treg细胞的分选及体外扩增 无菌条件下获取及处理脾脏,加入PBS制备脾单细胞悬液,单细胞悬液白细胞计数,用PBS调整细胞密度为1×106,流式标本的制备后立刻上机分选CD4+CD25+Treg细胞,采用德国美天旎公司的Treg细胞体外扩增试剂盒按说明书完成CD4+CD25+Treg细胞的体外扩增。
1.2.2 Treg细胞转染 对扩增之后的Treg细胞采用广州锐博公司的miR-146a agomir和miR-146a antagomir试剂进行细胞转染,分别实现对Treg细胞miR-146a表达水平的上调和下调。具体实验步骤如下:用完全1640培养基重悬细胞后,进行细胞计数并检测细胞活力。然后用完全培养基按3×105/mL的密度接种在24孔板中。将培养板置于37℃、5%CO2培养箱中孵育30min。分别在相应孔中加入100nmol/L agomir及150 nmol/L antagomir对Treg细胞转染,之后置于37℃、5%CO2条件下培养3 d后进行下一步检测。
1.2.3 实时荧光定量聚合酶链式反应(RT-PCR) 采用RT-PCR方法检测转染后调节T细胞的miR-146a表达水平。具体步骤包括:总miRNA提取,miRNA逆转录,实时定量PCR,用2-△Ct将原始数据(△Ct值)转化成线性形式进行统计处理,再以2-△△CT方法计算miRNA的相对表达量。
1.2.4 小鼠腹腔异位心脏移植模型的建立及处理 取Balb/c小鼠心脏作为供体,以C57小鼠作为受体,构建小鼠腹腔异位心脏移植模型[6-7]。实验分为NS对照组、Treg对照组、agomir组、antagomir组。于移植手术完成后立即经阴茎背静脉推注相应转染后的Treg细胞(数量均为106个)。术后小鼠分为两部分,一部分小鼠每日经腹壁触摸移植心脏搏动情况,直到供心停跳,记录各组供心存活时间。另一部分小鼠在术后第5天处死,取部分移植心脏组织用福尔马林固定,石蜡包埋后切片,行HE染色;流式检测受体脾脏中T细胞亚群及Th细胞的比例;RT-PCR技术检测术后 5 d供心IFN-γ、IL-4、IL-17mRNA的表达水平,实时定量PCR的实验方法同前,相关因子引物序列如下:

1.3 统计学处理 所有实验均重复6次,所得实验数据运用SPSS19.0软件包进行统计学处理。计量资料表示为±s,两样本之间的比较采用t检验,3组以上比较采用方差分析(one-way ANOVA),组间均数间多重比较采用最小显著差法(least significant difference,LSD)。
2 结果
2.1 Treg细胞扩增前后的纯度及miR-146a表达水平检测 Treg细胞经扩增试剂盒扩增后,流式检测结果显示细胞数量达扩增前的10倍,纯度为92.3%,如图1所示。RT-PCR结果显示,扩增前后Treg细胞miR-146a的表达水平无显著差异(P>0.05),见表1。

图1 Treg细胞扩增前后的纯度检测Fig 1 The purity of Treg cells before and after cell amplification

表1 扩增前后miR-146a的表达水平检测Tab 1 Expression of miR-146a before and after cell amplification
2.2 各组小鼠心脏移植术后生存曲线分析 如图2所示,与生理盐水对照组相比,输注空白Treg细胞能够明显延长供心的生存时间,在此基础上应用miR-146a agomir上调Treg细胞中miR-146a的表达,能够使供心生存时间进一步延长(P<0.05),与之相反的是,输注下调miR-146a的Treg细胞却使得供心生存时间较空白Treg组显著缩短(P<0.05)。

图2 各组小鼠心脏移植术后生存曲线分析Fig 2 The survival curves of mice after heart transplantation in each group
2.3 各组小鼠心脏移植术后5 d供心病理分析 对术后5 d各组供心进行了病理学分析,如图3、表2、3所示,miR-146a上调组的急性排斥反应病理分级较空白 Treg组显著降低(P<0.05),而 miR-146a下调组急性排斥反应病理分级较空白Treg组显著升高(P<0.05)。
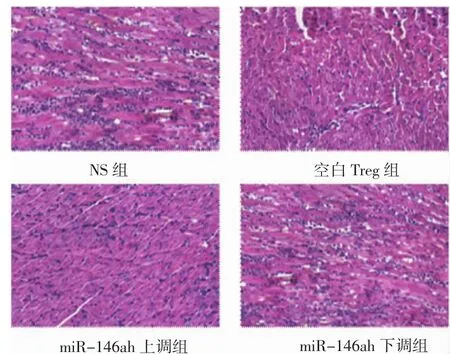
图3 各组移植心脏HE染色Fig 3 HE-staining of donor hearts in each group
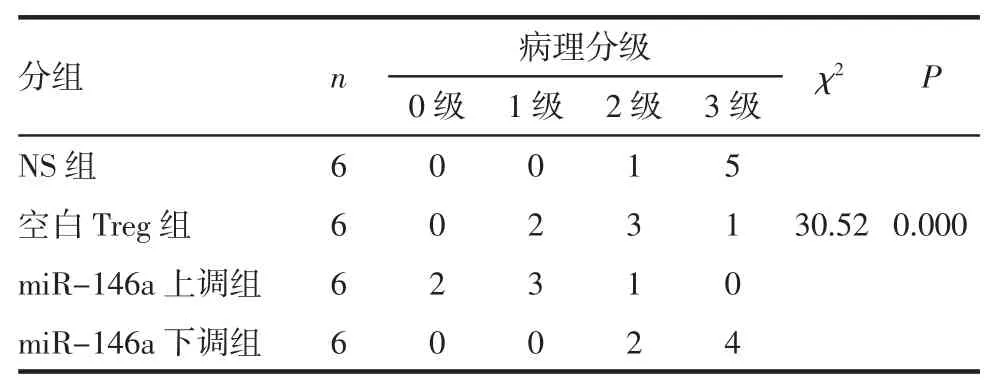
表2 各组移植心脏病理分级Tab 2 The pathological grades of donor hearts in each group

表3 各组间病理结果两两比较(P)Tab 3 Paired comparison of thepathologicalgradesineachgroup(P)
2.4 各组小鼠心脏移植术后5 d受体脾脏T细胞亚群检测 流式结果显示,与空白Treg组相比,miR-146a上调组CD4+T细胞数量显著降低(P<0.05),CD8+T细胞数量无明显区别(P>0.05),而 miR-146a下调组 CD4+、CD8+T 细胞数量无明显区别(P>0.05),如图4和表4、5所示。
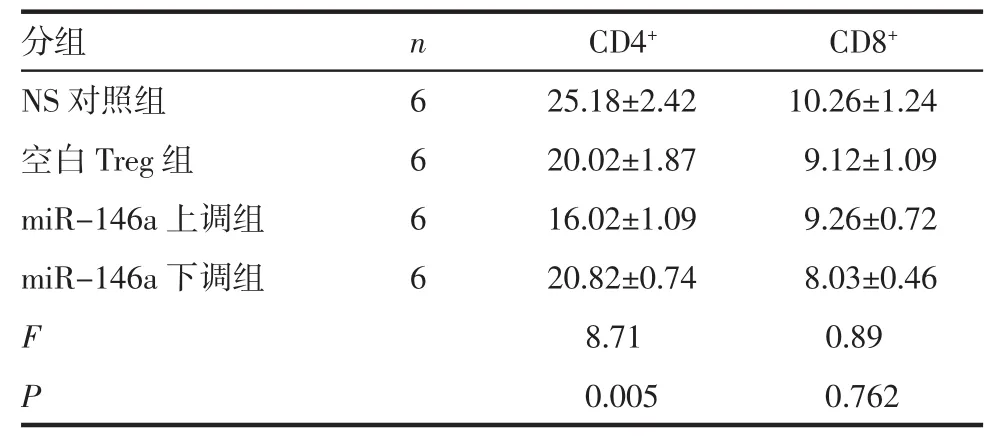
表4 各组受体小鼠术后5 d脾脏T细胞亚群分析Tab 4 Cells of spleen in recipients by flow cytometry on the 5th day after transplantation

表5 各组间CD4+结果两两比较(P)Tab 5 Paired comparison of CD4+in each group(P)
2.5 各组受体小鼠心脏移植术后5 d脾脏Th细胞亚群检测 与空白Treg组相比,miR-146a上调组Th1、Th2和 Th17细胞数量无明显差别(P>0.05);而miR-146a下调组Th1细胞数量显著升高(P<0.05),Th2和Th17细胞数量无明显区别(P>0.05),如表6、7所示。
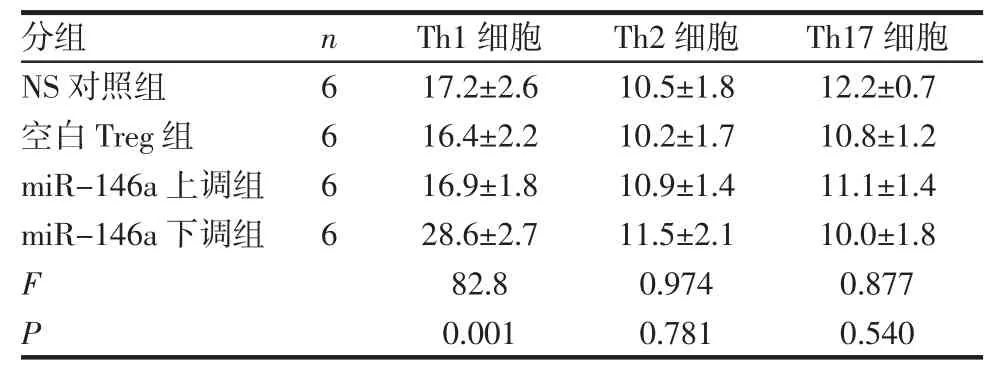
表6 各组受体小鼠术后5 d脾脏Th细胞亚群分析Tab 6 Th cells of spleen in recipients by flow cytometry on the 5th day after transplantation

表7 各组间Th1细胞结果两两比较(P)Tab 7 Paired comparison of Th1 cells in each group(P)
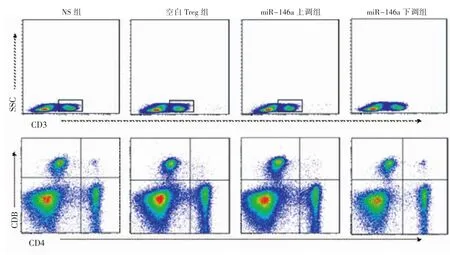
图4 各组术后5 d受体脾脏T细胞亚群流式检测Fig 4 T cells of spleen in recipients by flow cytometry on the 5th day after transplantation
2.6 各组受体小鼠心脏移植术后5 d供心相关细胞因子表达水平 如表8、9所示,与空白Treg组相比,miR-146a上调组供心IFN-γ、IL-4和IL-17的表达水平无明显差别(P>0.05);而miR-146a下调组供心 IFN-γ 的表达水平显著升高(P<0.05),IL-4、IL-17的表达水平无明显区别(P>0.05)。
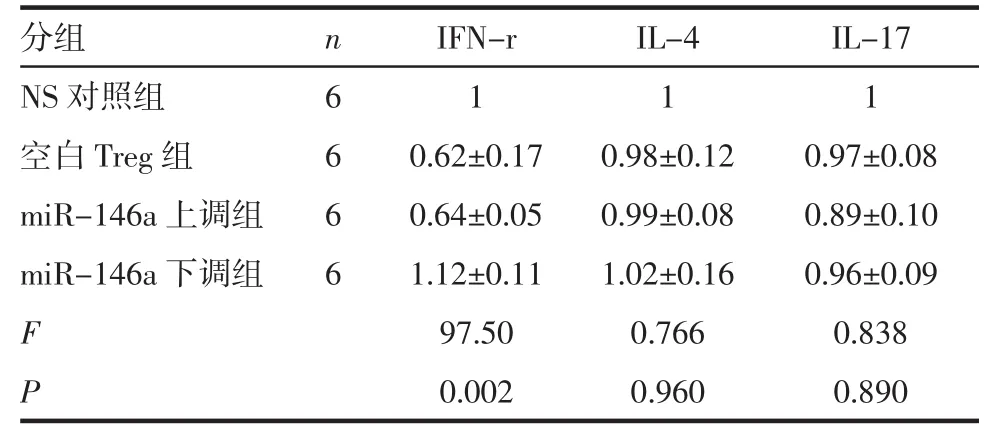
表8 各组受体小鼠术后5 d供心相关细胞因子检测Tab 8 Expression of related cytokines of donor hearts in recipients on the 5th day after transplantation
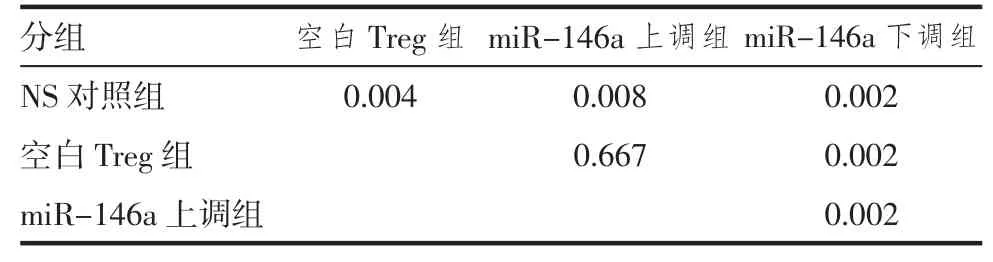
表9 各组间IFN-γ结果两两比较(P)Tab 9 Paired comparison of the expression of IFN-γ in each group(P)
3 讨论
器官移植的最终目的是受体对移植物产生类似于自身耐受的状态。早在1995年便有相关报道Treg细胞具有维持免疫耐受的作用。相关器官移植模型建立也表明其在维持免疫耐受的重要作用。Treg细胞作为一种治疗手段在几十年前出现[8]。Lee等通过小鼠骨髓移植模型证明了回输Treg细胞可以有效的防止移植物抗宿主病的发生或延缓病程进展。Treg是目前用于I期临床试验较多的调节T细胞,其通过细胞接触式和非细胞接触式两种方式实现免疫抑制。但是单一的抑制性细胞因子治疗却不能达到满意的治疗及抑制效果。而互噬作用可能会成为未来临床免疫耐受研究的新途径[9]。miRNA近年来成为免疫学领域的新热点,其能调控相关基因来影响免疫功能,进而参与更多自身免疫疾病发展。研究表明,miR-146a在器官移植的免疫排斥过程中起着重要的调控作用,而且研究人员证实,miR-146a对于Treg细胞的功能发挥也起着重要作用[10-11]。基于相关文献,我们将不同miR-146a表达条件下Treg细胞在小鼠心脏移植后回输体内,假设被移植心脏抗原激活效应T细胞,可被Treg细胞识别为自身反应性T细胞,从而被抑制,由此在受体内长期存在的,针对移植抗原记忆的Treg细胞,形成自身耐受的耐受模式,这就是的本课题的研究思路。Treg细胞是通过细胞间的直接作用来实现的[12],结合体外抑制实验得出要想实现有效的抑制功能,必须要满足足量的细胞数量。大量动物实验表明,要想达到回输的有效作用,细胞数量要达到106以上,而常规体外分选所得的Treg细胞数量极为有限[13],因此获得足够细胞数量,一直困扰从事细胞回输的研究人员,2009年研究人员首次成功地用体外扩增Treg细胞解决了细胞数量不足的困扰[14]。本实验采用扩增试剂盒有效获得满意细胞数量,并维持了Treg细胞的细胞表型及免疫功能。我们的实验结果表明,体内回输空白Treg及上调miR-146a表达后的Treg可减轻急性免疫排斥反应,延长移植心脏存活期,减轻移植心脏病理炎症反应,上调组作用更为明显。这进一步证实了miR-146a对Treg细胞起着重要的调控作用,上调Treg细胞中miR-146a的表达能够进一步增强其抑制功能,其具体机制也有待于进一步深入研究。但是,我们的实验也发现回输下调miR-146a的Treg细胞后,生存时间较空白Treg组缩短,病理分级明显升高。在对移植物Th细胞的流式检测中我们发现下调组Th1较Treg对照组及上调组明显升高,对应的细胞因子IFN-γ也明显升高。由此可知下调miR-146a的Treg细胞抑制功能受到破坏,其具体机制可能是下调Treg细胞的miR-146a表达水平使其抑制Th1分泌IFN-γ的功能受损[15]。综上所述,体外能有效的分选和扩增Treg细胞,且不影响miR-146a的表达。回输Treg明显抑制小鼠心脏移植急性排斥反应,上调组抑制功能增强,下调组抑制功能减弱。但是回输后的Treg细胞能否在体内进行扩增,或者细胞不断凋亡对于移植免疫反应的影响还需进一步研究。关于miR-146a和Treg细胞在心脏移植免疫耐受的作用及机制还需要更深入的研究。
