南方刺参性腺多肽酶解工艺优化 及抗氧化活性分析
2018-10-22徐仰丽苏来金
徐仰丽,叶 剑,余 海,苏来金,*
(1.温州科技职业学院,温州市农业科学研究院,浙江温州 325006; 2.苍南县渔业技术推广站,浙江温州 325802)
刺参(Apostichopusjaponicus),又称刺参、灰刺等,隶属于棘皮动物门(Echinodermata)、海参纲(Holothuroidea)、楯手目(Aspidochirotida)、刺参科(Stichopodidae)、刺参属(Apostichopus),在北方沿海地区广为分布[1],随着刺参人工育苗、养殖技术日趋成熟,刺参养殖产业在全国快速发展,成为我国水产养殖业中产值、利润最高的产业之一,并带动形成了育苗、养殖、加工产业链的完善[2]。自2006年刺参南移成功以来,南方刺参养殖产业也逐渐趋于稳定,2017年南方刺参产量2.65万吨,占全国的12.97%[3],盐渍刺参、淡干刺参、即食刺参等产品加工技术也在不断进步[4],但是刺参加工产业配套技术尚未成熟,刺参精深加工仍处在起步阶段[5]。
刺参性腺是刺参卵和刺参精的统称,研究表明,刺参性腺具有丰富的营养成分,还含有多糖、皂苷等活性成分[6-11],在北方刺参加工中,加工者已经开始收集海参性腺进行销售或者再加工,但在南方刺参粗加工中,刺参性腺作为废弃物直接丢弃,既造成资源浪费,也造成了环境的污染。研究表明,刺参通过酶解制成的刺参肽具有较好的活性[12-15],刺参性腺蛋白含量高,含有诸多活性成分[16],但有关刺参性腺的综合利用研究不多,南方刺参性腺的研究尚未见报道,其中的差异未知,因此开展南方刺参性腺酶解的综合利用,有助于减少污染,提升副产物附加值,促进养殖增收增效。
本研究以南移养殖刺参的性腺为原料,以多肽得率为评价指标,优化了内切性Protamex复合蛋白酶催化酶解刺参性腺的最佳的工艺,并利用该工艺对南、北方养殖刺参性腺进行酶解,分析了多肽液的抗氧化活性,为南方刺参性腺资源高效利用提供了方法依据。
1 材料与方法
1.1 材料与仪器
鲜刺参性腺 北方养殖刺参性腺由许鑫海参加工厂提供,养殖位置为青岛市即墨区田横镇马龙岛,2016年9月采收,-20 ℃冷冻后运往实验室;南方养殖刺参性腺 温州苍南水产技术推广站提供,养殖地点为苍南县马站镇霞关海域,2017年2月采收分离,-20 ℃冷冻运往实验室;Protomax复合蛋白酶(测定酶活5.23 mKat) 诺维信(中国)生物技术有限公司;超氧阴离子自由基检测试剂盒(磺胺比色法) 北京雷根生物技术有限公司;羟自由基清除能力测定试剂盒 北京索莱宝科技有限公司;CuSO4·5H2O、NaOH、三氯乙酸 维生素C等 分析纯,国药集团。
DF-2集热式恒温加热磁力搅拌器 常州华奥仪器制造有限公司;FE20K pH计 梅特勒-托利多;ALPHA 1-2LD PLUS真空冷冻干燥机 德国CHRIST;SP-754紫外可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 刺参性腺酶解工艺 新鲜南方养殖刺参性腺从养殖基地运往实验室后,冷冻干燥(条件:-30 ℃预冻,主干燥-25 ℃,10 Pa,16 h;水分5%以下),超微粉碎机粉碎500目后待用。称取一定量的冻干粉,按照一定比例加入水和蛋白酶,在一定温度下酶解,结束后灭酶,8000×g离心30 min后,取上清液待测。
1.2.2 酶活力测定 酶活测定按照文献[17],以酪蛋白溶液为底物,在40 ℃、pH7.2的条件下,每分钟催化水解酪蛋白产生1 μg酪氨酸所需的酶量定义为一个酶活力单位(U),为了方便计算,酶活力单位换算成mKat表示,公式为1 mKat=6×104U。
1.2.3 酶解液中多肽含量的测定 酶解液中多肽含量的测定参照文献[18]进行,将Gly-Gly-Tyr-Arg标准品配制成0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6和1.8 mg/mL标准溶液,分别取标准溶液6 mL放入10 mL离心管中,加入双缩脲试剂A 2.4 mL和双缩脲试剂B 1.6 mL,混匀。静置10 min,在2000 r/min离心10 min,离心后取上清液在540 nm的分光光度计下测定OD值,以肽浓度为横坐标,以OD值为纵坐标绘制标准曲线,样品中多肽含量通过回归方程计算求得。
1.2.4 酶解液中多肽得率 分别应用上述方法,检测酶解液酶解前后的多肽含量,计算多肽的得率[19]:
多肽得率(%)=(酶解后测得多肽含量-酶解前多肽含量)/总蛋白含量×100
1.2.5 酶解参数优化试验设计
1.2.5.1 单因素实验 酶解温度对多肽得率的影响:酶添加量为0.5 mKat/g,底物浓度为6%,pH6.0,酶解时间3 h,考察不同酶解温度(40、45、50、55、60、65 ℃)对多肽得率的影响;不同底物浓度对多肽得率的影响:酶添加量为0.5 mKat/g,pH6.0,酶解温度50 ℃,酶解时间3 h,考察不同底物浓度(4%、6%、8%、10%、12%)对多肽得率的影响;不同pH对多肽得率的影响:酶添加量为0.5 mKat/g,酶解温度50 ℃,酶解时间3 h,底物浓度6%,考察不同pH(5.0、6.0、7.0、8.0、9.0、10.0)对多肽得率的影响;不同酶解时间对多肽得率的影响:酶添加量为0.5 mKat/g,酶解温度50 ℃,pH6.0,底物浓度6%,考察不同酶解时间(1、2、3、4、5、6、7 h)对多肽得率的影响;不同酶添加量对多肽得率的影响:pH6.0,酶解温度50 ℃,酶解时间3 h,底物浓度6%,考察不同酶添加量(0.00、0.25、0.50、0.75、1.00 mKat/g)对多肽得率的影响。
1.2.5.2 响应面试验 根据单因素实验结果,酶作为催化剂,添加量应遵循节约、有效的原则,因此,多因素优化时,固定复合酶的添加量为0.5 mKat/g,响应面因素优化选择酶解温度(A)、底物浓度(B)、pH(C)、酶解时间(D)为影响因素,以刺参性腺多肽得率(Y)为响应值,根据Box-Behnken的中心组合实验设计原理,采用4因素3水平的响应面分析法进行实验设计,因素和编码水平见表1。

表1 响应面试验设计因素水平表Table 1 Factors and levelsTable of response surface design
1.2.6 抗氧化性实验 按照响应面优化的最佳条件,对南、北方养殖刺参性腺酶解得到的多肽溶液(浓度分别为10、20、40、60、80、100 mg/mL)分别进行体外抗氧化性试验。
1.2.6.1 超氧阴离子自由基清除率测定 使用清除超氧阴离子自由基测试盒(磺胺比色法),按照试剂盒说明书,试剂充分混匀,加入样品或者对照(阴性对照使用纯净水、阳性对照使用0.1 mg/mL维生素C溶液),37 ℃显色20 min,在530 nm处测定对照管和测定管的吸光值,分别记为A对照管和B测定管,多肽溶液清除超氧阴离子自由基能力计算公式:
超氧阴离子清除率(%)=(A对照管-B测定管)/A对照管×100
1.2.6.2 羟自由基清除能力测定 使用羟自由基测定试剂盒,根据试剂盒说明书,加入样品或者对照(阴性对照使用纯净水、阳性对照使用0.1 mg/mL维生素C溶液),加入试剂3,混匀,37 ℃反应1 min(准确以秒表计时),立即加入显色剂终止反应,混匀,室温放置20 min,在波长550 nm,测定各管吸光度值。多肽溶液清除羟自由基能力计算公式:
羟自由基清除率(%)=(OD标准-OD测定)/(OD标准-OD对照)×100
1.2.6.3 铁离子还原力测定 按照文献[20]进行,在反应管中加入0.1 mL样品溶液,再加入2.4 mL FRAP工作液,37 ℃水浴10 min,于593 nm处测定吸光度;配置0、100、200、400、800、1600 μmol/L的FeSO4的标准液替代样品,绘制标准曲线,阳性对照使用0.1 mg/mL维生素C溶液,样品抗氧化能力以FRAP值表示,通过方程求得相当于FeSO4浓度。
1.3 数据处理
2 结果与讨论
2.1 四肽标准曲线
根据不同浓度Gly-Gly-Tyr-Arg在540 nm下测定的吸光值绘制标准曲线,结果见图1。

图1 Gly-Gly-Tyr-Arg标准曲线Fig.1 Standard curves of Gly-Gly-Tyr-Arg
由图1可知,Gly-Gly-Tyr-Arg标准样品的回归方程为y=1.5466x+0.1064(R2=0.9992),在肽浓度0~1.8 mg/mL之间,线性关系良好,可用于溶液中多肽的检测。
2.2 单因素实验结果与分析
2.2.1 酶解温度对多肽得率的影响 不同酶解温度对刺参酶解提取多肽得率的影响结果见图2。从图2中看出,随着温度的升高,多肽得率先逐渐升高,这可能是由于温度升高提升了酶的活力,同时也增加了酶解体系的扩散程度;当温度为55 ℃时,多肽得率达到最高值为61.51%±0.99%,继续升高温度,多肽得率开始降低,这说明该酶的最适温度在55 ℃左右,因此,选择最佳的温度为55 ℃。

图2 酶解温度对多肽得率的影响Fig.2 Effect of extraction temperature on the polypetide yield
2.2.2 底物浓度对多肽得率的影响 不同底物浓度对刺参性腺酶解提取多肽得率的影响如图3所示,当底物浓度从4%升至12%时,提取率先增加后降低,在底物浓度10%时达到最高,提取率为66.41%±0.76%,这可能是由于底物浓度低时,酶与底物接触概率小,降低了酶解速率,而在底物浓度较高时,酶解体系粘稠,流动性减弱,也降低了酶解速率[21],因此选择底物浓度为10%。

图3 底物浓度对多肽得率的影响Fig.3 Effect of substrate concentration on the polypeptide yield
2.2.3 pH对多肽得率的影响 不同pH对刺参性腺酶解提取多肽得率的影响见图4,酸性环境下,随着pH的升高,多肽得率逐渐上升,中性环境多肽得率较高,碱性条件有所下降,当pH为7.0时,多肽得率达到最高值为64.20%±0.12%,这可能是因为酶解体系如果偏离了酶的最适pH,会导致酶活力减弱,使得酶解效率、多肽得率降低。因此,选择最佳的pH为7.0。

图4 pH对多肽得率的影响Fig.4 Effect of pH on the polypeptide yield
2.2.4 酶解时间多肽得率的影响 不同酶解时间对刺参性腺酶解提取多肽得率的影响见图5。从图5中可以看出,随时间的延长,刺参性腺多肽的得率逐渐增加,在4~6 h,多肽得率为62.68%~64.15%之间,趋于平稳,超过6 h后,多肽得率开始迅速下降,这可能是酶解时间过长,海参性腺被降解成更短的肽或者游离的氨基酸造成的[22]。考虑到节约时间,提升酶解效率,选择4 h为最优酶解时间。

图5 酶解时间对多肽得率的影响Fig.5 Effect of extraction time on the polypeptide yield
2.2.5 酶添加量对多肽得率的影响 复合酶的酶添加量对刺参性腺多肽酶解提取多肽得率的影响见图6。从图6中可以看出,随着酶添加量的增多,多肽得率逐渐增加,;当酶添加量为0.5 mKat/g和1.0 mKat/g时,多肽得率分别为61.78%±1.54%和62.73%±2.01%,差异不显著(p>0.05),这种结果是由于在酶解体系中,底物浓度充足时,反应速率与酶浓度成正比;当底物不足、酶过量时,过量的酶不会加快反应速率,即酶的过量,并没有影响到多肽得率。考虑到节约用酶和可溶性蛋白的量,确定酶用量为0.5 mKat/g。

图6 酶添加量对多肽得率的影响Fig.6 Effect of enzyme addition on the polypeptide yield
2.3 响应面结果与分析
2.3.1 响应面设计试验结果 根据Design-Expert软件设计,试验方案和结果见表2,从表2中可以看出,复合酶酶解刺参性腺多肽得率在32.07%~66.29%之间。
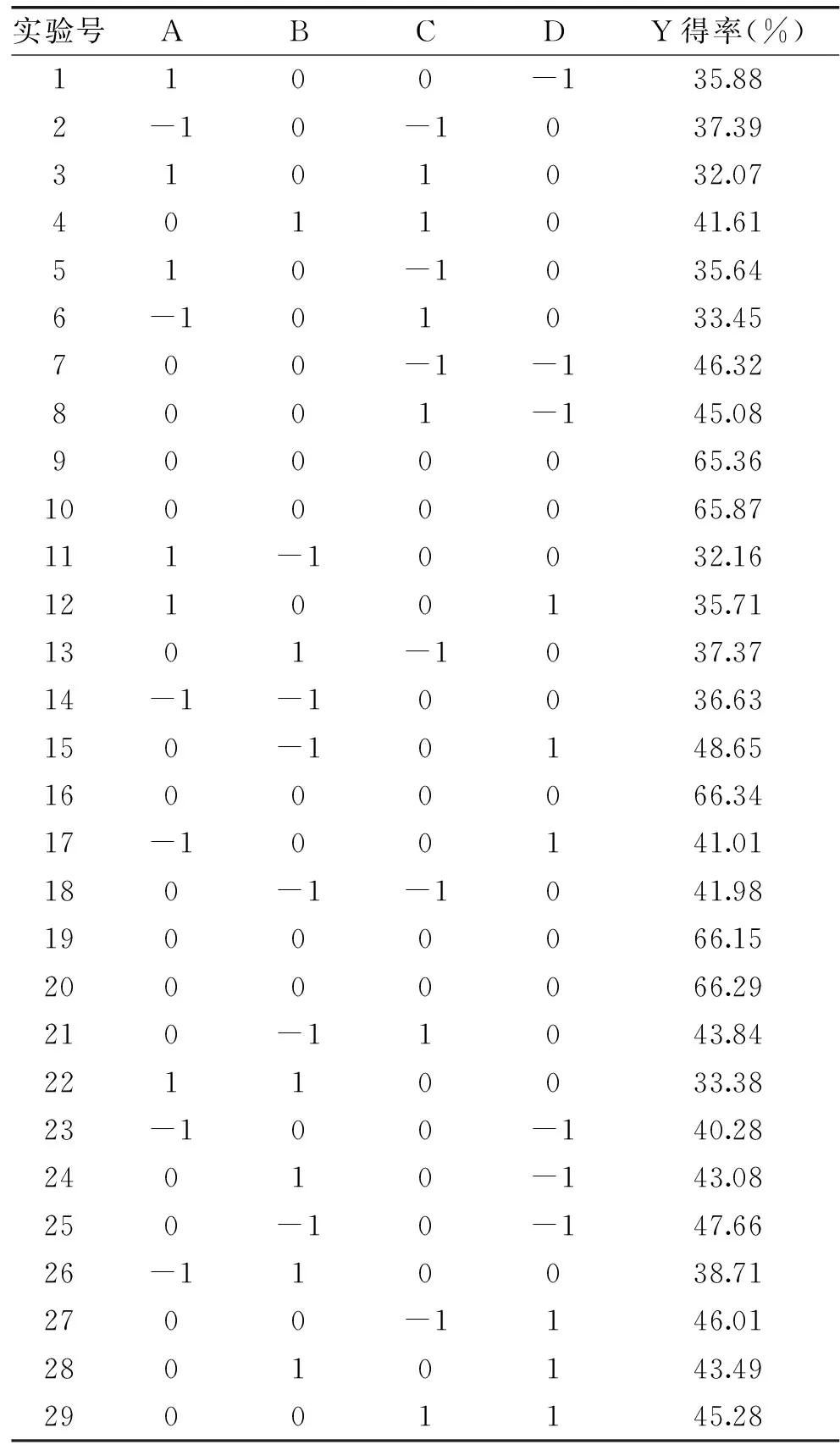
表2 响应面设计与结果Table 2 Results of response surface analysis
2.3.2 回归方程与分析 利用Design Expert软件,对表2中实验数据进行多元回归拟合,得到多肽得率的二次多项回归方程:
Y(多肽得率)=66.78+1.88A+2.60B+4.89C+3.26D-0.15AB-0.68AC-0.07AD-1.04BC+1.00BD-0.89CD-2.78A2-3.39B2-8.65C2-4.30D2。
利用软件开展模型可信度分析见表3,拟合度R2=0.9892,说明98.92%的变化是由所选变量引起的,说明该模型拟合程度良好;变异系数(C.V.)小于5%,表明可靠性高;信噪比为33.0494,远大于4。综上所述,本实验模型较为理想,可以用于刺参性腺多肽最佳制备工艺的模拟估算。

表3 模型的可信度分析Table 3 The credibility analysis of the model
按照回归模型方差分析(ANOVA)进行分析,分析结果见表4,从表中可以看出,模型F值为91.7,模型极显著(p<0.01);一次项A、B、C、D和二次项A2、B2、C2、D2的对多肽得率影响极显著(p<0.01),交互作用BC和BD对多肽得率影响显著(p<0.05),其他交互项对多肽得率影响不显著(p>0.05)。

表4 回归方程系数及显著性检验Table 4 Regression equation coefficient and significance examine
2.3.3 因素间交互作用 根据Design Expert软件得出的回归模型各因素之间的交互作用,从图7中可以看出,酶解温度和酶解时间一定时,随着底物浓度升高,多肽得率先升高后降低,
随着pH升高,多肽得率先升高后降低,从等高线图可以看出,底物浓度与pH的交互作用对多肽得率影响显著(p<0.05)。从图8中看出,酶解温度和pH一定时,随着底物浓度升高,多肽得率先升高后降低,随着提取时间延长,多肽得率先升高后降低,从等高线图可以看出,底物浓度与酶解时间的交互作用对多肽得率影响显著(p<0.05)。

图8 底物浓度与酶解时间交互作用Fig.8 The interaction of substrate concentration and time
2.4 响应面结果与工艺条件验证
以多肽得率最大值为评价指标,结合响应面曲面图和等高线图,应用上述方程,预测出最佳工艺条件为:酶解温度55.89 ℃,底物浓度11.51%,pH7.11,酶解时间4.41 h,预测的多肽得率可达到68.23%。
考虑到实际应用,修正工艺条件56 ℃,底物浓度11.5%,pH7.1,酶解时间4.5 h,在此条件下试验3次,实际测的多肽得率68.90%、68.03%和66.98%,平均值为67.97%,与理论值相差0.26%,可见该模型优化的最佳工艺条件具有可靠性。
2.5 南北刺参性腺多肽抗氧化活性比较
2.5.1 超氧阴离子自由基清除能力 利用最优工艺对南、北方养殖刺参性腺酶解得到的多肽溶液进行体外抗氧化性试验,超氧自由基的清除能力见图9。

图9 南北方养殖刺参性腺多肽 对超氧自由基的清除能力测定Fig.9 Superoxide radical clearance rate of Apostichopus japonicas Gonad polypeptide from South and North China
从图9中可以看出,随着多肽浓度的升高,超氧阴离子自由基的清除率均不断上升,当肽浓度为40 mg/kg时南、北方养殖刺参性腺多肽溶液超氧阴离子自由基抑制率分别为65.19%±2.83%、70.67%±2.29%,高于0.1 mg/mL的维生素C的抑制率61.25%±0.13%,表明刺参性腺多肽对超氧阴离子自由基有较强的抑制能力,随着多肽浓度继续增大,超氧阴离子自由基抑制率上升逐渐趋于稳定。
2.5.2 羟自由基清除能力 利用最优工艺对南、北方养殖刺参性腺酶解得到的多肽溶液进行体外抗氧化性试验,羟自由基清除能力见图10。
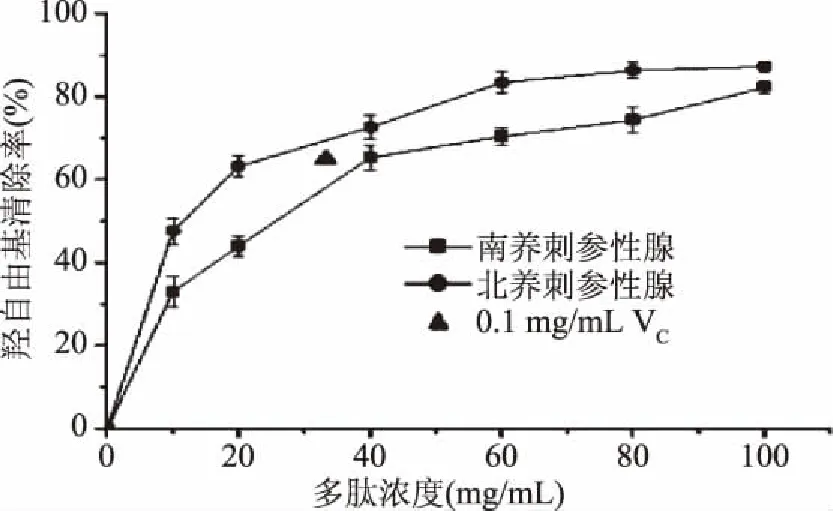
图10 南北方养殖刺参性腺多肽 对羟自由基的清除能力测定Fig.10 Hydroxyl radical clearance rate of Apostichopus japonicas Gonad polypeptide from South and North China
从图10中可以看出,随着多肽浓度的升高,清除率均不断上升,当多肽浓度为40 mg/kg时,南、北方养殖刺参性腺多肽溶液羟自由基抑制率为68.21%±2.68%、72.55%±3.09%,高于0.1 mg/mL的维生素C的抑制率64.54%±2.8 7%,表明刺参性腺多肽对羟自由基抑制能力较强,随着浓度继续增大,羟自由基抑制率上升逐渐趋于稳定。
2.5.3 铁离子还原能力 利用最优工艺对南、北方养殖刺参性腺酶解得到的多肽溶液进行体外抗氧化性试验,铁离子还原能力(FRAP值)见图11。

图11 南北方养殖刺参性腺多肽的铁离子还原能力Fig.11 Ferric ion reducing antioxidant power of Apostichopus japonicas Gonad polypeptide from South and North China
从图11中看出,FRAP随多肽浓度升高而增加,当肽浓度为60 mg/kg时,南、北方养殖殖刺参性腺多肽溶液的FRAP值分别达到613.49±25.59 μmol/L和 627.47±33.54 μmol/L,此时,大于0.1 mg/mL维生素C溶液的FRAP值,说明刺参性腺多肽具有良好的抗氧化性,随着多肽浓度继续增大,FRAP值的上升逐渐趋于稳定。
综上所述,南、北方养殖刺参性腺多肽抗氧化性总体趋势相同,但相同浓度条件下,北方养殖刺参性腺多肽的自由基清除率、FRAP值比南方养殖刺参的高,南、北方养殖刺参性腺多肽浓度为20、40、60、80、100 mg/mL时,对抗氧化能力超氧自由基、羟自由基清除率、FRAP值的纵向比较,经过比较均值独立样本T检验,无显著性差异(p>0.05)。当多肽浓度为10 mg/mL时,南北刺参多肽超氧自由基清除率、羟自由基清除率差异显著(p=0.026和p=0.039),这可能是由于南北刺参养殖生长环境影响不同,导致南北刺参体内含有的多糖或皂苷等活性成分差异[4],进而导致在低肽浓度下,肽的抗氧化性未起到主要作用。
3 结论
利用复合蛋白酶对南方养殖刺参性腺进行了酶解,以多肽得率为评价指标,经过单因素和响应面分析建立了酶解工艺模型,根据实际验证,确定了最佳酶解温度为56 ℃,底物浓度11.5%,酶添加量0.5 mKat/g,pH7.1,酶解时间4.5 h,此时刺参性腺多肽得率可达到67.97%±0.96%,结果可信。利用本方法对南、北方养殖刺参性腺酶解并进行抗氧化能力测定,发现刺参性腺多肽具有良好的抗氧化活性,南、北方养殖刺参性腺多肽抗氧化能力无显著差异。
