高糖通过诱导自噬障碍促进心肌细胞H9c2凋亡
2018-10-22方媛郭统帅吴岳刘洋曹瑜梦雷新军
方媛 郭统帅 吴岳 刘洋 曹瑜梦 雷新军
作者单位:710061 西安交通大学第一附属医院心内科
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病所致的心肌广泛局灶性损伤坏死,严重危害了人们的健康与生活,目前对于它的治疗仍缺乏有效的治疗手段[1]。研究表明长期高血糖状态引起的心肌细胞凋亡是其发病或病死的主要原因[2]。因此,深入阐明高糖(high glucose,HG)引起的心肌细胞凋亡机制对于DCM防治具有重要的意义。
自噬是一种细胞自我分解代谢途径,其在调节细胞存活中起着重要的稳态作用,几乎参与所有细胞的病理、生理过程。研究发现在多种心血管疾病中自噬异常[3],故推测自噬可能参与了HG引起的心肌细胞凋亡。本研究拟用HG诱导心肌细胞H9c2凋亡,观察其在HG诱导下H9c2细胞自噬相关蛋白的情况,之后用自噬抑制剂或诱导剂观察HG诱导H9c2细胞中自噬相关蛋白变化情况,试图为进一步研究DCM的发病机理奠定实验基础。
材料和方法
一、试剂
H9c2细胞(上海名劲生物科技有限公司),1 : 9的胎牛血清(北京索莱宝科技有限公司),DMEM(美国Invitrogen公司),青霉素和链霉素(上海碧云天),MTT粉末(青岛MDBio公司)。
二、实验方法
(一)细胞培养及分组
H9c2细胞培养液由1 : 9的胎牛血清与DMEM,再加0.1﹪青链霉素混合液构成。25 ml的细胞培养瓶中加入适量的H9c2细胞和3 ml的细胞培养液放置于37 ℃、5﹪ CO2的培养箱中培养,隔天更换培养液,2 ~ 3 d 传代一次。分成Control(为基础糖培养,含糖4.5 mg/ml)组, 12 mg/ml HG组,24 mg/ml HG组,48 mg/ ml HG组,Mannitol(在细胞活力检测时添加甘露醇等渗对照组以排除渗透压对实验结果的影响)组。
(二)MTT法检测H9c2细胞活力
收集对数生长期的H9c2细胞,把细胞悬液浓度调整为1×104个/ml,均匀接种于96孔板中,每孔100 μl,设调零组(加培养液及后续溶液,不加细胞)、对照组和药物处理组,每组设3 ~ 5个副孔,于培养箱中培养过夜。待细胞正常贴壁生长约75﹪,根据实验需要加入药物处理24 h。用PBS溶解MTT粉末(MDBio公司)配置0.5﹪ MTT溶液,每孔加入20 μl MTT溶液,继续孵育4 h。4 h后,吸出孔内液体,每孔加入150 ml DMSO,置摇床振荡10 min,以助结晶物充分溶解。最后用酶标仪在490 nm波长处测量各孔的吸光值。细胞存活率 = (药物处理组均值-调零组均值)/(对照组均值-调零组均值)×100﹪。样本量均大于等于3。
(三)hoechst33258染色法检测凋亡细胞
收集对数生长期的H9c2细胞,均匀接种于24 孔板,于细胞培养箱中培养至贴壁约75﹪,经药物处理24 h后,用预冷 PBS 摇床清洗细胞1 min×2 次,每孔加入 500 μl 预冷的 4﹪的多聚甲醛室温固定细胞10 min,用预冷PBS清洗细胞1 min×2次。用滤纸滤干孔板中的水,每孔加入约300 μl Hoechst 33258 染色剂(碧云天),于 4 ˚C 冰箱避光孵育10 ~15 min。预冷PBS洗涤细胞3次后,滤干水分后,可置于4 ˚C或-20 ˚C冰箱待用荧光显微镜观察拍照。在镜下凋亡细胞出现细胞核浓染致密的固缩形态出现强度荧光。
(四)Western Blot检测H9c2细胞Bax、Bclin-1和P62蛋白的表达
取对数生长期的H9c2细胞,把细胞悬液浓度调整为适宜浓度并均匀接种于培养瓶中,置CO2培养箱中培养过夜。待细胞正常生长贴壁约75﹪,根据实验需要加入药物处理24 h。经蛋白提取、BCA定量后进行Western Blot操作,根据所跑蛋白分子量的不同,配置10﹪或15﹪的分离胶,用乙醇封口,置于37 ℃生化培养箱中25 min,用滤纸小心吸出残留乙醇。加5﹪浓缩胶至分离胶上层并插入孔道梳子,注意避免产生气泡。待浓缩胶凝固垂直拔出孔道梳,用夹板固定,置电泳槽中,加入电泳液后上样(每孔加入等量的20 μg蛋白样品,第一孔加入3 μl的Marker)。先设置在 80 V进行电泳 40 min,后将电压改为120 V使蛋白继续跑到合适位置。根据Marker说明书在适当位置切胶,再进行恒流转膜,待转膜完成后,膜用5﹪脱脂牛奶常温摇床封闭2 h,再用5﹪脱脂牛奶稀释一抗,于4 ℃摇床孵育过夜。TBST洗膜5 min×5次,加入稀释的二抗孵育2 h后,再次用TBST洗膜5 min×5次,最后再膜上均匀加入显影液(A液: B液为1 : 1),在凝胶成像系统中成像,用Image J软件分析条带,样本量均大于等于3,最后统计各组灰度值。
三、统计学分析方法
本研究用SPSS 18.0软件进行数据分析,细胞活力OD值和蛋白条带灰度值均用表示,各组间差异用单因素ANOVA分析。以P< 0.05为差异有统计学意义。
结 果
一、HG诱导心肌细胞H9c2损伤
12,24,48 mmol/L的HG浓度依赖性地降低H9c2细胞活力,与Control组比较,差异具有统计学意义(P< 0.05);为排除渗透压对 H9c2细胞活力的影响,同时设置了甘露醇等渗对照组(即表1 Mannitol组),Mannitol组与 Control组比较,差异无统计学意义(P> 0.05),表明HG能诱导H9c2细胞损伤(表 1)。
12,24,48 mmol/L的HG处理,hoechst 33258染色后发现HG浓度越高,hoechst 33258阳性细胞越多(核固缩、透亮的细胞,即图1中白色箭头所示)数目的增加;在不同浓度HG处理后,用Western Blot法检测H9c2细胞促凋亡蛋白Bax发现,12,24,48 mmol/L的HG浓度可依赖性地上调H9c2细胞Bax蛋白的表达,且与Control组比较,差异有统计学意义(表 1,P< 0.05),表明 HG能诱导 H9c2细胞凋亡。
二、HG诱导H9c2细胞自噬相关蛋白表达异常
运用Western Blot法检测在不同浓度HG处理下,H9c2细胞自噬相关蛋白Beclin-1和P62的表达。结果发现,当增加HG浓度时,Beclin-1蛋白表达下调(表2);与之相反的是,当HG浓度越高,P62蛋白表达上调(表2),表明HG可诱导H9c2细胞自噬障碍。
三、自噬诱导剂雷帕霉素逆转HG诱导的细胞凋亡增加
H9c2细胞经雷帕霉素(Rap,100 nmol/L)预处理30 min后加入HG(HG,24 mmol/L)共处理细胞24 h,先用hoechst 33258染色观察各细胞核形态改变,发现雷帕霉素能明显阻断HG诱导的hoechst 33258染色阳性细胞(核固缩、透亮的细胞,即图2中白色箭头所示)数目的增加;用Western blot法检测H9c2细胞内Bax蛋白表达,结果显示,HG组(24 mmol/L HG)、HG和雷帕霉素共处理组、雷帕霉素组与Control组比较,Bax灰度值/β-actin灰度值分别为1.51±0.31(P< 0.05)、1.42±0.23(P< 0.05)和 1.81±0.12(P> 0.05),表明 HG 诱导的Bax蛋白表达增加被雷帕霉素所逆转,而单独给予雷帕霉素(100 nmol/L)处理H9c2细胞与Control组比较无显著影响。以上结果提示自噬介导了HG诱导的H9c2细胞凋亡这一损伤作用。
表1 高糖对H9c2细胞损伤的影响( ± s)
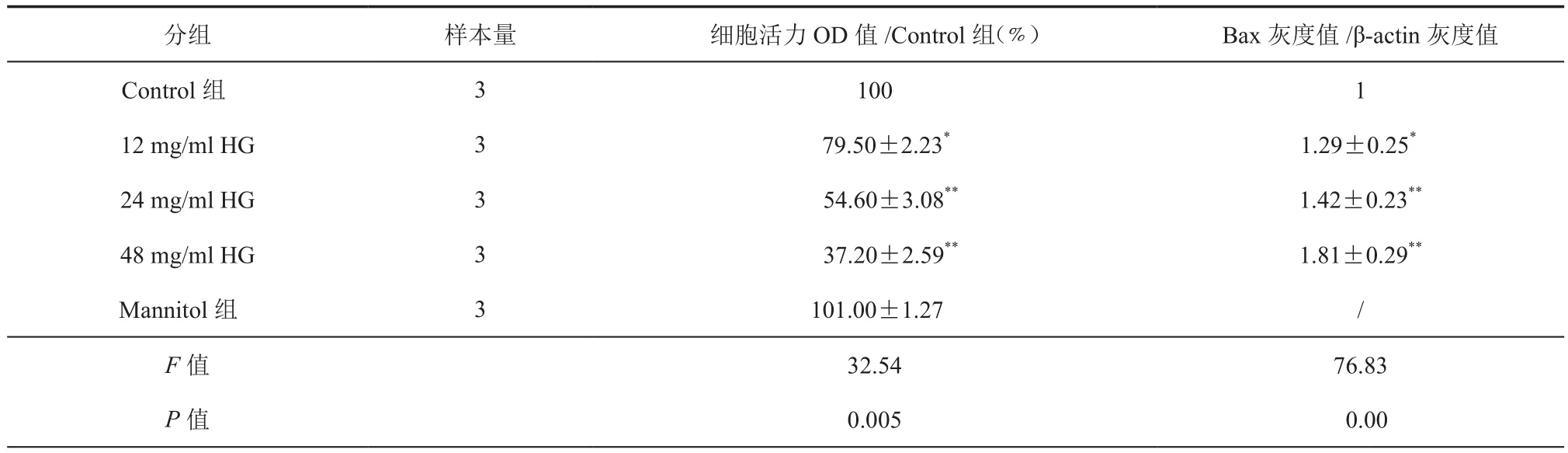
表1 高糖对H9c2细胞损伤的影响( ± s)
注:第3列是细胞活力值,第4列是蛋白条带灰度值。H9c2细胞用12、24、48 mmol/L的高糖处理24 h后,用MTT法检测细胞活力。HG为高糖的缩写。Mannitol,即甘露醇组作为一个等渗对照组,浓度为48 mmol/L;H9c2细胞用高糖(12,24,48 mmol/L)处理24 h后,用Western Blot法检测促凋亡蛋白 Bax蛋白的表达,与 Control组比较 *P < 0.05,**P < 0.01
分组 样本量 细胞活力OD值/Control组(﹪) Bax灰度值/β-actin灰度值Control组 3 100 1 12 mg/ml HG 3 79.50±2.23* 1.29±0.25*24 mg/ml HG 3 54.60±3.08** 1.42±0.23**48 mg/ml HG 3 37.20±2.59** 1.81±0.29**Mannitol组 3 101.00±1.27 /F值 32.54 76.83 P值 0.005 0.00
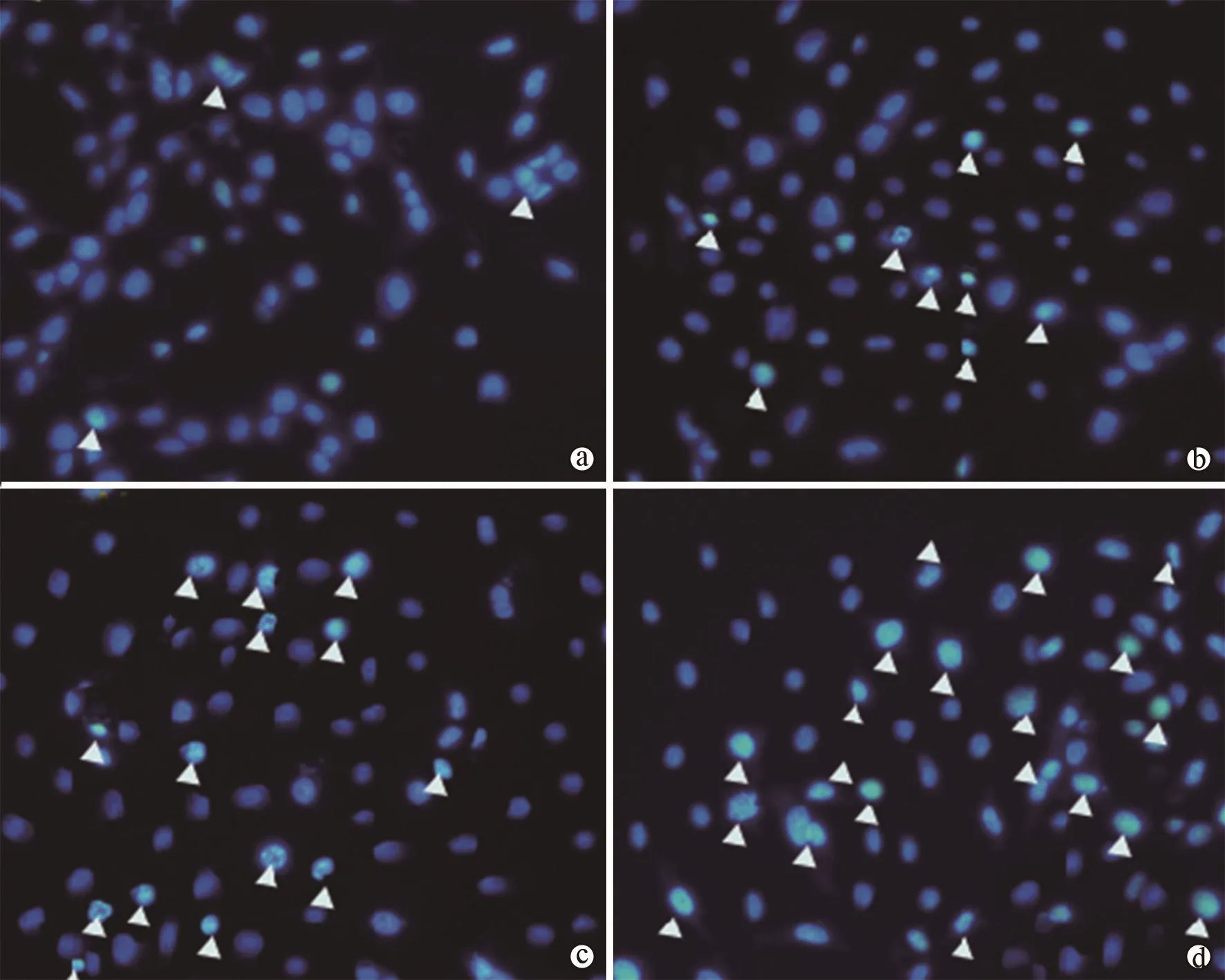
图1 荧光显微镜下观察高糖对H9c2细胞凋亡形态(Hoechst 33258染色,×200)
表2 高糖对H9c2细胞自噬相关蛋白表达的影响(灰度值比较, ± s)
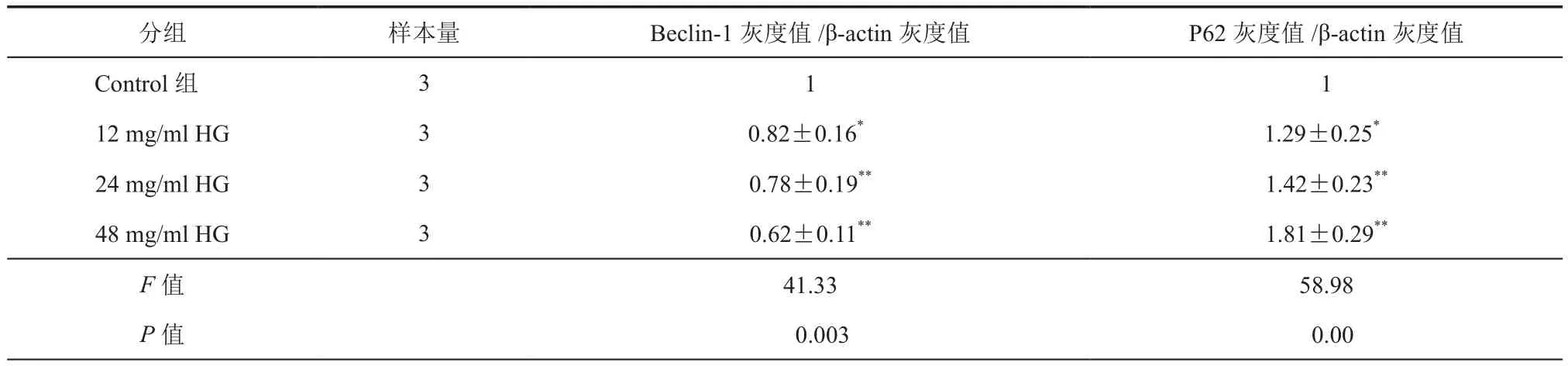
表2 高糖对H9c2细胞自噬相关蛋白表达的影响(灰度值比较, ± s)
注:H9c2细胞用高糖(12,24,48 mmol/L)处理24 h后,分别检测了自噬相关蛋白Beclin-1和P62蛋白的表达。与Control组比较*P < 0.05,**P < 0.01
分组 样本量 Beclin-1灰度值/β-actin灰度值 P62灰度值/β-actin灰度值Control组 3 1 1 12 mg/ml HG 3 0.82±0.16* 1.29±0.25*24 mg/ml HG 3 0.78±0.19** 1.42±0.23**48 mg/ml HG 3 0.62±0.11** 1.81±0.29**F值 41.33 58.98 P值 0.003 0.00
讨 论
DCM是一种独立的心肌疾病,每年约有2﹪~3﹪的糖尿病患者并发心血管病变。已有文献证明,DCM最终引发疾病或病死的主要原因在于高血糖引起的心肌细胞凋亡。因此本研究以HG诱导心肌细胞H9c2凋亡,试图阐明DCM的发病机理。
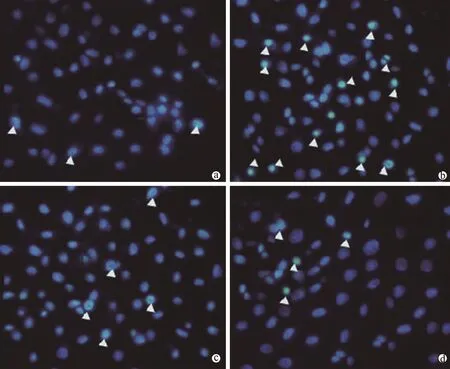
图2 荧光显微镜下观察雷帕霉素对高糖诱导的H9c2细胞凋亡的形态(Hoechst 33258染色,×200)
本研究首先用不同的HG诱导H9c2细胞损伤,通过用MTT法检测其细胞活力以确定HG损伤H9c2细胞的浓度,发现12、24、48 mmol/L的HG能浓度依赖性地降低H9c2细胞活力。接着,通过运用hoechst 33258染色观察了12、24、48 mmol/ L HG作用下H9c2细胞细胞核的变化,发现HG能明显诱导H9c2细胞凋亡形态改变;Western Blot法检测了12、24、48 mmol/L HG作用下的促凋亡蛋白变化,结果发现随着HG浓度的增加,Bax蛋白的表达也增加,表明HG可诱导H9c2细胞凋亡。该实验结果与多个实验室所做的结果一致[4-5]。
自噬在1963年由Christian De Duve首次被发现,是一个溶酶体介导的受损蛋白质和细胞器转换的“管家”亚细胞过程[6]。许多组织和器官都被发现了自噬的特殊功能。在心血管系统中,自噬对心脏和血管动态平衡和功能起着至关重要的作用。Nakai等[7]用选择性敲除自噬蛋白的小鼠证明了自噬在正常心脏维持和功能中的作用,越来越多的研究发现在多种心血管疾病中自噬异常。但目前尚不清楚自噬是否参与了HG诱导的H9c2细胞凋亡。因此,本研究检测了H9c2细胞在HG损伤后自噬相关蛋白的表达,发现12、24、48 mmol/ L的HG处理24 h能降低自噬早期标志蛋白Beclin-1的表达,同时明显上调P62蛋白的表达。在自噬启动阶段需要Beclin-1发挥作用,而在自噬过程中P62被不断的消耗,该结果表明HG诱导了H9c2细胞自噬障碍。
尽管有文献提及自噬有可能是促进细胞凋亡的重要机制,但尚未充分阐明。本研究用了自噬诱导剂雷帕霉素,观察其能否减轻HG对H9c2细胞凋亡的诱导作用,以明确自噬在HG诱导H9c2细胞凋亡过程中的介导作用。结果发现,使用雷帕霉素能逆转HG诱导的hoechst 33258染色阳性细胞数目的增加和Bax蛋白表达增加,而单独给予雷帕霉素无显著影响,表明自噬参与了HG诱导的H9c2细胞凋亡。文献报道的用雷帕霉素靶来增加自噬可以有效防止衰老性心肌病的发生与本研究发现一致,进一步证明本研究的可靠性[8-9]。
