AngⅡ通过激活Notch1/Sox2通路对肝星状细胞LX2的活化和增殖的作用
2018-10-22郑伟常虎林海军宋晓雪杜立学
郑伟 常虎林 海军 宋晓雪 杜立学
作者单位:710068 西安,陕西省人民医院肝胆外科
肝纤维化是指由各种因素所致肝内结缔组织异常增生,病因和发病机制不清,肝纤维化是肝硬化的前期病变,肝纤维化可发展成为肝硬化,肝硬化往往因引起并发症而死亡,上消化道出血为肝硬化最常见的并发症,而肝性脑病是肝硬化最常见的死亡原因[1]。逆转肝纤维化可阻止大多数慢性肝病进展[2]。肝星状细胞是肝内一种具有多功能、变化不定的非实质细胞[3]。研究表明,肝星状细胞活化和增生是肝纤维化发生的中心环节[4]。血管紧张素Ⅱ(AngⅡ)是调节水盐代谢及血压的激素,是肾素-血管紧张素系统的主要活性物质[5]。研究表明,AngⅡ与多种肿瘤的增殖和迁移密切相关,但其在肝星状细胞中的作用研究较少,分子机制不明确[6-7]。本研究探讨AngⅡ对肝星状细胞增殖和活化的影响及其作用机制。
材料与方法
一、实验材料
(一)实验试剂
人源肝星状细胞LX2细胞系(上海复祥生物科技有限公司),胎牛血清(杭州四季青),AngⅡ(上海源叶生物科技有限公司),RPMI 1640细胞培养基(美国Gibico公司),胰酶、Lipofectamine 2000(美国thermofisher公司),羟脯氨酸检测试剂盒-消化法(南京建成生物工程研究所),siRNA-Notch1及其对照物siRNA-NC(广州锐博生物科技有限公司),CCK8检测试剂盒(碧云天生物技术公司),Notch1,Sox2 Rabbit mAb(美国CST公司)。
二、实验方法
(一)细胞培养与细胞转染
人肝星状细胞LX2细胞用含有10﹪胎牛血清的RPMI 1640培养基培养,于37 ℃、5﹪ CO2培养,每2天换1次培养基,细胞汇合至80﹪以上传代培养。
转染前1天,6孔板接种LX2细胞,用不含抗生素的培养基培养。待细胞密度达到70﹪ ~80﹪时,按照Lipofectamine 2000操作说明进行细胞转染,Notch1的siRNA靶向序列为,5'-GATCCTGGCGGGAAGTGTGAAGCGT-3',对照组NC的siRNA靶向序列为5'-AGACGCTTCACACTTCCCGCCATTA-3',加 入转染试剂和siRNA混合物,6 h后去除培养基,加入含10﹪胎牛血清的RPMI 1640培养基。37 ℃、5﹪CO2正常培养后用于后续检测实验。
(二)CCK8法检测细胞增殖
取处理后的人肝星状细胞LX2,0.25﹪胰酶消化离心,调整细胞浓度为2×104个/ml,均以100 μl/ 孔种植于 96 孔板中,37 ℃、5 ﹪ CO2培养箱中培养,24 h 后加入不同终浓度(0、5、10、20、40、80 nmol/L)的AngⅡ,每组设置3个复孔,置于培养箱中分别继续培养24 h后,每孔加入10 μl CCK8溶液培养2 h,于450 nm下测定各孔吸光值(A450),并绘制CCK8曲线图。
(三)羟脯氨酸法检测胶原合成
收集细胞培养液,按照羟脯氨酸检测试剂盒说明书(消化法)进行检测。取细胞培养液0.25 ml(或标准应用液),加入0.05 ml消化液,37 ℃水浴3 h进行酶解,再加入0.5 ml试剂一,混匀后室温静置10 min,加入0.5 ml试剂二,混匀后静置5 min,加入1 ml试剂三,60 ℃水浴 15 min,用双蒸水调零,于550 nm处测定吸光值,计算羟脯氨酸含量。
(四)Western Blot检测蛋白表达
培养转染后的人肝星状细胞LX2,处理后加入蛋白裂解液收集细胞蛋白样品,定量后取等量蛋白样品进行 SDS-PAGE电泳分离、转膜,5﹪脱脂奶粉封闭 1 h,加入(1 : 500)稀释的一抗(Notch1,Sox2,Oct4,GAPDH),室温孵育1 h。洗涤后加入HRP标记的二抗,室温孵育1 h,洗涤后加入化学发光液显色,成像拍照,蛋白相对表达量采用软件Image J进行灰度值统计。
三、统计学分析方法
采用SPSS 17.0软件进行分析,CCK8、羟脯氨酸检测结果和Western Blot结果采用表示。CCK8、羟脯氨酸检测结果和Western Blot结果数据中,多组间的比较采用单因素方差分析,两组间的比较采用独立t检验,以P< 0.05为差异有统计学意义。
结 果
一、AngⅡ促进肝星状细胞LX2增殖
CCK8结果显示,AngⅡ能促进肝星状细胞的增殖,其A450值分别为 0.67±0.06、0.88±0.07、0.98±0.07、1.08±0.07、1.23±0.07,增殖能力高于NC组0.57±0.05,差异具有统计学意义(F=45.76,P<0.01)。(表 1)
二、AngⅡ对LX2细胞胶原合成的影响
羟脯氨酸检查结果显示,AngⅡ(10、20、40 nmol/L)预处理能促进肝星状细胞胶原合 成,其羟脯氨酸浓度分别为(2.60±0.20)、(3.47±0.25)、(4.17±0.21)mg/L,羟脯氨酸浓度高于NC组(1.90±0.10)mg/L,差异具有统计学意义(F=75.18,P<0.0001)。这表明 AngⅡ能够促进LX2细胞胶原合成。(表2)
三、AngⅡ对LX2细胞Notch1蛋白表达的影响
进一步检测AngⅡ对LX2细胞Notch1蛋白表达的影响。Western Blot结果显示,AngⅡ10、20、40 nmol/L组Notch1蛋白表达水平分别为0.20±0.02、0.54±0.04、0.82±0.03,与正常对照组比较 0.11±0.02 升高(F= 400.50,P< 0.0001)。表明AngⅡ可以促进肝星状细胞Notch1蛋白的表达。(图1)
四、干扰Notch1抑制AngⅡ诱导的肝星状细胞增殖
上述研究表明,AngⅡ可剂量依赖性的促进肝星状细胞活力,因此进一步检测AngⅡ是否介导Notch1抑制肝星状细胞增殖。CCK8结果显示,siRNA-Notch1+AngⅡ组(10、20、40 nmol/L)A450值分别为 0.53 ± 0.06,0.83 ± 0.03,1.03 ± 0.03,与siRNA-NC+ Ang Ⅱ对照组(0.97±0.06,1.43±0.06,1.73±0.06)比较降低(P< 0.01)。表明 Ang Ⅱ可能是通过促进Notch1的表达促进肝星状细胞增殖。(表3)
五、干扰Notch1对AngⅡ的肝星状细胞蛋白表达的影响
AngⅡ 40 nmol/L处理 24 h后,AngⅡ组Notch1,HES1和Sox2蛋白表达水平分别为2.83±0.15、2.20±0.10和 1.17±0.06,分别与正常对照组 1.07±0.12、1.06±0.11和 0.57±0.06比较差异具有统计学意义(P< 0.05);Notch1敲低组(AngⅡ+siRNA-Notch1)Notch1,HES1 和 Sox2蛋白表达水平分别为 1.47±0.12、0.77±0.06和0.50±0.10,分别与AngⅡ组比较差异具有统计学意义(P< 0.05)(图2和表4)。这表明干扰Notch1可抑制AngⅡ诱导的Sox2蛋白表达,表明AngⅡ可能通过激活Notch1/Sox2信号轴促进细胞增殖。
表1 不同浓度AngⅡ处理后CCK8检测LX2细胞A450值比较(± s)
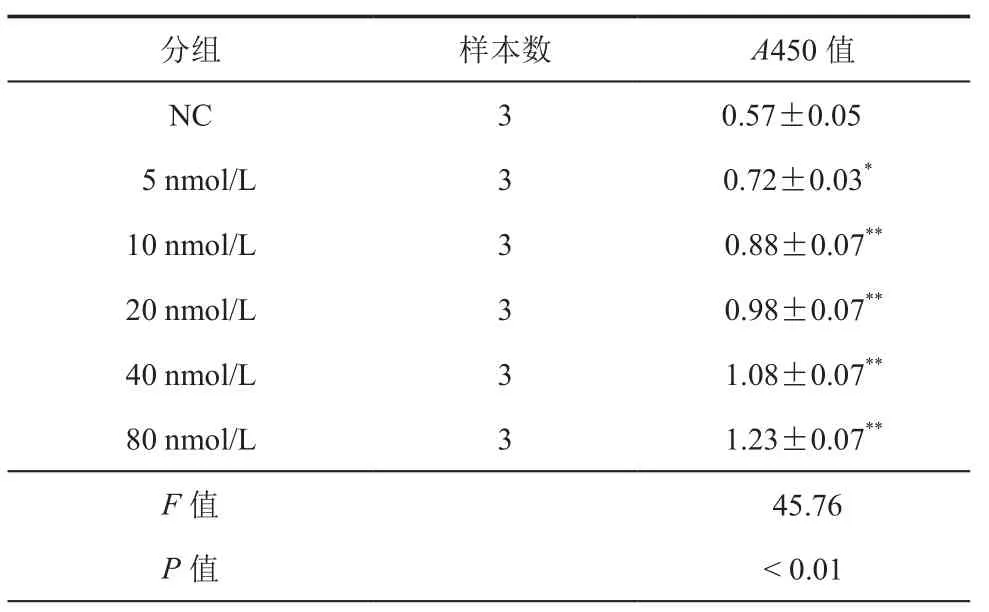
表1 不同浓度AngⅡ处理后CCK8检测LX2细胞A450值比较(± s)
注:与 NC 组比较,*P < 0.05,**P < 0.01
NC 3 0.57±0.05 5 nmol/L 3 0.72±0.03*10 nmol/L 3 0.88±0.07**20 nmol/L 3 0.98±0.07**40 nmol/L 3 1.08±0.07**80 nmol/L 3 1.23±0.07**F值 45.76 P值 < 0.01
表2 不同浓度AngⅡ处理后消化法检测LX2细胞羟脯氨酸浓度(mg/L,± s)
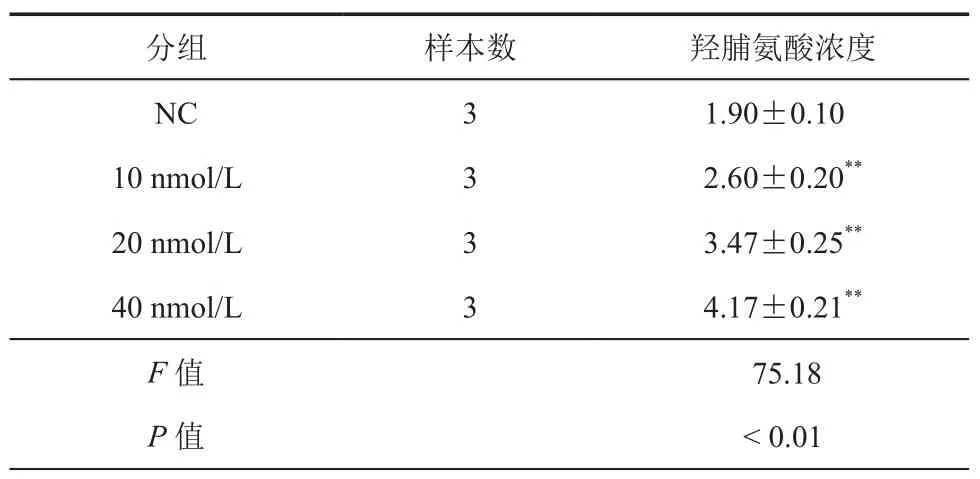
表2 不同浓度AngⅡ处理后消化法检测LX2细胞羟脯氨酸浓度(mg/L,± s)
注:与NC组比较,**P < 0.01
分组 样本数 羟脯氨酸浓度NC 3 1.90±0.10 10 nmol/L 3 2.60±0.20**20 nmol/L 3 3.47±0.25**40 nmol/L 3 4.17±0.21**F值 75.18 P值 < 0.01
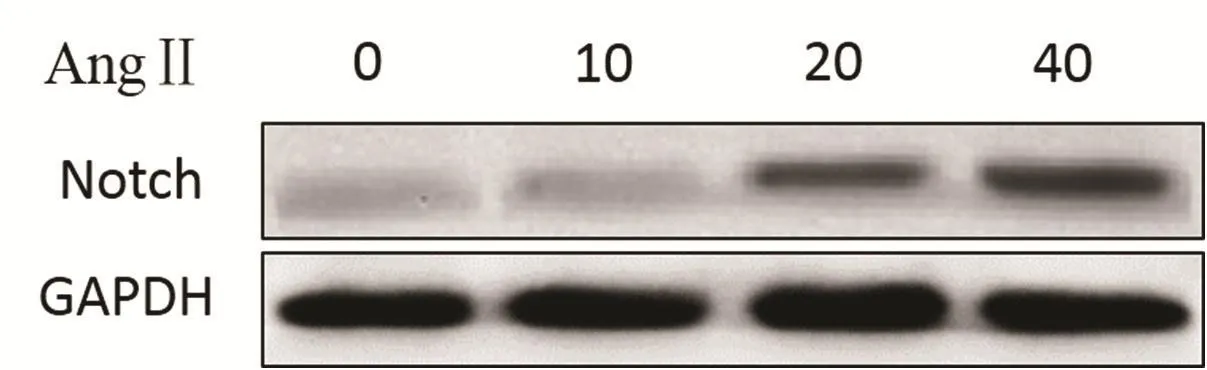
图1 AngⅡ对肝星状细胞胞Notch1蛋白表达的影响
表3 不同浓度AngⅡ诱导Notch1干扰前后的肝星状细胞增殖率A450的变化(nmol/L,± s)
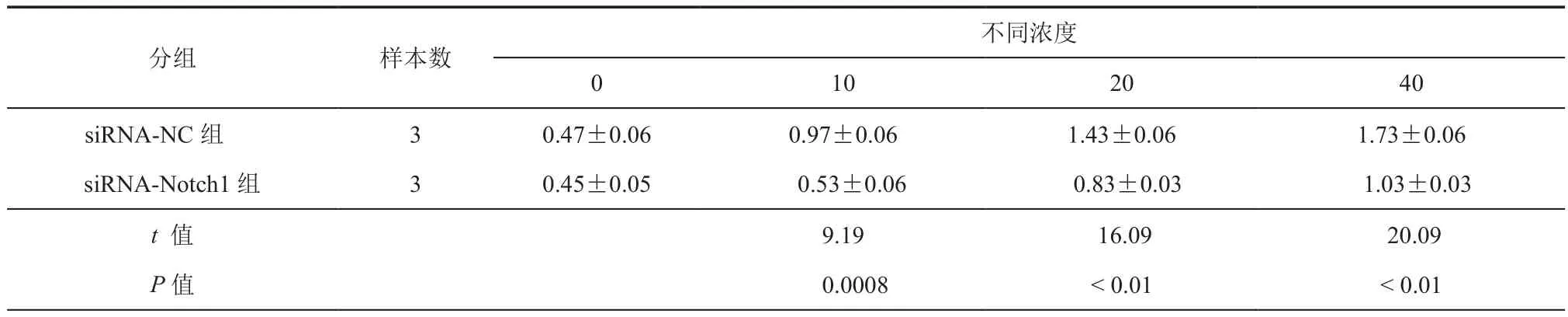
表3 不同浓度AngⅡ诱导Notch1干扰前后的肝星状细胞增殖率A450的变化(nmol/L,± s)
分组 样本数不同浓度0 10 20 40 siRNA-NC 组 3 0.47±0.06 0.97±0.06 1.43±0.06 1.73±0.06 siRNA-Notch1 组 3 0.45±0.05 0.53±0.06 0.83±0.03 1.03±0.03 t 值 9.19 16.09 20.09 P值 0.0008 < 0.01 < 0.01
表4 干扰Notch1AngⅡ诱导的肝星状细胞蛋白表达的变化( ± s)

表4 干扰Notch1AngⅡ诱导的肝星状细胞蛋白表达的变化( ± s)
注:与NC组比较,aP < 0.01;与AngⅡ组比较,bP < 0.01;Notch1相对表达量:Notch/GAPDH;HES1相对表达量:HES1/GAPDH;Sox2相对表达量:Sox2/GAPDH
分组 样本数 Notch1相对表达量 HES1相对表达量 Sox2相对表达量NC 组 3 1.07±0.12 1.06±0.11 0.57±0.06 Ang Ⅱ组 3 2.83±0.15a 2.20±0.10a 1.17±0.06a AngⅡ +siRNA-Notch1组 3 1.47±0.12b 0.77±0.06b 0.50±0.10b F值 154.5 192.9 72.8 P 值 < 0.01 < 0.01 < 0.01
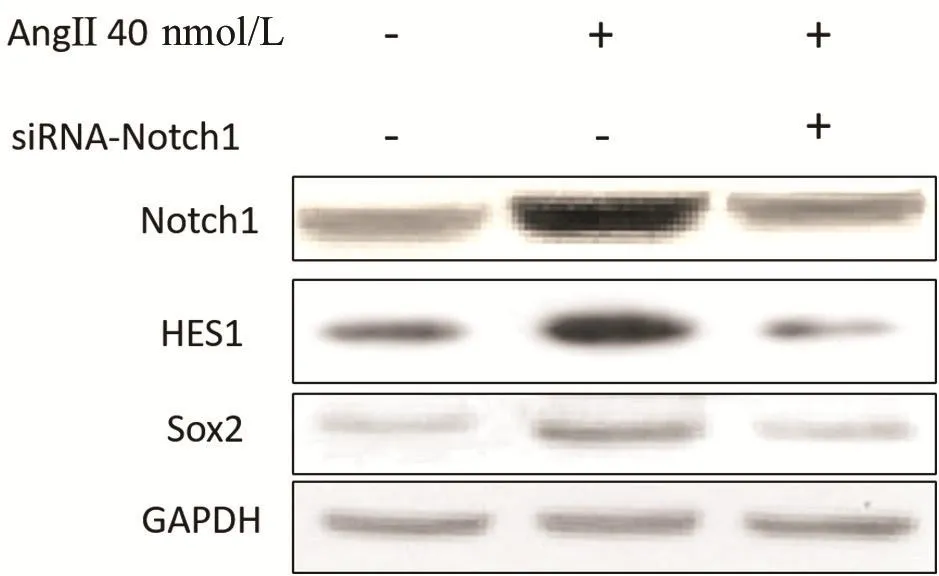
图2 干扰Notch1和AngⅡ对人肝星状细胞蛋白表达的影响
讨 论
肝星状细胞是肝脏特异性的间充质细胞,在肝脏生理和纤维发生中起着重要作用。它们位于Disse空间内并与窦状内皮细胞和肝上皮细胞保持密切的相互作用[8]。越来越多的研究表明肝星状细胞在肝发育和再生过程中对其他肝细胞类型的分化,增殖和形态发生有着深远的影响。研究表明,肝星状细胞的活化与肝癌的发生和转移以及肝纤维化的发生发展密切相关[9]。大量研究表明,减缓或阻止肝纤维化的发生和发展可预防肝硬化和肝癌的发生[10]。肝星状细胞是肝细胞外基质的主要来源,激活并转化为肌成纤维细胞样细胞,因此,肝星状细胞活化和增生是肝纤维化发生的关键环节[11]。本研究以人源性肝星状细胞LX2为细胞模型,研究肝纤维化发生发展的机制。
AngⅡ由血管紧张素Ⅰ在酶的作用下水解生成的激素,是肾素-血管紧张素系统的主要活性物质[12]。AngⅡ参与多种疾病的发生发展,成为筛选药物的重要靶点,对心血管、肝病等诊断和治疗有重要意义[13-14]。推测AngⅡ对肝星状细胞也具有显著的影响,基于该推论,通过CCK8检测了AngⅡ对肝星状细胞增殖的影响。结果显示AngⅡ能够促进肝星状细胞LX2细胞增殖,这与之前的研究结果一致,表明AngⅡ可能通过激活肝星状细胞促进肝纤维化的生成。
羟脯氨酸在胶原蛋白中占13.4﹪,在弹性蛋白中占极少量,其它蛋白中均不存在,因此羟脯氨酸的含量能反映细胞或者组织的胶原蛋白情况[15]。细胞分泌胶原量增加易导致细胞外基质大量沉积,导致纤维化疾病的发生[16]。大量研究表明,肝星状细胞分泌胶原含量的升高是肝纤维化发展的重要机制之一。检测了AngⅡ对肝星状细胞胶原合成的影响。结果显示AngⅡ能够促进肝星状细胞胶原合成,进一步提示AngⅡ可能参与肝纤维化的发生发展。
Notch信号转导通路由Notch受体、配体和结合蛋白三部分组成。Notch信号通路是一条影响细胞增殖和分化的一条重要信号转导通路,几乎涉及所有细胞的增殖和分化活动,在调节细胞分化、细胞干性及一系列生理、病理过程中都起重要作用[17]。众多研究发现Notch1信号具有促肿瘤作用,在肿瘤组织中的表达量比正常组织多[18]。SOX2(sex determining region Y-box 2)是一种转录因子SOX家族的成员,该蛋白质家族拥有高度保守的DNA结合结构域,含有大约80个氨基酸的HMG,对维持未分化胚胎干细胞的自我更新或多能性至关重要[19]。SOX2与癌症的发生发展相关,研究表明SOX2可能与结直肠癌和乳腺癌的发生发展相关[20]。本研究结果显示,AngⅡ在促进肝星状细胞增殖的过程中,Notch1的蛋白表达升高,而通过siRNA敲低Notch1的蛋白表达可以抑制AngⅡ诱导的肝星状细胞增殖,且抑制Sox2的蛋白表达水平。表明AngⅡ对肝星状细胞增殖的调控是通过调控Notch1/Sox2信号轴来实现的。
综上所述,本研究证实了Notch1是AngⅡ下游重要靶点之一,AngⅡ通过激活Notch1/Sox2信号轴促进人肝星状细胞增殖。AngⅡ是如何影响Notch1的表达及作用机制还需要进一步研究。本课题研究结果有助于了解AngⅡ和Notch1在肝纤维化中的作用,为肝纤维化的治疗提供理论依据和实验基础。
