乙醇诱导的柞蚕丝素蛋白多孔材料的研究
2018-10-15王心如邹盛之冯文庆张耀鹏张佳明邵惠丽
王心如, 邹盛之, 冯文庆, 张耀鹏, 张佳明, 邵惠丽
(1.东华大学 a.纤维材料改性国家重点实验室; b.材料科学与工程学院,上海 201620;2.复旦大学附属华山医院 老年科,上海 200040)
生物医用材料是一类与生命系统相作用,用以诊断、治疗、修复和替代人体病变或损伤的组织、器官,或增进其功能的材料[1]。目前,正在研究及已得到应用的生物医用材料很多,例如硅橡胶、胶原蛋白、甲壳胺、尼龙、聚酯等,它们各有其特点,但有些合成材料的生物相容性不足,有些天然材料则提纯比较困难,成本较高[1-2]。
相比之下,天然蚕丝是一种容易获得且价格相对便宜的生物材料,由于其具有优良的柔韧性、吸湿性、透气性和优雅的光泽而被人们熟知。蚕丝中含有生物相容性良好的丝素蛋白,而丝素蛋白自身及降解产物对细胞和机体无毒,不会或较少引起炎症和免疫排斥反应,从而使得蚕丝在生物医学领域的研究得到迅速发展。蚕丝可分为家蚕丝与野蚕丝两大类,家蚕丝主要指桑蚕丝,野蚕丝则包括柞蚕丝、天蚕丝、蓖麻蚕丝等,其中柞蚕丝在我国资源丰富、分布广阔。目前,中国柞蚕茧每年产量占世界总产量的90%左右[3]。近年来,人们对蚕丝丝素蛋白的研究逐渐转向分子水平。通过研究发现,柞蚕丝中的丝素蛋白(ASF)具备一般蚕丝丝素蛋白所不具备的优点,即ASF中含有大量的精氨酸-甘氨酸-天门冬氨酸(Arg-Gly-Asp,RGD)三肽序列,经证明该序列对细胞的黏附有利[4],因此,利用ASF制备的生物组织工程支架在医学领域中有较大的应用前景。
为了制备ASF多孔组织工程支架材料,冷冻干燥技术是一种环境友好、经济高效的成型方法。但研究发现,经冷冻干燥法直接得到的ASF材料是溶于水的,尚无法有效应用于生物医学领域。人们在对家蚕丝素蛋白(BSF)的研究中发现,采用某些方法可使丝素蛋白构象转变,从而使制备的材料不溶于水。其中,用乙醇处理是最简单和可靠的方法。目前,有些研究小组已报道了乙醇影响BSF构象的研究结果[5-7]。然而,国内外尚未见报道在溶液中直接加入乙醇诱导ASF成胶、再冷冻干燥制备ASF多孔材料。
为此,本研究以柞蚕丝为原料,采用乙醇促使ASF溶液快速凝胶并进一步冷冻干燥的方法制备ASF多孔材料,然后通过傅里叶变换红外光谱(FTIR)、扫描电子显微镜(SEM)探讨了乙醇水溶液浓度及ASF初始浓度对ASF样品结构的影响。采用激光扫描共聚焦显微镜(LSCM)对ASF多孔材料的生物相容性进行初探,本研究有望对制备性能优良的ASF组织工程支架材料提供一定的理论指导。
1 实 验
1.1 材 料
柞蚕丝,购自辽宁丹东(市售)。无水碳酸钠(Na2CO3)(分析纯,上海凌峰化学试剂有限公司),硫氰酸锂(LiSCN)(分析纯,西格玛奥德里奇有限公司),纤维素透析袋(截留相对分子质量为14 000±2 000)(上海源聚生物科技有限公司),无水乙醇(分析纯,江苏常熟市鸿盛精细化工有限公司),雪旺细胞(SCs细胞株)(中国科学院生物化学与细胞生物学研究所),鬼笔环肽(Alexa Fluor®568 phalloidin)(英杰生命科技有限公司),4’,6-二脒基-2-苯基吲哚(DAPI)(北京索莱宝科技有限公司)。
1.2 仪器与设备
MDF-192型超低温冰柜(日本SANYO公司),FD-1A-50型冷冻干燥机(北京博医康实验仪器有限公司),Nicolet 8700型傅里叶变换红外光谱(美国热电公司),JSM-5600LV型扫描电子显微镜(SEM)(日本电子株式会社),TCS SP5 Ⅱ型激光扫描共聚焦显微镜(德国徕卡公司)。
1.3 再生柞蚕丝素蛋白水溶液的制备
将柞蚕丝放入质量分数0.5%的Na2CO3水溶液中,浴比1︰50,在100 ℃下脱胶30 min,重复该过程3次,用去离子水充分洗涤,然后干燥获得脱胶丝。将脱胶丝以1︰10的浴比在50 ℃下溶解于9.0 mol/L的LiSCN水溶液中,经离心过滤后将滤液装入纤维素透析袋,在4 ℃下用去离子水透析后进一步浓缩形成初始质量分数分别为4%、6%、8%和10%的再生ASF水溶液,并将它们分别等体积置于不同的烧杯中待用。
1.4 再生柞蚕丝素蛋白多孔材料的制备
向上述各种质量分数的再生ASF水溶液中以1︰1的体积比分别加入70%、80%、90%和100%的乙醇水溶液或纯乙醇,将混合溶液于4 ℃下静置使其形成凝胶后,采用MDF-192型超低温冰柜在-50 ℃下对其进一步冷冻24 h,然后采用FD-1A-50型冷冻干燥机进行减压干燥,得到再生ASF多孔材料(简称ASF冻干样品)。
1.5 再生柞蚕丝素蛋白样品结构与性能的表征
采用Nicolet 8700型傅里叶变换红外光谱(FTIR)仪,通过ATR法对再生ASF凝胶及其冷冻干燥后样品的二级结构进行表征。测定波数范围为4 000~525 cm-1,分辨率为4 cm-1,扫描次数为32次。
上述样品的FTIR谱图的酰胺Ⅰ区(1 600~1 700 cm-1)中,各子峰与丝素蛋白二级结构的对应关系如下[8-10]:1 600~1 640 cm-1为β-折叠构象,1 640~1 660 cm-1为α-螺旋或无规线团构象,1 660~1 690 cm-1为β-转角构象。按文献[11]所述方法用Peakfit软件采用高斯函数对样品谱图进行曲线拟合,根据归一化后各子峰的积分面积计算ASF样品中对应的二级结构相对百分含量。
采用JSM-5600LV型扫描电子显微镜(SEM)在10 kV电压下对表面经喷金处理的ASF冻干样品的形态进行观察及拍照,并用图像处理软件(Nano Measurer)分析电镜照片中100个孔的尺寸,由此得到样品的平均孔径及孔径分布。
参考文献[12]方法,在再生ASF多孔材料(ASF水溶液初始质量分数为6%,乙醇诱导采用纯乙醇)上接种雪旺细胞(SCs),培养第4天后用鬼笔环肽和4’,6-二脒基-2-苯基吲哚(DAPI)染色,使用激光扫描共聚焦显微镜观察接种在多孔材料上的细胞形貌。
2 结果与分析
2.1 乙醇诱导柞蚕丝素蛋白结构转变的二级结构分析
ASF分子的二级结构主要包括β-折叠构象、α-螺旋构象和无规线团构象,另外还有部分的中间态构象(即β-转角构象)[13-14]。图1是不同ASF样品的FTIR图谱。其中,图1(a)为天然柞蚕丝经脱胶后的样品结果,从图中可以发现,脱胶柞蚕丝在1 625 cm-1(酰胺Ⅰ)、1 520 cm-1(酰胺Ⅱ)、1 237 cm-1(酰胺Ⅲ)、962 cm-1(酰胺Ⅳ)和700 cm-1(酰胺Ⅴ)处的吸收峰均属于丝素蛋白β-折叠构象[15-16],621 cm-1(酰胺Ⅴ)处的吸收峰则属于α-螺旋构象[17]。由此可见,脱胶柞蚕丝样品的二级结构以β-折叠构象为主。
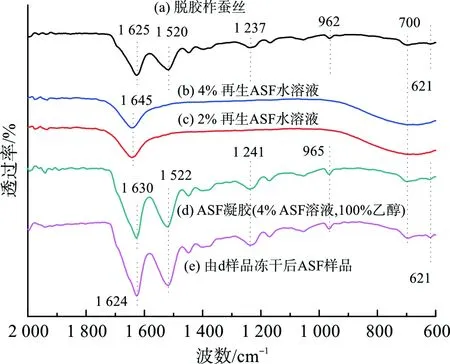
图1 不同ASF样品的FTIR图谱Fig.1 FTIR spectra of different ASF samples
图1(b)反映的是初始质量分数为4%的再生ASF水溶液的红外结果。考虑到乙醇处理过程是在其中以1︰1的体积比加入乙醇或乙醇水溶液,混合溶液中ASF的质量分数会下降至2%左右,为了便于比较分析,图1(c)进一步给出了2%再生ASF水溶液的FTIR结果。可以发现,图1(b)与图1(c)具有相同的出峰位置,其中1 645 cm-1(酰胺Ⅰ)处较尖锐的峰是丝素蛋白无规线团/α-螺旋构象所致[18-19],而700 cm-1(酰胺Ⅴ)处属于β-折叠构象的峰相对较弱。由此可见,与上述脱胶柞蚕丝相比,再生ASF水溶液中β-折叠构象要少得多。
图1(d)是乙醇诱导ASF水溶液所形成的凝胶的FTIR图谱,较明显看出,该谱图的吸收峰位置和脱胶柞蚕丝样品(图1(a))的红外吸收峰位置类似,1 630 cm-1(酰胺Ⅰ)、1 522 cm-1(酰胺Ⅱ)、1 241 cm-1(酰胺Ⅲ)、965 cm-1(酰胺Ⅳ)和700 cm-1(酰胺Ⅴ)处是丝素蛋白β-折叠构象的典型吸收峰,621 cm-1(酰胺Ⅴ)处为丝素蛋白α-螺旋构象的吸收峰。从红外光谱变化来看,乙醇诱导溶液成胶后,ASF凝胶的红外谱图(图1(d))出现了明显的β-折叠构象的吸收带。对图1(b~d)曲线的酰胺Ⅰ区按文献[8]提及方法进行分峰处理,可得到各样品中不同二级结构的含量,其中2%和4%再生ASF水溶液中的β-折叠构象含量分别仅为10.9%和13.0%,而添加乙醇后得到的凝胶中β-折叠构象的含量升至26.5%,这表明ASF溶液在乙醇的诱导作用下形成凝胶后,部分ASF分子由原来的α-螺旋/无规线团构象转变成了β-折叠构象。
图1(e)是上述ASF凝胶冷冻干燥后样品的FTIR图谱。由图1(e)可知,该样品红外光谱的出峰位置和图1(d)基本一致,但酰胺Ⅰ区属于β-折叠构象的吸收带略往低波数方向移动至1 624 cm-1处。据文献[20]报道,酰胺Ⅰ区(1 600~1 700 cm-1)的产生主要由C—O伸缩振动贡献,且易受到氢键效应的影响。氢键的产生会引起伸缩振动频率向低波数方向偏移,由此说明了ASF凝胶冷冻干燥得到的ASF样品中含有更多的氢键。定量分析结果显示,ASF冻干样品中β-折叠构象含量也更高,这可能是因为在ASF凝胶冷冻干燥过程中,冰晶会对丝素蛋白产生类似剪切的作用而诱导丝素蛋白由α-螺旋/无规线团构象向β-折叠构象转变[21-22],使得ASF样品中形成更多的分子间氢键。因此,与ASF凝胶相比,ASF冻干样品在酰胺Ⅰ区的吸收带略往低波数方向移动(更接近于脱胶柞蚕丝)。
2.2 乙醇水溶液浓度对ASF凝胶及其冻干样品二级结构的影响
根据本研究中FTIR测试结果并结合文献[23-25],一方面,在ASF水溶液中加入乙醇会使乙醇分子更多地与水分子结合,破坏水分子与丝素蛋白分子的结合,从而使得丝素蛋白分子之间的相互作用增强,导致丝素蛋白分子间形成更多的氢键,生成更多β-折叠构象。另一方面,ASF富含聚丙氨酸序列,该序列表现出很强的疏水性。而乙醇分子中的乙基与ASF中丙氨酸链段的结构较为相似,推测能与其相似相溶,故在ASF水溶液中加入乙醇后,丝素蛋白的疏水基团与乙醇分子的相互作用逐渐增强,削弱了丝素蛋白分子在疏水区域之间的相互作用,促进了这些疏水链段的活动,从而导致丝素蛋白从高能量的无规线团/α-螺旋构象转变为低能量的β-折叠构象。当β-折叠构象的含量增加到某个临界值时,ASF水溶液中就出现了不溶物,随着不溶物尺寸和数目不断增多,体系的流动性逐渐变差,最终形成凝胶。
研究表明,在正常情况下ASF凝胶过程十分缓慢,将低质量分数(如4%或2%)的ASF水溶液置于4 ℃的温度下,经过两周仍无凝胶现象产生。而在与一定量的乙醇作用后,即有部分丝素蛋白变性成白色絮状物,这些白色絮状丝素蛋白就是前述的不溶物。当水溶液中ASF含量一定时,随着乙醇浓度的提高,溶液中出现的白色絮状物增多,凝胶过程也大幅加速。当乙醇浓度仅为70%时,体系完全形成凝胶的时间需20 h以上;当乙醇浓度上升至80%及90%时,溶液中出现白色絮状物的速度加快,且凝胶时间分别缩短至7 h和5 h;而当乙醇浓度达到100%时,溶液中很快出现白色絮状物,凝胶时间仅需3 h。
图2反映了乙醇水溶液浓度对ASF凝胶及其冻干样品二级结构的影响。在不同乙醇浓度下,ASF凝胶中β-折叠构象含量均比其进一步冷冻干燥后的样品低,这再次佐证了上一节的相关结论。从图2中a曲线还可以看出,乙醇浓度的增加能使ASF凝胶中β-折叠构象的含量增多。这是因为溶液中乙醇浓度越高,有越多的乙醇分子会与水分子结合,从而破坏水分子与丝素蛋白分子结合,导致丝素蛋白分子之间的相互作用增强,这种情况下形成β-折叠构象的速度更快,凝胶中β-折叠构象的含量相对更多。此外,乙醇浓度越高意味着有更多的乙醇分子会与丝素蛋白的疏水基团发生相互作用,使得疏水链段的活动能力加快,从而导致更多的无规线团/α-螺旋构象转变为β-折叠构象。
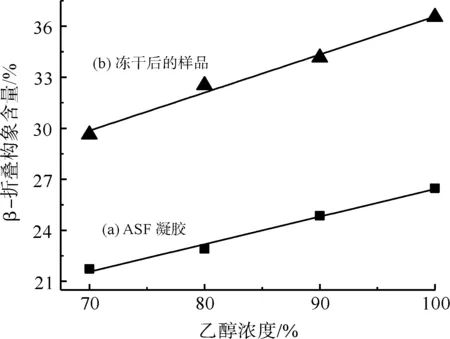
图2 乙醇水溶液浓度对ASF凝胶及其进一步冻干后样品的二级结构的影响Fig.2 Effect of ethanol concentration on the secondary structure of ASF gel and freeze-dried ASF samples
从图2中b曲线进一步可以看出,ASF凝胶冷冻干燥后的样品也有类似的结果,当乙醇水溶液浓度从70%上升至100%时,ASF冻干样品中β-折叠构象的含量从29.6%增加至36.5%。由此可见,提高乙醇诱导过程中采用的乙醇水溶液浓度,将促进冷冻干燥法ASF材料中β-折叠构象的形成。
2.3 ASF初始质量分数对ASF凝胶及其冻干样品二级结构的影响
图3反映了ASF初始质量分数对ASF凝胶及其进一步冻干后样品二级结构的影响,可以发现,当ASF初始质量分数从4%上升至10%时,ASF凝胶中的β-折叠构象含量(图3(a))从26.5%提高到33.0%,而α-螺旋/无规线团构象含量则从54.7%降至43.9%,这说明ASF初始质量分数的增加有利于凝胶中β-折叠构象的形成。ASF初始质量分数越高,越能减少丝素蛋白分子与水分子结合的几率,使得丝素蛋白分子链相互碰撞的机会更大,丝素蛋白分子之间的相互作用也更强。
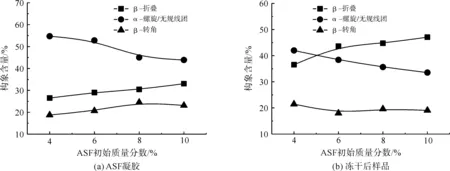
图3 ASF初始质量分数对ASF凝胶及其进一步冻干后样品二级结构的影响Fig.3 Effect of original ASF concentration on the secondary structure of ASF gel and freeze-dried ASF samples
随着丝素蛋白分子间相互作用的增强,ASF水溶液成胶的过程中形成β-折叠构象的速度将变快,从而导致β-折叠构象的含量更多。ASF初始质量分数对ASF凝胶进一步冻干后样品二级结构的影响也有类似的结果(图3(b)),当ASF初始质量分数从4%上升至10%时,ASF冻干样品中β-折叠构象的含量随之从36.5%提高至46.1%,而α-螺旋/无规线团构象的含量则从42.0%降至33.5%。由此可见,ASF水溶液质量分数的适当提高,有利于冷冻干燥法ASF材料中丝素蛋白构象向β-折叠构象转变。
2.4 ASF初始质量分数与乙醇水溶液浓度对ASF冻干样品微观结构的影响
由前述可知,ASF凝胶中β-折叠构象含量已明显高于ASF水溶液,但仍不占主导地位,这导致凝胶结构不是非常稳定。因此,在对ASF样品进行形态结构分析时,主要采用由凝胶进一步冷冻干燥处理后的样品。图4为由不同初始质量分数的ASF水溶液制得的ASF冻干样品横截面的SEM照及对应的孔径分布结果,从中可以看出,ASF水溶液初始质量分数为4%时,样品截面中空隙形态大体呈无规则(故无法分析其孔径分布,图4(a)中无所对应的孔径分布图),这可能是由于ASF质量分数较低使得材料强度不高,导致制样及测试中材料形态易被破坏。而当溶液中ASF含量逐渐增大时,样品截面的形态也变得更有规则,逐渐呈现孔状结构。从图4(b~d)右侧所对应的各样品孔径分析结果可以进一步发现,ASF水溶液的初始质量分数从6%上升至10%时,样品的平均孔径从30.4 μm减小至18.8 μm。这可能是因为溶液中ASF含量较高时,冷冻过程中ASF分子对水分子运动的阻力较大,不利于形成大的冰晶,故所制得的ASF多孔材料的孔径相对较小。
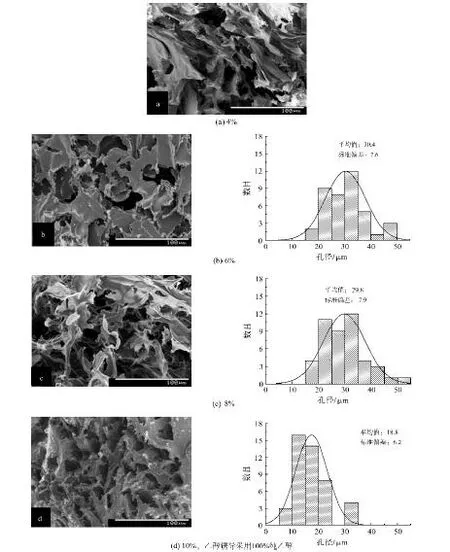
图4 由不同质量分数的ASF水溶液制得的ASF冻干样品横截面的SEM照片及对应的孔径分布Fig.4 SEM images and pore size distribution histograms of freeze-dried ASF samples prepared from ASF aqueous solution with different concentrations
图5进一步给出了采用不同浓度的乙醇水溶液诱导制得的ASF冻干样品横截面的SEM照片。由图5可知,随乙醇水溶液浓度的增加,ASF样品的平均孔径呈一定的上升趋势。由文献[26-27]可知,孔径在10~20 μm的微小孔洞能基本满足细胞黏附及生长因子、营养物质通过的要求,孔径介于20~100 μm的多孔材料在动物表皮细胞培养及载入生长因子方面具有一定的应用前景[28],而更大孔洞则有利于细胞生长[29]。因此,为了验证所制备的ASF多孔材料能否满足细胞黏附、生长的需求,本研究进一步考察了其生物相容性。
2.5 再生柞蚕丝素蛋白多孔材料的生物相容性评价
选择ASF质量分数为6%、纯乙醇诱导作为优选条件来制备多孔材料。细胞在材料上的生长数目和形态可直观体现生物相容性。图6显示了SCs在ASF多孔材料和盖玻片材料上接种4 d后的激光扫描共聚焦显微镜图(采用鬼笔环肽和DAPI分别对细胞的骨架和细胞核进行染色)。从图6中可以看出,ASF多孔材料和盖玻片上的细胞生长形态很多是圆形,部分细胞出现了伪足。并且,相比于盖玻片,SCs在ASF多孔材料上生长得更为密集,细胞数目和伪足更多,这说明ASF多孔材料比盖玻片更能促进细胞的黏附和生长。因此,本研究所制备的ASF多孔材料可作为组织工程支架应用在生物医疗领域,并具有较大的潜在价值。
3 结 论
本研究以柞蚕丝为原料,采用乙醇促使ASF水溶液快速凝胶并进一步冷冻干燥的方法,制备了ASF多孔材料,得到以下结论:
1)乙醇能诱导ASF水溶液形成凝胶,且形成凝胶的过程中伴随有大量β-折叠构象的产生。
2)随乙醇水溶液浓度的升高及ASF水溶液初始质量分数的增加,凝胶中β-折叠含量也相应上升。
3)提高乙醇水溶液浓度或适当降低ASF水溶液初始质量分数,有利于获得孔径较大的冷冻干燥法ASF多孔材料。
4)细胞实验结果表明,本研究所制备的ASF多孔材料可作为组织工程支架应用在生物医用领域,并具有较大的潜在价值。
