小续命汤对急性脑缺血再灌注线粒体相关蛋白Hsp60、Mitofilin表达的影响
2018-10-10兰瑞张勇马云枝吴涛郑海忠古春青李亚娜武继涛
兰瑞,张勇,马云枝,吴涛,郑海忠,古春青,李亚娜,武继涛
1.河南中医药大学第一附属医院,河南 郑州 450004
2.郑州大学第三附属医院,河南 郑州 450052
3.河南中医药大学,河南 郑州 450008
脑卒中是一组突然起病,以局灶性神经功能缺失为特征的急性脑血管病,好发于中年人,是威胁人类生命和致残的重要因素之一,缺血性脑卒中约占脑卒中的60%~80%[1~2]。因其高致残率、高病死率,一直是研究热点。中医学为中风的诊疗积累了丰富的治疗经验。小续命汤来源于唐代名医孙思邈的《备急千金要方》,临床应用治疗中风效果显著[3~5],本课题组在前期研究的基础上,建立脑缺血再灌注损伤大鼠模型,观察小续命汤对急性脑缺血再灌注损伤后皮层缺血半暗带线粒体相关蛋白的表达,以期为小续命汤的临床应用提供理论依据。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠60只,体质量250~280 g,购自河南省实验动物中心,实验动物许可证号:SCXK(豫)2017-0001。
1.2 小续命汤药物制备 中药材统一采购于河南中医药大学第一附属医院门诊中药房。小续命汤中麻黄、桂枝、芍药、川芎、黄芩、杏仁、附子、甘草、人参、防己、防风、生姜以1∶1∶1∶1∶1∶1∶1∶1∶1∶1∶1.5∶5 的比例配药,将中药材水浸1 h后,用10倍体积水煎1 h,滤取上清,再加10倍体积水煎1 h,重复3次。合并3次所得药汁并浓缩至100%浓度,冷却后加入无水乙醇使其达到总体积的75%,磁力搅拌过夜,25000×g离心20 min后取上清。药渣收集后用75%乙醇浸泡,过滤后收集上清,与离心所得的上清合并,恒温蒸发尽酒精,用蒸馏水调药物浓度至1 g/mL[6~8]。
1.3 主要试剂及仪器 兔抗Hsp60抗体购自Cell Signal Signal公司,货号12165S,兔抗Mitofilin抗体购自Abcam公司,货号ab48139,羊抗兔IgG二抗购自杭州华安生物技术有限公司,货号HA1001。环孢素A、通用SP检测试剂盒购自Solarbio,货号分别为SC5120、SP0041。凝胶配置试剂盒、ECL显色试剂盒购自西安晶彩生物科技有限公司,货号分别为JC-PE022,JC-PC001。电子天平(启东友铭衡量有限公司),系列磁力搅拌器(河南爱博特科技发展有限公司),SSW型电热恒温水浴箱(上海博迅实业有限公司)。电泳仪、转膜仪、凝胶成像仪、PVDF膜均购自BIO-RAD,优普系列超纯水仪器(成都超纯科技有限公司),光学显微镜(日本尼康公司)。
1.4 模型的制作 10%水合氯醛(350 mg/kg)腹腔注射麻醉大鼠,常规皮肤消毒后,沿颈部中线偏左侧皮肤剪开,钝性分离肌肉,将颈外动脉远端结扎,近心端结扎备用后,结扎颈总动脉远心端,确保动脉夹完全夹闭颈内动脉,沿着颈外动脉远端结扎处剪断一V型小口,将1根3.0 mm尼龙丝线插入动脉后,沿小口彻底剪断颈外动脉。将颈外动脉残端沿着颈内动脉拉直,缓慢推进丝线至有阻力停止,离颈总动脉分叉处约19.5 mm结扎备线。动脉阻塞90 min后缓慢轻柔拉出丝线实现再灌注。假手术组步骤同上,仅进行动脉分离但不插入丝线。待大鼠苏醒后评估神经功能缺损,出现神经功能缺损症状视为模型制作成功。
1.5 动物分组及给药 本课题组前期研究发现小续命汤60 g/(kg·d)为治疗急性脑缺血再灌注损伤的最优剂量[6]。本研究将60只实验动物随机分为假手术(Sham)组,模型(IR)组,小续命汤(XXMD60)组,环孢素A(CsA)组和溶媒(Vehicle)组。用乙醇溶解阳性药环孢菌素A,按照配制环孢素A的剂量比配制相应的溶剂。XXMD60组给予相应剂量的小续命汤,Sham组、IR组给予相应剂量的双蒸水,CsA组以10 mg/(kg·d)的CsA腹腔注射。Vehicle组每天以相应剂量的溶剂腹腔注射,持续至处死大鼠。所有的给药均在实验前3天开始连续进行灌胃直到研究设定的观察时间点。
1.6 观察指标
1.6.1 观察一般情况 研究期间观察并记录实验大鼠的毛色、活动、进食饮水,称量体质量。
1.6.2 测定神经行为学 依据Longa EZ等[9]介绍的方法,进行神经功能缺损的评估。0分:无神经功能缺损;1分:病灶对侧前爪不能完全伸展;2分:向病灶对侧自发性旋转;3分:向病灶对侧倾倒;4分:无自发性行走且出现意识丧失。
1.6.3 Nissl染色观察细胞缺血损伤 脑缺血再灌注24 h后,实验大鼠深度麻醉后,经心脏灌注生理盐水200 mL待右心耳流出液体清亮后,换4%多聚甲醛溶液匀速灌注300 mL。取出脑组织放置于4%多聚甲醛溶液后固定24 h,经梯度脱水,石蜡包埋,切片。脑组织石蜡切片58℃烤片2 h。经脱腊、水化后,将切片放入1%甲苯胺蓝染色液中,50℃染色30 min。PBS洗3次,各5 min。经脱水后中性树胶封片,自然晾干。光学显微镜下观察缺血皮层半暗带区观察缺血性损害,并拍片。
1.6.4 Western blot检测Hsp60、mitofilin蛋白的表达 取新鲜脑缺血半暗带皮层组织100 mg,剪碎放入1.5 mL离心管中,将1 mL RIPA加入离心管,放置快速研磨仪中研磨4 min后,冰上静置15 min,将蛋白溶液置于4℃ 13000 r/min离心15 min,取上清液。应用BCA法进行蛋白浓度检测。用10%~12%SDS聚丙烯酰胺凝胶进行电泳,蛋白分离后转移至PVDF膜。将PVDF膜放于封闭液,室温摇床上2 h,用5%BSA溶液将一抗稀释成合适的浓度后滴加至PVDF膜,4℃摇床上孵育过夜;次日TBST洗膜3次,每次10 min;将HRP标记的二抗用5%BSA溶液稀释为1∶2000滴加至PVDF膜,室温摇床上孵育2 h;TBST洗涤后用ECL化学发光试剂盒在凝胶成像分析系统显影,分析条带灰度值。
1.6.5 免疫组织化学染色检测Hsp60、mitofilin蛋白的定位表达 经烤片、脱腊、水化后,将片子插入柠檬酸修复溶液放置于微波炉进行修复抗原。PBS洗片,3%H2O2溶液滴加至切片上室温处理20 min。PBS洗片后,5%BSA封闭液滴加至组织上,室温封闭60 min。滴加相应稀释浓度的一抗4℃过夜,PBS洗3次,每次5 min。滴加合适稀释溶度的HRP标记抗兔二抗37℃孵育1 h。PBS洗3次,每次5 min。按照试剂盒说明书配制DAB显色试剂,混匀后滴加至切片,显微镜下观察显色情况,自来水洗15 min。苏木素复染5 min后,自来水洗15 min。1%盐酸酒精迅速分化。梯度脱水后,中性树胶封片,自然晾干。光学显微镜下观察缺血皮层半暗带阳性细胞并拍摄照片。
1.7 统计学方法 用SPSS19.0统计软件进行数据处理。计量资料以(±s)表示。统计学差异由单因素方差分析进行检验,方差齐性检验后用t检验和post hoc Fisher's检验分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况及神经功能缺损评分比较 见表1。造模前各组大鼠体质量、一般情况无差异。造模后,与Sham组比较,IR组大鼠毛发黄暗,活动能力显著下降,进食饮水困难,体质量均显著下降(P<0.05),均表现出明显的神经功能缺损(P<0.05);与IR组比较,Vehicle组无显著性差异;XXMD60组、CsA组大鼠毛发发黄,活动能力受限,进食饮水较正常,反应较迅速,神经功能缺损评分显著下降(P<0.05),体质量明显上升(P<0.05)。
表1 各组大鼠造模前后体质量及神经功能缺损评分比较(±s)
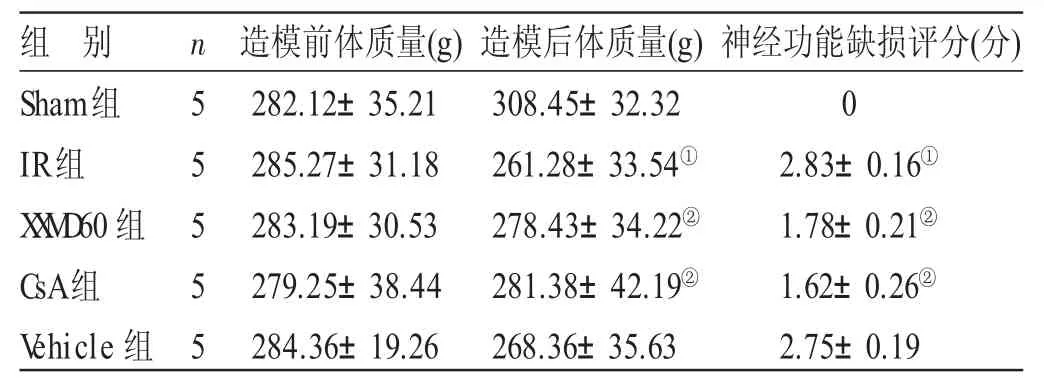
表1 各组大鼠造模前后体质量及神经功能缺损评分比较(±s)
与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组 别Sham组IR组X X M D60组CsA组V ehicle组n 5 5 5 5 5造模前体质量(g)282.12±35.21285.27±31.18283.19±30.53279.25±38.44284.36±19.26造模后体质量(g)308.45±32.32261.28±33.54①278.43±34.22②281.38±42.19②268.36±35.63神经功能缺损评分(分)02.83±0.16①1.78±0.21②1.62±0.26②2.75±0.19
2.2 各组大鼠大脑皮层缺血半暗带神经细胞结果比较 见图1、图2。Nissl染色结果显示,Sham组皮层神经元形态结构完整,数量多,排列有序,细胞形态清晰饱满,细胞核圆。IR组、Vehicle组则见缺血区大片淡染,缺血再灌注半暗带区神经细胞排列杂乱,细胞质体积小,严重呈空泡样变,细胞核呈皱锁深染色。XXMD60组、CsA组细胞排列较整齐,细胞形态较正常,细胞层数略少,细胞质较饱满,与IR组比较损伤明显减轻。
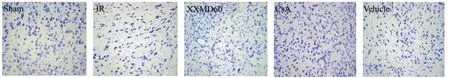
图1 各组大鼠大脑皮层缺血半暗带神经细胞损害结果 (×200)
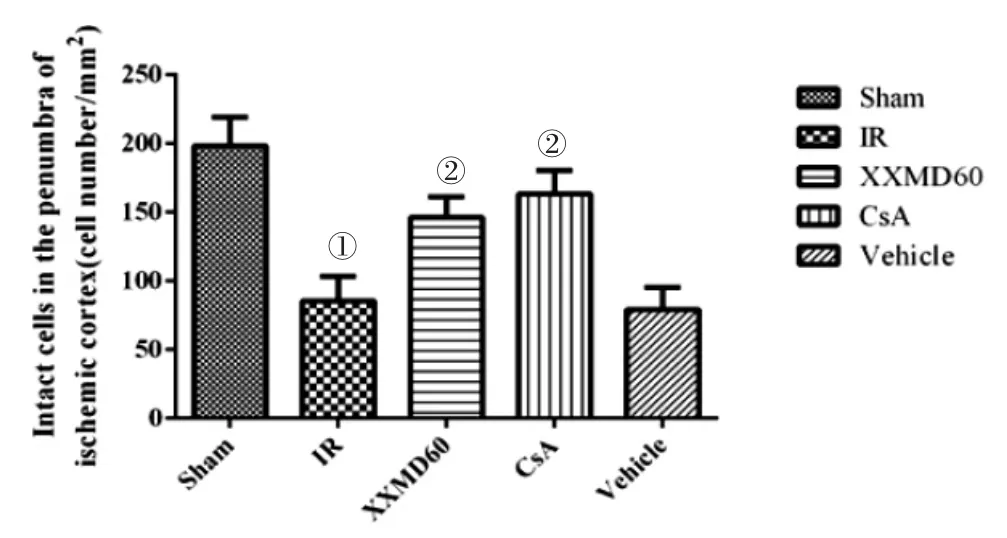
图2 各组大鼠大脑皮层缺血半暗带完整细胞数
2.3 各组大鼠大脑皮层缺血半暗带神经细胞Hsp60、mitofilin的表达和分布结果比较 见表2,图3~5。免疫组织化学染色结果显示,Sham组Hsp60、mitofilin的阳性细胞数较少。与Sham组比较,IR组、Vehicle组可见神经细胞呈缺血再灌注损伤表现,细胞皱缩,空泡改变,阳性细胞呈褐色,主要表达在胞浆,大脑皮层缺血半暗带神经细胞Hsp60、mitofilin的表达明显升高(P<0.05)。与IR组比较,XXMD60组、CsA组大鼠大脑皮层缺血半暗带区神经细胞缺血再灌注损伤较轻,细胞形态较为正常,两种蛋白阳性细胞数较IR组显著升高(P<0.05)。
图4~5结果显示,Sham组Hsp60、mitofilin两种蛋白的表达均较低,与Sham组比较,IR组、Vehicle组上述2种蛋白的表达均显著上调(P<0.05);与IR组比较,XXMD60组、CsA组上述两种蛋白表达均显著上调(P<0.05)。
3 讨论
脑缺血再灌注属于中医学中风范畴,中医理论认为中风多由风、火、痰、瘀等引起,导致脏腑阴阳失调、气血逆乱、直冲犯脑或脑脉闭阻而发病。临床上中风辩证分为中经络或中脏腑。中经络当祛邪活络为要,中脏腑则醒神开窍为先。中经络者发病特点为正气亏虚,气血不和,脉络空虚,风邪乘虚入中经络,气血痹阻,肌肤筋脉失于濡养,症见神志不清,半身不遂,肢麻胀痛,言语不利等症状,故以祛风活络为主。小续命汤首载于唐代名医孙思邈的《备急千金要方》,具有祛风通络,活血化瘀之功效。临床治疗中风辩证治疗中风患者收效良好,可减轻患者的神经功能缺损,改善生活质量[3~5]。本研究结果显示,小续命汤可显著降低脑缺血再灌注损伤大鼠神经能缺损评分,明显减轻神经细胞缺血性损伤及脑梗死体积形成,提示小续命汤对脑缺血再灌注损伤有神经保护作用。
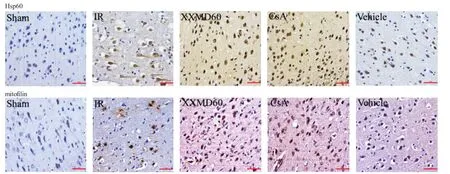
图3 各组大鼠大脑皮层缺血半暗带神经细胞Hsp60、mitofilin表达结果 (×200)
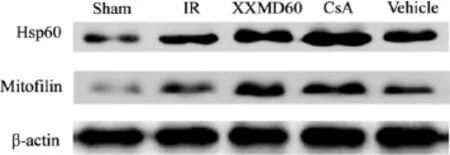
图4 各组大鼠大脑皮层缺血半暗带神经细胞Hsp60、Mitofilin蛋白表达情况
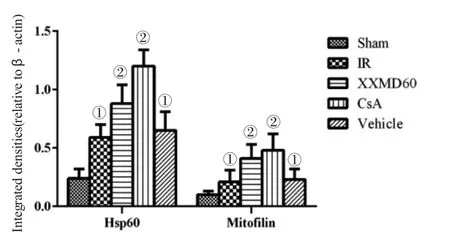
图5 各组大鼠大脑皮层缺血半暗带神经细胞Hsp60、Mitofilin蛋白定量表达
表2 各组大鼠大脑皮层缺血半暗带神经细胞Hsp60,mitofilin表达结果比较(±s) 个
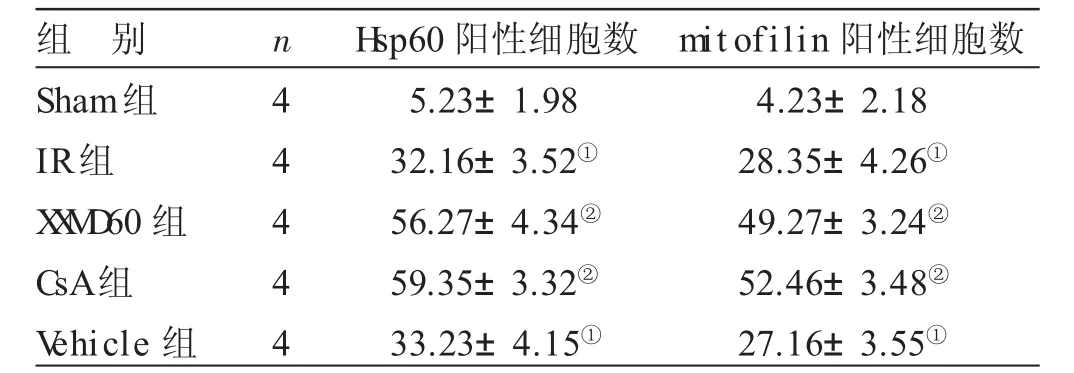
表2 各组大鼠大脑皮层缺血半暗带神经细胞Hsp60,mitofilin表达结果比较(±s) 个
与Sham组比较,①P<0.05;与IR组比较,②P<0.05
组 别Sham组IR组X X M D 60组CsA组V ehicle组n44444 H sp60阳性细胞数5.23±1.9832.16±3.52①56.27±4.34②59.35±3.32②33.23±4.15①mitofilin阳性细胞数4.23±2.1828.35±4.26①49.27±3.24②52.46±3.48②27.16±3.55①
脑缺血再灌注损伤根据血供减少的程度分为核心区和缺血半暗带,后者为挽救的关键部位。线粒体是极其关键的细胞器,为能量代谢、ATP生成、氧化磷酸化的重要场所,负责线粒体DNA复制、转录,线粒体蛋白翻译,钙存储、生产和清除氧化产物,隔离促凋亡蛋白维持细胞存活[10]。脑缺血再灌注可导致线粒体通透性转换孔开放,进而触发ATP过度消耗细胞坏死、凋亡等一系列的事件[11]。文献报道环孢素A可抑制线粒体通透性转换孔开放,减少线粒体损伤进而发挥神经保护作用[12~13],本研究设立环孢素A组作为阳性对照,关注缺血半暗带区线粒体蛋白,进一步探讨小续命汤对缺血半暗带区Hsp60、Mitofilin表达的影响。
Hsp60是一种重要的分子伴侣,主要存在真核细粒体基质中。研究发现Hsp60基因由粒线体中未折叠蛋白质的累积选择性诱导,诱导Hsp60表达可减少神经元的缺血性损伤[14~15]。本研究结果与报道一致,脑缺血可导致Hsp60的表达升高[15~16],与模型组比较,小续命汤、环孢素A能显著上调缺血半暗带Hsp60的表达,进而可能发挥神经保护作用。
Mitofilin是线粒体重要的内膜嵴形态维持蛋白,参与线粒体多项功能的调控,下调Mitofilin的表达影响线粒体功能,使得其受损,表现为可诱导细胞凋亡的发生,导致线粒体内膜结构紊乱,改变线粒体网格结构,降低线粒体呼吸链复合体V活性,减少活性线粒体数量及细胞ATP产量等[17]。还有研究者发现Mitofilin还与聚合酶I相互作用,促进PARP-1向线粒体定位,该蛋白的缺失会导致线粒体DNA损伤积累[18]。Mitofilin蛋白在脑缺血再灌注这一应激创伤后表达上调,而小续命汤与环孢素A治疗显著上调该蛋白的表达,从而可能抑制细胞凋亡发生。
综上,小续命汤干预诱导Hsp60、Mitofilin蛋白上调表达,保护神经细胞损伤,可能为小续命汤治疗脑缺血再灌注损伤的作用靶点。
