血府逐瘀胶囊对脑缺血再灌注大鼠一氧化氮合酶亚型表达的影响
2018-10-10王帅周迎松张晋
王帅,周迎松,张晋
1.宁波市第二医院,浙江 宁波 315000;2.宁波大学体育学院,浙江 宁波 315000
脑缺血性疾病(Ischemic cerebral vascular disease,ICVD)是较常见的脑血管疾病,我国患该病的人数也在逐年上升[1~2]。临床上,ICVD主要会引起原发的缺血性脑损伤和再灌注脑损伤。两种损伤机制会在不同时间和程度上导致患者脑组织出现功能障碍,尤其是脑缺血再灌注对脑细胞造成的损伤,逐渐受到临床医师的重视。脑缺血再灌注损伤是指对脑缺血患者采用医疗手段,对脑血管闭塞的脑组织进行再通后,导致的脑组织损伤现象[3]。脑缺血再灌注损伤主要出现于缺血性脑损伤的后期,引起一系列脑组织受损及神经系统病变。随着专家学者对脑缺血再灌注损伤机制的深入研究,人们发现细胞凋亡、炎症反应、自由基过度形成、细胞内钙超量和氨基酸的毒性作用等是引起该病的主要原因[4]。
一氧化氮合酶(NOS)是一种催化一氧化氮合成的酶,共分为神经元型一氧化氮合酶(nNOS)、内皮型一氧化氮合酶(eNOS)和诱导型一氧化氮合酶(iNOS)3种亚型[5]。eNOS与nNOS合称结构型一氧化氮合酶(cNOS),表达过程需要钙离子介导,iNOS则不需要。3种NOS亚型在脑缺血再灌注损伤发生时表达于不同的部位和时间[6]。NOS能够催化NO生成,从而引起脑组织内的氧化炎症级联反应,同时还可以改变血脑屏障通透性,从而加重神经损伤[7]。研究显示,nNOS大量表达于脑缺血损伤早期,损伤后期其表达量逐渐降低;iNOS大量表达于脑缺血损伤后期,在损伤早期极少甚至不表达;eNOS主要在再灌注早期表达,具有保护神经的作用[8~9]。本研究将探索血府逐瘀胶囊是否能够在脑缺血再灌注损伤时起脑保护作用,及3种NOS亚型的表达水平与其作用机制的关系。
1 材料与方法
1.1 实验动物及分组 165只雄性SPF级SD大鼠,鼠龄8~10周,体质量均在250~300 g之间,由上海南方模式动物中心提供,合格证号:SCXK(沪)2017-0016,在温度为20~25℃的单笼动物房中饲养,1周后进行实验。随机将165只大鼠分为模型组37只、假手术组21只和血府逐瘀胶囊低、中、高剂量预处理组(低剂量组、中剂量组、高剂量组)共107只。
1.2 主要试剂与仪器 抗体:兔抗鼠eNOS多克隆抗体、兔抗鼠nNOS多克隆抗体以及兔抗鼠iNOS多克隆抗体(北京博奥森公司),二甲苯(国药试剂),过氧化氢(天津化学试剂公司),多聚甲醛(上海化学试剂公司)、组织切片机(德国Leitz公司),OLYMPUS光学显微镜(Olympus公司)。
1.3 药品配置及给药方法 用生理盐水将血府逐瘀胶囊粉末配制为 0.1 g/(kg·d)、0.2 g/(kg·d)、0.5 g/(kg·d)的混悬液,以 55 kg为标准成人体重,低剂量组给药量为成人剂量的1倍,中剂量组给药量为成人剂量的3倍,高剂量组给药量为成人剂量的5倍。术前7 d按照低、中、高3种剂量对预处理组大鼠进行灌胃给药,10 mL/(kg·d);给予缺血再灌注组和假手术组大鼠同等剂量的生理盐水,并在最后1次给药2 h后制备大鼠脑缺血再灌注模型。
1.4 模型制备及评分 改良Longa法制备大鼠大脑中动脉阻断(MCAO)再灌注模型:将各组大鼠进行标记并做好术前准备;按照3 mL/kg的剂量使用水合氯醛(10%)对大鼠进行麻醉;大鼠取仰卧位,切开皮肤并分离出大鼠的右侧颈总动脉和颈外动脉以作挂线用,同时分离出大鼠的颈内动脉以便于后期插线使用;先用夹子关闭大鼠的颈内动脉,而后在颈总动脉的近心端进行结扎,同时结扎颈外动脉。随后沿着颈总动脉将拴线插入颈内动脉,深度自分叉部开始计算约18 mm,将拴线末端留长以便于抽出;拴线插入假手术组大鼠模型的深度约9 mm,此时暂不夹闭大脑中动脉,只在颈内动脉的近心端结扎,而后缝合切口;再灌注过程,需将鱼线向外抽出约10 mm,保持环境温度在25℃;等待大鼠苏醒,然后放回笼中继续饲养,以备后续实验使用。分别于缺血再灌注2、5、10、20、48 h等5个时间点处死大鼠并制作脑组织标本。
根据Longa EZ等[10]研究出的评分标准进行评分,开始评分时间为缺血2 h再灌注24 h后(0分:可正常活动,未出现明显的神经功能损伤症状;1分:出现轻微的神经功能损伤症状,即提起尾部时大鼠左前肢无法完全伸直;2分:出现神经功能损伤症状,即向左侧转圈爬行;3分:出现明显的神经功能损伤症状,即爬行时向左侧倾倒;4分:出现严重的神经功能损伤症状,即无法正常爬行甚至出现晕厥;5分:死亡),筛选出评分为1~3分的大鼠作为实验对象,剔除该过程中结果不符合要求和死亡的大鼠,并重新制备模型补充至相应组别,各组随机抽取7只大鼠检测各指标。
1.5 制备脑组织切片 大鼠脑缺血再灌注模型制备完成后,用10%水合氯醛(3 mL/kg)在各时间点将大鼠麻醉后打开胸腔,开始灌注,针头需从大鼠的左心室进入到升主动脉,将针头固定好,然后剪开大鼠的右心耳。用0.9%氯化钠对假手术组及缺血再灌注组模型进行灌注5 min(约150 mL)来排出大鼠体内的血液,当大鼠的肝脏开始发白并且其右心房流出无色液体时说明灌注完成。灌注试剂:用大约400 mL的浓度为4%、pH为7.4的多聚甲醛磷酸缓冲液对大鼠进行灌注,当大鼠的肝脏开始发硬并且全身肌肉僵硬时说明灌注完成。灌注完成后断头处死取出脑组织,并使用4%多聚甲醛固定24 h。将固定好的脑组织切片,厚度为2~3 cm,置于包埋盒内,先使用清洁自来水进行冲洗,而后按照50%乙醇4 h、70%乙醇4 h、80%乙醇12 h、95%乙醇1 h、95%乙醇1 h、无水乙醇1 h和无水乙醇30 min的梯度次序进行脱水。透明:先在二甲苯中放置20 min,再在二甲苯中放置10 min,使脑组织完全透明。将石蜡融化并过滤(60℃),按照浸蜡1 h后,再浸蜡30 min的顺序对脑组织进行处理。将脑组织放入金属包埋框内,加入石蜡液覆盖,将包埋盒轻轻放在上面,置于冷冻台进行冷却,冷却完成后将石蜡脑组织块进行标记。将石蜡脑组织块边缘修剪整齐,固定至载物台上,将切片装置厚度调整为4 μ m。用毛笔托起蜡带1端,用镊子将蜡带放入45℃水中,在水中用镊子将蜡带分开,充分展开脑组织,然后用经过多聚赖氨酸处理的载玻片将蜡带捞起,立即放入60℃的烤箱烤48 h备用。
1.6 免疫组织化学染色 实验开始前将所需要的石蜡切片放入65℃恒温干燥箱内干燥1~6 h。脱蜡:将干燥后的石蜡切片依次浸于二甲苯中2次,各10 min。梯度乙醇水化:将石蜡切片依次浸于100%酒精中2次,各10 min、95%酒精中2次各10 min、90%酒精中10 min、85%酒精中5 min。清洗:将石蜡切片依次置于事先配好的0.1 mol/L PBS磷酸缓冲液2次,各3 min。将石蜡切片浸于刚配好的3%的过氧化氢溶液中15 min以便去除内源性过氧化物酶,而后再依次浸于0.1 mol/L的PBS磷酸缓冲液中3次,各3 min。抗原修复:先将石蜡切片浸于pH为6.0的柠檬酸盐缓冲液中,然后将高压锅温度设置为270℃预热。水沸腾后,将带有石蜡切片的柠檬酸盐缓冲液一起放入高压锅,关严锅盖并继续加热,高压锅喷气后将温度重新设置为140℃,1.5 min后关闭电源,取出石蜡切片置于冷却台,使切片冷却至室温,而后将切片放入PBS磷酸缓冲液中清洗3次,各3 min。滴加均已被稀释为1∶400的兔抗鼠iNOS、eNOS和nNOS抗体(一抗),将切片放入湿盒,在4℃冰箱内过夜孵育。将湿盒取出并晾至室温,将石蜡切片依次置于PBS磷酸缓冲液中3次,各4 min。滴加经过标记(生物素)的兔PV-6001(二抗),37℃孵育40 min,取出后置于PBS磷酸缓冲液中清洗3次,各4 min。DAB显色:滴加DAB显色剂,将切片背景染为浅棕色(光镜下)即可停止显色,然后用清洁自来水水化20~30 min。使用苏木素对切片复染10 s并返蓝40 min。将切片放入梯度酒精进行脱水,再次使用二甲苯透明切片,最后用中性树胶对切片进行封片,置于显微镜下观察。对照组:只需使用PBS磷酸缓冲液来代替一抗进行免疫染色,作为阴性对照,其余步骤均相同。
1.7 统计学方法 使用SPSS23.0软件进行统计处理,计量资料用(±s)表示,组间比较用单因素方差分析法,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经学评分结果比较 见表1。假手术组大鼠在研究期间均未出现神经功能缺失的症状,与假手术组比较,模型组大鼠在24 h后出现明显的神经功能缺失症状(P<0.05);与模型组比较,低、中、高剂量组均出现神经功能缺失症状(P<0.05);与低剂量组比较,中、高剂量组大鼠的神经行为评分显著降低(P<0.05)。
表1 各组大鼠神经学评分结果比较(±s) 分
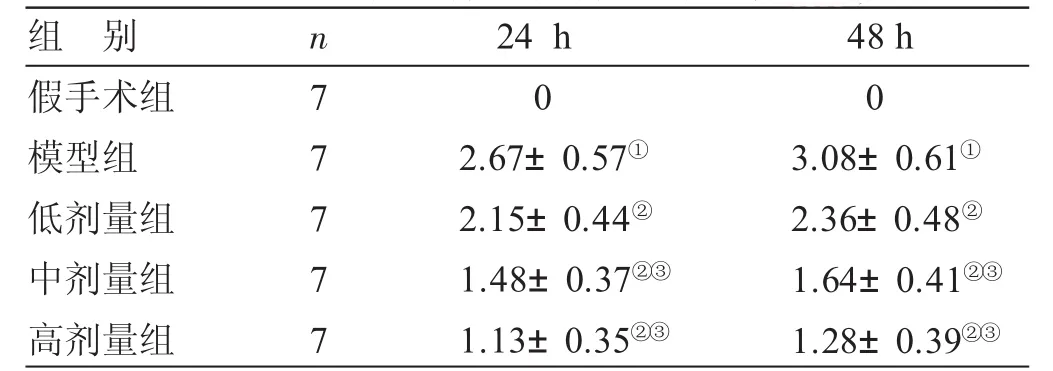
表1 各组大鼠神经学评分结果比较(±s) 分
与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与低剂量组比较,③P<0.05
组 别假手术组模型组低剂量组中剂量组高剂量组n7777724 h 02.67± 0.57①2.15± 0.44②1.48± 0.37②③1.13± 0.35②③48 h 03.08± 0.61①2.36± 0.48②1.64± 0.41②③1.28± 0.39②③
2.2 各组大鼠脑组织eNOS蛋白表达结果比较 见表2。与假手术组比较,模型组大鼠脑组织切片中各时间点eNOS阳性表达均显著增加(P<0.05),在脑缺血再灌注后10 h时达到最大值,相比于其他时间点,差异有统计学意义(P<0.05);与模型组比较,低、中、高剂量组大鼠eNOS的阳性表达均显著升高(P<0.05),其中在高剂量组大鼠eNOS阳性表达最高。
2.3 各组大鼠脑组织n NOS蛋白表达结果比较 见表3。与假手术组比较,模型组大鼠脑组织切片中各时间点nNOS阳性表达均显著减少(P<0.05),在脑缺血再灌注后的第10 h时达到最大值,相比于其他时间点差异有统计学意义(P<0.05);与模型组比较,低、中、高剂量组nNOS阳性表达均显著下降(P<0.05),其中高剂量组大鼠nNOS阳性表达最低。
表2 各组大鼠脑组织e N O S蛋白表达结果比较(±s) ppm
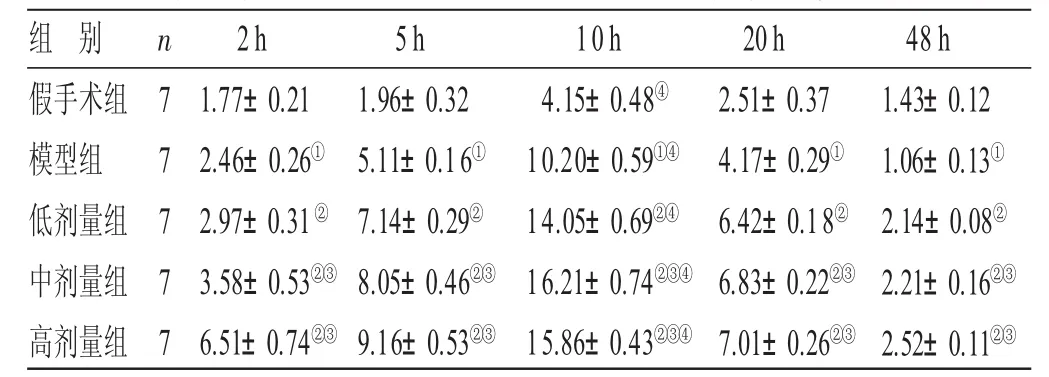
表2 各组大鼠脑组织e N O S蛋白表达结果比较(±s) ppm
与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与低剂量组比较,③P<0.05;与同组其他时间点比较,④P<0.05
组 别假手术组模型组低剂量组中剂量组高剂量组n 7 7 7 7 72h 1.77±0.212.46±0.26①2.97±0.31②3.58±0.53②③6.51±0.74②③5h 1.96±0.325.11±0.16①7.14±0.29②8.05±0.46②③9.16±0.53②③10h 4.15±0.48④10.20±0.59①④14.05±0.69②④16.21±0.74②③④15.86±0.43②③④20h 2.51±0.374.17±0.29①6.42±0.18②6.83±0.22②③7.01±0.26②③48 h 1.43±0.121.06±0.13①2.14±0.08②2.21±0.16②③2.52±0.11②③
表3 各组大鼠脑组织n N O S蛋白表达结果比较(±s) ppm
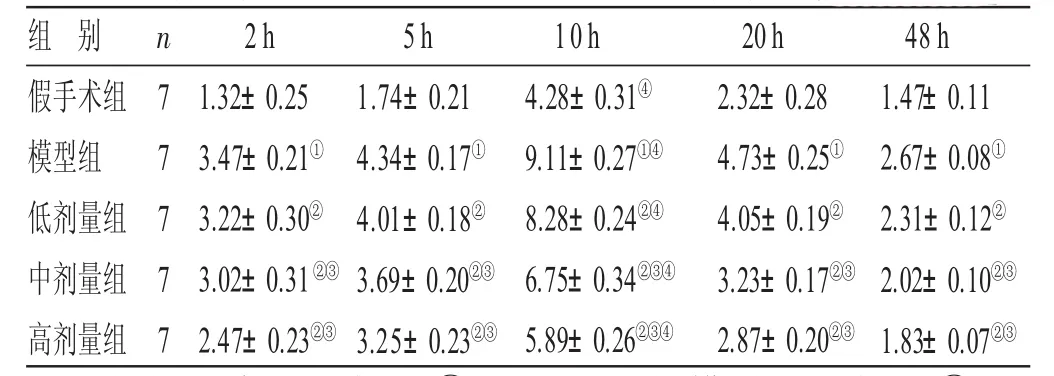
表3 各组大鼠脑组织n N O S蛋白表达结果比较(±s) ppm
与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与低剂量组比较,③P<0.05;与同组其他时间点比较,④P<0.05
组 别假手术组模型组低剂量组中剂量组高剂量组n 7 7 7 7 72h 1.32±0.253.47±0.21①3.22±0.30②3.02±0.31②③2.47±0.23②③5h 1.74±0.214.34±0.17①4.01±0.18②3.69±0.20②③3.25±0.23②③10h 4.28±0.31④9.11±0.27①④8.28±0.24②④6.75±0.34②③④5.89±0.26②③④20h 2.32±0.284.73±0.25①4.05±0.19②3.23±0.17②③2.87±0.20②③48 h 1.47±0.112.67±0.08①2.31±0.12②2.02±0.10②③1.83±0.07②③
2.4 各组大鼠脑组织iNOS蛋白表达结果比较 见表4。假手术组的大鼠脑组织未检测到iNOS阳性表达,模型组大鼠中检测iNOS阳性表达,且其表达水平随着缺血再灌注后时间的延长而逐渐升高;与模型组比较,低、中、高剂量组中iNOS阳性表达均显著下降(P<0.05),与低剂量组比较,中、高剂量组大鼠iNOS的表达较低(P<0.05)。
表4 各组大鼠脑组织iN O S蛋白表达结果比较(±s) ppm
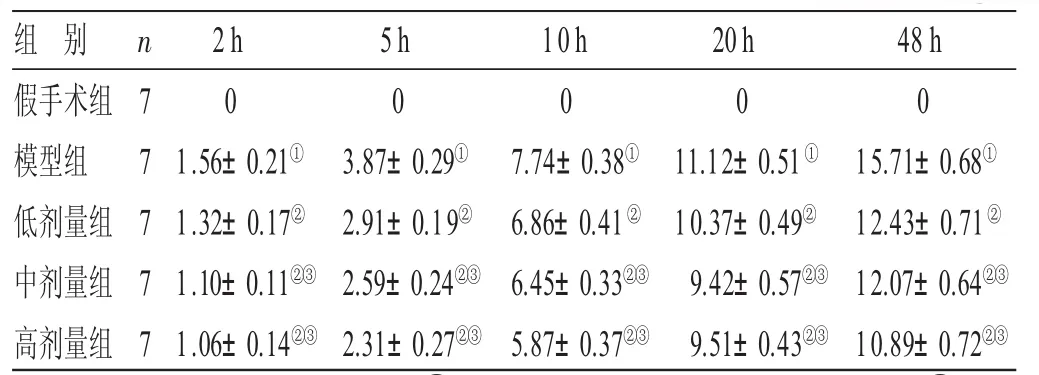
表4 各组大鼠脑组织iN O S蛋白表达结果比较(±s) ppm
与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与低剂量组比较,③P<0.05
组 别假手术组模型组低剂量组中剂量组高剂量组n 7 7 7 7 72h 01.56±0.21①1.32±0.17②1.10±0.11②③1.06±0.14②③5h 03.87±0.29①2.91±0.19②2.59±0.24②③2.31±0.27②③10h 07.74±0.38①6.86±0.41②6.45±0.33②③5.87±0.37②③20h 011.12±0.51①10.37±0.49②9.42±0.57②③9.51±0.43②③48 h 015.71±0.68①12.43±0.71②12.07±0.64②③10.89±0.72②③
3 讨论
ICVD在全球范围内的发病率逐渐升高,严重威胁着人类健康,人们也越来越重视对它的防治。脑组织发生缺血性损伤是由于脑组织血供减少引起微循环障碍,进而导致脑组织发生缺血缺氧性坏死。及时有效恢复脑部血供是治疗此病的关键,但同时会导致脑缺血后的再灌注损伤,进一步加重脑组织损伤。脑缺血再灌注损伤是指对脑缺血患者再灌注引起的病理事件,脑血管出现阻塞后的首发表现是脑组织发生缺血性损伤,经过治疗后血管再通,恢复脑组织血供,反而加重脑细胞损伤[11]。脑部的缺血症状虽然得到了改善,但却会加重脑细胞损伤程度,引起迟发型神经损伤,非常不利于患者预后[12]。脑缺血再灌注损伤的机制错综复杂、互相联系,共同影响着再灌注对脑组织的损伤。近年来,相关专家学者对其机制进行不断研究,发现NOS在脑缺血再灌注损伤过程中发挥着重要作用。但NOS具有多种亚型,表达于不同时间、部位,所以对脑组织的影响也不尽相同[9]。
NOS是一种催化NO生成的限速酶,正常情况下脑组织中的NO浓度处于较低的纳摩尔水平,但脑组织发生缺血性损伤后会激活NOS表达,进而使NO浓度升高达到微摩尔水平。目前人们研究出的NOS共有2类3型,一类cNOS,需要依靠钙离子才能表达,另一类是iNOS,不需要钙离子即可表达,并且只有在神经受损后才会表达[10]。由于不同亚型NOS的表达部位、规律均不相同,所以其在脑缺血性损伤过程中共有以下两方面作用:由eNOS介导的神经保护功能和早期由nNOS介导、晚期由iNOS介导的神经毒性功能。
血府逐瘀胶囊主要由当归、川芎、红花等组成,有行气活血化瘀的功效[13]。临床上常用于瘀血证的治疗,近年来也常用于脑中风的治疗。瘀血是造成缺血性中风的常见病因病机,瘀血阻滞,脉络不行,脑髓失养,进而加重病情,方中桃仁、红花、川芎、当归、赤芍活血祛瘀,当归、生地黄养血化瘀,柴胡、枳壳理气,牛膝活血通经,引血下行,桔梗载药上行,甘草调和诸药,共奏活血祛瘀、理气通络之功效,现代药理研究发现,本方具有扩张血管增加缺血器官血流量、抑制血栓形成、抗凝、抑制动脉硬化等作用[14]。本研究采用血府逐瘀胶囊对脑缺血再灌注大鼠模型进行预处理,发现其在保护脑缺血再灌注损伤过程中起着重要作用。预处理组各时间点的eNOS阳性表达均明显增加,尤其是高剂量组的增加最显著,因而我们可以推测血府逐瘀胶囊在脑缺血再灌注中,可能通过提高脑组织中eNOS的表达水平,起到神经保护的功能。同时血府逐瘀胶囊能够影响nNOS在再灌注损伤早期的表达,血府逐瘀胶囊的预处理能够降低nNOS在缺血再灌注损伤早期的表达。另外,nNOS在早期的神经损伤过程中起一定作用,所以降低其产生能够起到一定的脑细胞保护作用。血府逐瘀胶囊预处理组在各时间点iNOS染色阳性表达均明显降低,以高剂量组降低最为显著,表明血府逐瘀胶囊预处理能够降低脑组织损伤过程中iNOS的阳性表达,从而降低iNOS介导的迟发性神经损伤,与之前报道也较为一致[15]。
综上,在脑缺血再灌注损伤的病理生理过程中,3种NOS亚型在不同时期的表达发挥着重要作用;通过血府逐瘀胶囊的预处理,可影响NOS亚型在脑组织的表达,从而提示血府逐瘀胶囊可能是通过影响NOS亚型的表达来发挥对脑组织的保护功能。
