多钒硼氧簇化合物水热合成实验
2018-09-29孙瑞卿黄梦梦陈义平
孙瑞卿, 黄梦梦, 陈义平
(福州大学 化学学院, 福州 350116)
0 引 言
无机-有机杂化材料由于其独特的分子结构和多样性的电子结构,在催化、生物化学、药物及新材料领域具有广泛的应用前景,受到科研工作者的关注[1-5]。多钒硼氧簇化合物是杂化材料中金属氧簇化合物的一个重要分支。利用水热法[6-10]合成的多钒硼氧簇化合物,钒氧间的配位方式有VO4四面体、VO5四角方锥和VO6八面体等,硼氧间的配位方式有BO4四面体、BO3平面三角形等, 钒氧多面体(VOn)和硼氧多面体(BOn)间通过共顶点、共棱或共面的方式形成了结构丰富的多钒硼氧簇化合物。
相比于其他合成晶体的方法,水热法具有操作简单、反应时间自由、能够一步合成目标产物的优点,并且目标产物缺陷较少、形状规则。当然,水热法也存在一定的局限性,还没有形成稳定、通用的规律,可分析和利用的热力学数据不足;水热法有时无法按照设计方案获得预期的理想产物,还存在转化率低且杂质含量高的问题。
本文设计多种实验方案,探索不同条件下水热合成多钒硼氧簇化合物的特点,并利用X-射线单晶衍射法确定化合物的结构,利用红外光谱对化合物进行表征,探讨结构与性能的关系,从而总结出适合实验教学的多钒硼氧簇化合物水热合成实验过程。
1 实 验
1.1 化合物的合成
1.1.1[enH2]2[Mn(H2O)2]2[V12B16O50(OH)8(H2O)0.5]·4(H2O)化合物1的合成
称取原钒酸钠(Na3VO4·12H2O) 0.217 6 g,硼酸(H3BO3)0.500 0 g,醋酸锰(Mn(CH3COO)2·4H2O)0.200 0 g,乙二胺(en)0.2 mL,放入25 mL内衬聚四氟乙烯的不锈钢水热反应釜中,再加入4.0 mL蒸馏水搅拌30 min使其完全溶解,滴加氨水调节pH 8.58左右,置于160 ℃的恒温箱中反应96 h,取出后自然冷却至室温,经过抽滤、洗涤得到棕黄色类似正方形状的化合物1(按钒计算产率约56%)。
1.1.2[Zn(en)0.5(H2O)]6[V12B18O54(OH)6(OH)]·3(OH)化合物2的合成
称取偏钒酸铵(NH4VO3)0.175 5 g,硼酸(H3BO3)0.25 g,醋酸锌(Zn(CH3COO)2·2H2O)0.329 3 g,2,2联吡啶0.156 2 g,放入25 mL内衬聚四氟乙烯的不銹钢水热反应釜中,再加入4.0 mL蒸馏水搅拌30 min使其完全溶解,滴加乙二胺调节pH 8.68左右,置于140 ℃的恒温箱中反应120 h,取出后自然冷却至室温,经过抽滤、洗涤得到棕黄色化合物2(按钒计算产率约为70%)。
1.2 结构的确定
X-射线单晶衍射法是目前测定单晶结构最常用且有效的方法。利用Rigaku R-Axis-Parid Weissenberge IP衍射仪,在293 K温度下,采用石墨单色化的Mo靶Kα射线(λ=0.710 73×10-10)以ω-2θ扫描方式对本文所合成的化合物进行晶体晶胞参数和衍射强度的测定。选择I>2σ(I)的独立衍射点,用 SHELXL-97程序[11]对单晶数据进行解析,确定化合物的结构。
1.3 红外光谱表征
红外光谱是一种基于分子振动的光谱,不同的化学键或官能团具有特定的振动吸收峰,因此,红外光谱是分析化合物结构的有效辅助方法,也是研究金属氧簇化合物的性质与结构关系的常用方法之一[12]。利用 Thermo Scientific Nicolet iS50 FT-IR仪器,以KBr为背景,在400~4 000 cm-1范围内,对化合物扫描32次,得到化合物的红外光谱图。
2 结果与讨论
2.1 化合物的结构特征
化合物1属于单斜晶系,C2/C空间群,不对称单元如图1所示。

对称操作符: a. (1-x,y,0.5-z); b. (0.5+x,-0.5+y,z);c. (-0.5+x, 0.5+y,z)
化合物以[V12B16O58]16-簇单元为主体,[V12B16O58]16-簇单元由一个V12笼和两条B8O20链组成,其中V12笼由12个VO5四方锥以共棱的形式连接形成扭曲开放的笼状,B8O20链由2个B4O11基础单元构成,B4O11由3个BO4四面体和1个BO3三角形桥连而成。两条B8O20链通过V-O-B键桥连嵌入V12笼的空隙中,形成一个闭合的笼。化合物中V存在两种价态,4价和5价,通过BVS价键[13]计算可得V原子的平均价态为4.333 (V(IV)∶V(V)=2∶1)。
化合物1是有机-无机杂化形成的多酸化合物,它是由[Mn(H2O)2]2+与[V12B16O58]16-簇阴离子间通过金属-氧(Mn-O)键作用构成,两个Mn2+分别与每个簇单元中B8O20链上的两个氧原子配位,同时还与两个水分子配位,呈现出八面体的六配位方式,经platon计算其孔隙率为20.0%。[V12B16O58]16-簇单元通过Mn-O键及乙二胺与B8链上的氢键作用形成了二维层状结构(见图 2)。层间通过氢键作用形成三维结构,氢键如表1所示。O30为与硼原子相连的端氧,O2,O9,O4,O8是与钒原子相连的端氧。
化合物2属于三方晶系,R-3空间群,不对称单元如图3所示。
化合物2是以V12B18为构筑主体的零维结构的化合物,且具有较大的孔洞结构,经platon计算,得出其孔隙率为22.1%。V12B18由两个V6环和一个B18环组合而成,两个V6环通过V-O-B键分别连接在B18环的上、下方,从而形成V6-B18-V6夹心结构。V6环由6个四方锥形的VO5共边相连构成,B18环由6个B3O7共顶点连接而成,一个平面三角形的BO3和2个四面体形的BO4组成一个B3O7单元。每个[V12B18O60]14-簇单元中的B18链通过Zn-O键与6个Zn配位,同时Zn原子还通过Zn-N键或Zn-O键与en或H2O分子相连接,但en和H2O占有率各为0.5,6个[Zn(en)0.5(H2O)]2+在V12B18簇单元外,围成一个圆圈,V12B18簇单元位于其圆圈的中心。化合物2中的V仍是混合价态,通过BVS价键[13]计算可得V原子的平均价态为4.333 (V(IV)∶V(V)=2∶1)。从图4可以看出,化合物2通过[Zn(en)0.5(H2O)]2+与[V12B18O60]14-簇阴离子桥连作用及乙二胺或水与簇阴离子间的氢键作用构成,氢键如表2所示,O1与O4均为与钒原子相连的端O,相对于化合物1,化合物2的氢键较少。

图2 化合物1二维层状结构
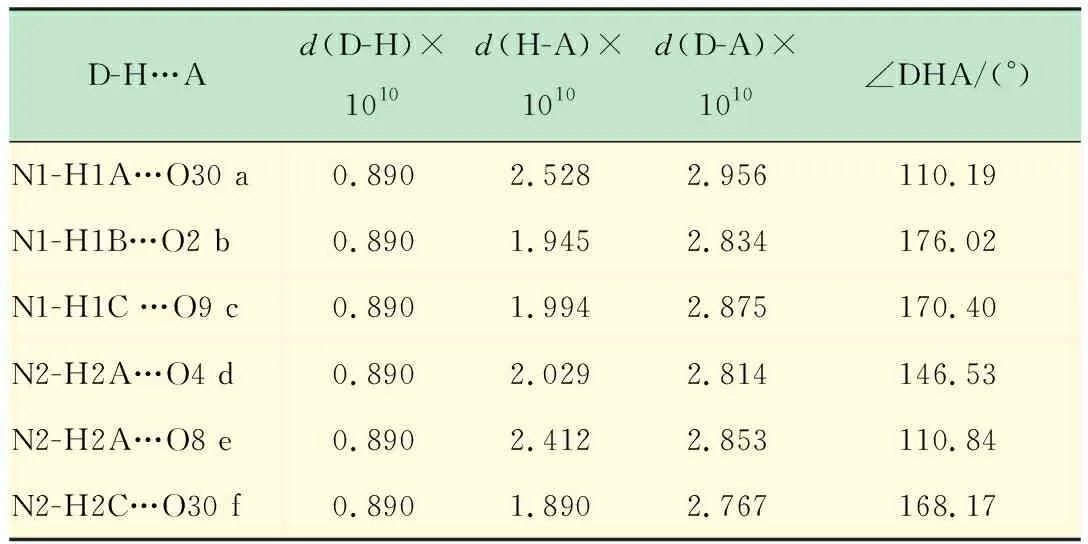
表1 化合物1部分氢键列表
对称操作符: a. (-x+2, -y+1, -z+1); b. (x, -y+1,z+1/2);c. (-x+3/2, -y+3/2, -z+1);d. (-x+1,-y+1, -z+1);e. (-x+3/2, -y+3/2, -z+1);f. (x, -y+1,z+1/)

图3 化合物2的不对称单元图(省略氢原子和孤立的水分子)
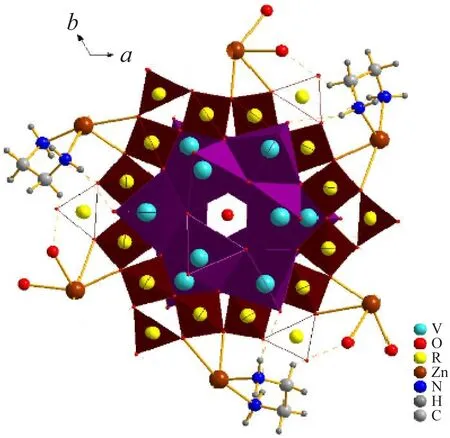
图4 化合物 2堆积图

表2 化合物2部分氢键列表
对称操作符: a. (-x+1, -y+1, -z+1); b. (x-y+1,x, -z+1,1/3-z); c. (-x+y, -x+1,z)
2.2 化合物的红外光谱
如图5所示,由于化合物1和2均含有乙二胺配体和水,因此分别在3 403 cm-1和3 428 cm-1左右出现νas(O—H)吸收峰,又因氢键的影响,峰出现了宽化;乙二胺中νas(N—H) 尖吸收峰分别出现在3 162、3 339 cm-1附近,化合物1中,乙二胺与水分子及V12B16簇间形成强烈的氢键导致vas(N—H)向低波数偏移。1 623和1 632 cm-1处出现的峰分别归属于两个化合物的δ(O—H)振动吸收峰。B原子在两个化合物中均存在两种不同的配位方式,但因所形成的笼不同,故峰位略有移动,平面三角形的BO3中的νas(B—O)吸收峰在化合物1中出现在1 344 cm-1处附近,化合物2中则在1 355 cm-1,而BO4中的νas(B—O)吸收峰在两化合物中分别出现在1 038和1 065 cm-1,同样ν(V=Ot)吸收峰分别在930和951 cm-1,化合物1中 乙二胺与V12B16簇钒端氧间形成强烈的氢键,导致ν(V=Ot)向低波数偏移,且峰形宽;化合物1中795 cm-1和化合物2中796 cm-1处的吸收峰归属于νas(V—Oμ)反对称伸缩振动吸收峰。而化合物1中711 cm-1附近νs(V—Oμ)被簇单元的骨架振动吸收峰所掩盖,化合物2中νs(V—Oμ)位于718 cm-1处,表3对两化合物主要化学键的红外振动吸收峰进行了归纳。
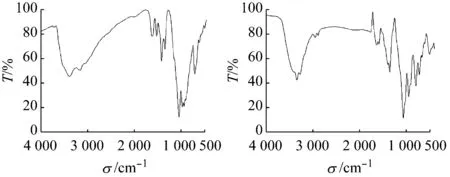
(a) 化合物1(b) 化合物2

表3 化合物1,2部分红外振动吸收峰
注:a. 四配位的B; b. 三配位的B
3 实验条件
3.1 钒源和硼源
实验中,尝试的钒源样品有:Na3VO4、NaVO3、NH4VO3以及VOSO4和V2O5。采用氧化物V2O5为钒源,通常不能与其他原料完全反应,即便完全反应,最终得到的产物也都是粉末,无法得到理想的晶体,这与V2O5水溶性差、化学性质稳定有关。同样采用硫酸氧钒(VOSO4)作钒源,与其他原料通过水热反应最后得到的大部分也是粉末。文献报道的钒氧簇合物大多采用偏钒酸铵作为钒源[14],可能是因为铵根离子本身显酸性,对溶液体系的pH产生一定的影响,本实验合成得到的化合物2的钒源也采用偏钒酸铵,化合物1采用Na3VO4作钒源。
实验中尝试用到的硼源有:H3BO3、Na2B4O7·10H2O、BLiO2和B2O3。采用B2O3作为硼源,与其他原料水热反应后,最终得到的产物是黑色的粉状固体,同样与B2O3的水溶性差以及化学性质稳定有关。
通过筛选不同类型的钒源、硼源,多次调整实验方案,发现采用硼酸作为硼源、钒酸盐作为钒源较易合成得到形状规则、尺寸适中的多钒硼氧簇化合物单晶,与有关文献报道相吻合[14]。本实验获得的两个化合物均采用硼酸作为硼源、钒酸盐作为钒源。
3.2 反应体系pH
反应体系的pH对多酸化合物的合成具有较大影响,在不同的pH范围内,钒酸盐存在形式不同[15],如图6所示。
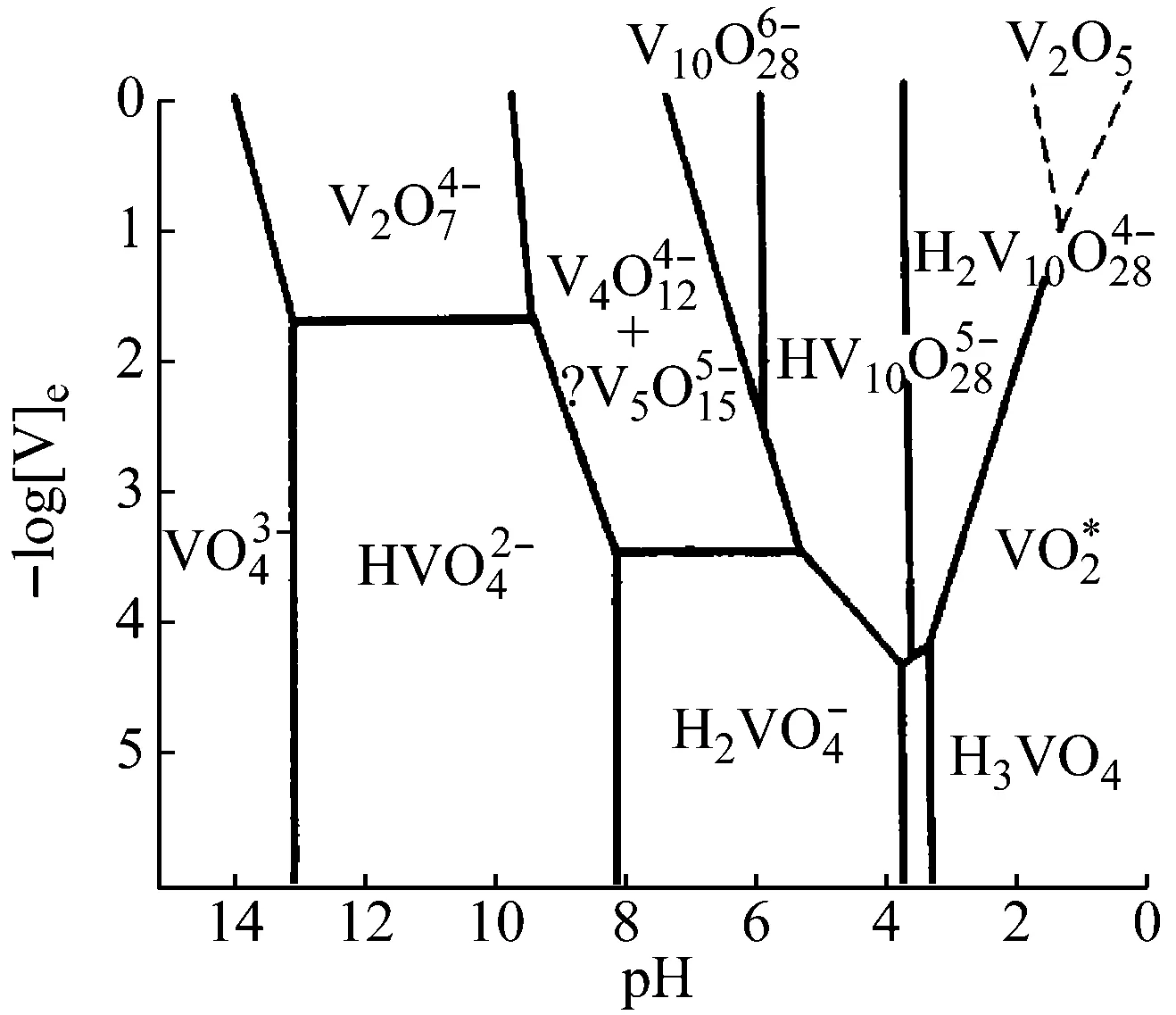
图6 钒氧阴离子与pH的关系
pH值不仅影响金属离子的沉淀情况,也对有机物的水解有一定的影响。本文经过实验探索,采用NaOH、NH3·H2O、1,2-dap(1,2-丙二胺)、en(乙二胺)、dien(二亚乙基三胺)、HAc来调控反应溶液的pH值,表明在pH 8.00~9.10左右,较易合成得到多钒硼氧簇化合物单晶,且获得的晶体形状规则、尺寸适中。本文两个化合物的反应溶液pH分别为8.58和8.68。
3.3 模板剂
模板剂会影响水热合成化合物的结构。实验过程分别引入多种有机胺作为模板剂,如1,2-dap、en、dien、DMF(二甲基甲酰胺)、2,2-dpy(2,2-联吡碇),也尝试同时引入两种不同类型的有机胺作为模板剂,以期合成得到新型多钒硼氧簇化合物,但实验结果并不理想,只有乙二胺较易参与多酸化合物的配位,这与相关文献报道相符。化合物1中的乙二胺处在簇单元外,化合物2中的乙二胺与金属离子锌配位。实验结果显示,有机模板剂不仅可以调节溶液体系的pH值,而且还可以修饰多钒硼氧簇单元的结构。
3.4 温度和时间
反应温度与水热体系的反应程度和反应平衡的移动有关,合适的反应温度不仅可以提高目标产物的转化率,同时合成得到的化合物晶形也较好。不同的反应时间影响晶核的成长速度以及它们的成型。
在探索温度对化合物合成的影响时,实验从120~190 ℃设置温度梯度,每间隔10 ℃为一个梯段,研究不同温度梯度下化合物的形成情况。结果表明,在不同的温度下,合成得到的化合物的晶形和数量有明显的差别,最适合化合物合成的温度是120~180 ℃(化合物1合成温度160 ℃,化合物2为140 ℃),如果温度超过180 ℃,得到的产物多是黑色粉末或者无法合成出目标化合物。
不同的反应时间直接影响晶体的成型速度。经过实验尝试,合成的反应时间在3~6 d内,化合物成形较好,形状规则,且尺寸适中。反应时间少于3 d,成核晶体数少且多数形状不规则;超过7 d,晶体之间容易发生晶形的转变。
4 结 语
水热合成是一个能较快得到目标产物的方法,同时又是一个非常复杂的过程,它受到很多因素的影响:例如原料、反应物浓度、pH值、模板剂、反应时间、反应温度以及加入的金属阳离子等[16]。到目前为止,多钒硼氧簇化合物都是采取水热合成法获得,但由于影响水热合成的因素复杂,缺乏可靠的实验设计方案指导,所以仍需进行文献调研,不断总结实验经验,探索新颖化合物的合成条件和合成方案。本文综合研究实验原料、有机模板剂、pH值和反应温度等控制因素,经过多种实验方案设计,筛选出适合本科生综合实验教学和研究生实验教学的多钒硼氧簇化合物的合成过程、结构表征、谱学研究等。
本文实验可以进一步拓展,利用X-射线粉末衍射(XRD)、元素分析(EA)、紫外光谱、热重分析等对化合物进行更多谱学性质的研究,探讨化合物结构与性能的关系,在培养学生查阅文献、设计实验方案、合成目标化合物的创新能力和实验操作技能基础上,指导学生确定化合物的结构并进行性能测试,进一步拓展学生操作使用大型仪器设备的能力和综合分析问题、解决问题的能力,为本科生准备毕业论文或研究生进行科研实验提供良好的综合训练。
