营养治疗在晚期食管癌同步放化疗过程中早期介入的作用研究
2018-09-18李宁高岭孟丹丹弋振营张红蕊徐志巧
李宁,高岭,孟丹丹,弋振营,张红蕊,徐志巧
开封市中心医院肿瘤诊疗中心,河南 开封4750010
食管癌是常见的一种消化道恶性肿瘤,其发病率和病死率均较高,是影响人类健康的重要疾病[1]。早期食管癌以手术治疗为主,而放疗及化疗是Ⅲ~Ⅳ期食管癌的主要治疗方式。由于进食困难、放射损伤及化疗药物引起的不良反应,接受同步放化疗的食管癌患者存在不同程度的营养不良,影响了患者机体的免疫功能及治疗效果,降低了其生活质量[2-3]。肠内营养是目前常用的营养支持治疗,采用肠内营养管将营养液输注至屈氏韧带水平肠管,可以达到补充机体能量及营养素的作用[4-5]。本研究对早期肠内营养治疗对食管癌患者同步放化疗过程中营养状态、免疫功能及治疗效果进行探讨,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2013年6月至2017年6月开封市中心医院肿瘤诊疗中心收治的Ⅲ~Ⅳ期食管癌患者的病历资料。根据营养治疗方法不同将患者分为观察组和对照组。纳入标准:①均为Ⅲ~Ⅳ期食管癌患者;②初次就诊,均未接受手术治疗及放化疗;③年龄﹤80岁;④卡氏(KPS)评分≥70分;⑤符合2015年《食管癌放疗患者肠内营养专家共识》中肠内营养适应证[6];⑥病历资料完整。排除标准:①合并肝脏及颅内转移者;②消化道先天畸形者;③急性感染;④消化道梗阻;⑤胃肠道功能不全;⑥严重肝肾功能不全及心肺功能不全;⑦凝血功能异常;⑧近6个月内心肌梗死及脑卒中者。根据纳入和排除标准,本研究共纳入Ⅲ~Ⅳ期食管癌患者90例。其中观察组45例,男25例,女20例;年龄41~75岁,平均(62.7±9.2)岁;临床分期:Ⅲ期39例,Ⅳ期6例;病理类型:鳞癌43例,腺癌2例。对照组45例,男21例,女24例;年龄40~77岁,平均(63.5±10.8)岁;临床分期:Ⅲ期40例,Ⅳ期5例;病理类型:鳞癌42例,腺癌3例。两组患者的性别、年龄、临床分期及病理类型比较,差异均无统计学意义(P﹥0.05),具有可比性。
1.2 治疗方法
1.2.1 化疗 两组患者均采用顺铂+氟尿嘧啶+亚叶酸钙方案化疗,具体方案:第1~2天顺铂,30 mg/m2,加至500 ml生理盐水中,静脉滴注;第1~5天氟尿嘧啶,400 mg/m2,静脉泵入6 h/d;第1~5天亚叶酸钙,200 mg/d,加至250 ml生理盐水中,静脉滴注。每4周为1个周期,共接受2个周期化疗。
1.2.2 放疗 采用调强适形放射治疗(intensitymodulated radiation therapy,IMRT)技术,放疗设备选择Varian 23EX直线加速器,应用6MV-X线。患者取仰卧位双手上举至头顶,体部热熔膜固定,在平静呼吸下经计算机断层扫描(computed tomography,CT)定位增强扫描,扫描层厚为5 mm,扫描范围自胸廓入口至肾上腺水平,包括全部肺组织、纵隔、心脏、胸部椎体等。扫描数据经光纤传输至TPS工作站,放疗医师根据患者胸部CT或正电子发射计算机断层显像(positron emission tomography and computed tomography,PET-CT)等影像资料勾画靶区。大体肿瘤体积(gross tumor volume,GTV)为参考钡餐、胃镜或者PET-CT检查结果,结合CT影像上显示食管壁厚度﹥0.5 cm的区域;临床靶区体积(clinical target volume,CTV)为GTV前后左右外扩0.5 cm,上下两端外扩2.0 cm;计划靶区体积(planning target volume,PTV)为CTV前后左右外扩0.5 cm,上下两端外扩1.0 cm。物理师根据放疗处方要求制定治疗计划,处方剂量60~66 Gy/30~33 f,单次剂量2 Gy,每天1次,每周5次。要求95%PTV体积接受﹥100%的处方剂量照射,脊髓﹤40 Gy,全肺V20≤25%,V30≤18%,心脏平均剂量≤30 Gy。治疗计划经放疗主任医师审核及验证后开始治疗,全部患者均顺利完成放射治疗。
1.2.3 营养治疗 观察组患者采用肠内营养治疗,常规留置肠内营养管,根据患者的实际情况,由营养科医师制定营养计划,采用肠内营养泵控制肠内营养液用量及输注速度,肠内营养液采用肠内营养乳剂(每瓶 500 ml,500 kcalth,1 calth=4.1840 J),满足患者35 kcalth(/kg·d)的能量需求。对照组患者采用常规方法治疗,对于能经口进食者采用常规饮食,对常规饮食受到严重影响者,采用静脉营养支持,包括氨基酸、葡萄糖、脂肪乳及微量元素。
1.3 观察指标
检测并比较两组患者治疗前后的营养指标、免疫状态及近期治疗效果。其中营养指标包括白蛋白(albumin,ALB)、前清蛋白(prealbumin,PA)及转铁蛋白(transferrin,TF)。免疫指标包括 CD3+、CD4+、CD8+及CD4+/CD8+水平。近期疗效评价参照1979年WHO实体瘤疗效评价标准:完全缓解(CR),辅助检查显示病灶完全消失,维持至少4周;部分缓解(PR),病灶缩小最大径及其最大垂直直径的乘积缩小≥50%,维持至少4周;稳定(SD),病灶最大径及其最大垂直直径的乘积缩小﹤50%,或增大﹤25%,维持至少4周;进展(PD),出现新发病灶,或病灶最大径及其最大垂直直径的乘积增大≥25%。
1.4 统计学分析
采用SPSS 13.0统计软件对数据进行分析。计量资料以均数±标准差(±s)表示,组间比较采用重复测量方差分析及t检验;计数资料以率(%)表示,组间比较采用χ2检验,等级有序分类变量采用秩和检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 治疗前后营养指标的比较
治疗前至治疗后1个月,对照组患者的PA、TF水平均呈下降趋势,组内比较,差异均有统计学意义(F=20.18,21.08,P﹤0.05);观察组患者的ALB、PA及TF水平均呈先下降后上升趋势,但组内比较,差异均无统计学意义(P﹥0.05)。两组患者的PA、TF水平比较,差异均有统计学意义(F组间=3.66、4.22,P组间﹤0.05);不同时间点(治疗前、治疗后1周、治疗后2周、治疗后1月)的PA、TF水平比较,差异均有统计学意义(F时间=4.18、4.38,P时间﹤0.05);组别与时间存在交互作用(F交互=4.65、5.74,P交互﹤0.05)。两组患者的ALB水平在组间、不同时间点间、组间·不同时点间比较,差异均无统计学意义(P﹥0.05)。(表1)
表1 治疗前后两组患者的ALB、PA、TF水平(g/L,±s)
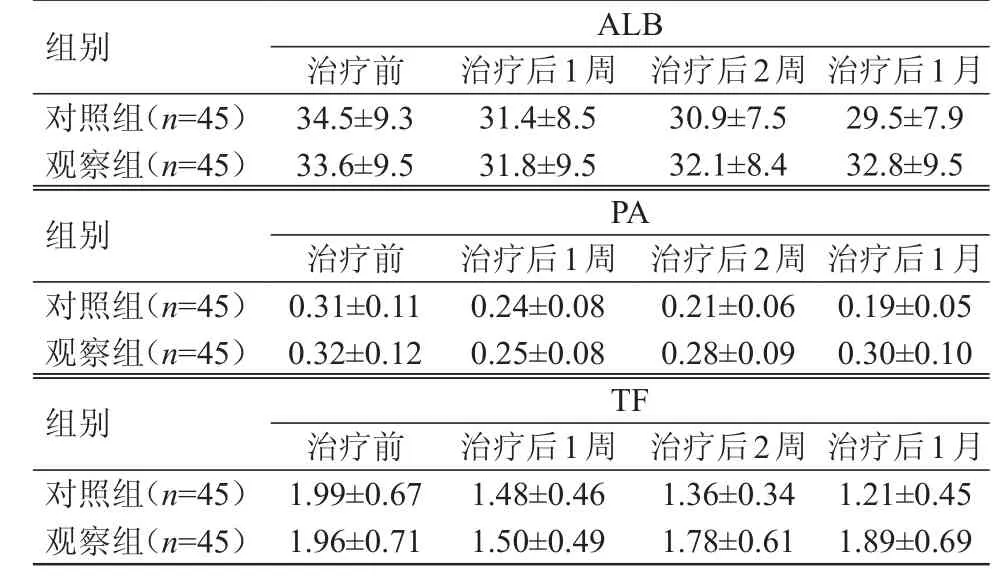
表1 治疗前后两组患者的ALB、PA、TF水平(g/L,±s)
治疗后2周30.9±7.5 32.1±8.4治疗后1月29.5±7.9 32.8±9.5治疗后1周31.4±8.5 31.8±9.5治疗前34.5±9.3 33.6±9.5 PA治疗后2周0.21±0.06 0.28±0.09治疗后1月0.19±0.05 0.30±0.10组别对照组(n=45)观察组(n=45)组别对照组(n=45)观察组(n=45)组别对照组(n=45)观察组(n=45)TF治疗前1.99±0.67 1.96±0.71治疗后1周1.48±0.46 1.50±0.49治疗后2周1.36±0.34 1.78±0.61治疗后1月1.21±0.45 1.89±0.69 ALB治疗前0.31±0.11 0.32±0.12治疗后1周0.24±0.08 0.25±0.08
2.2 治疗前后CD 3+、CD 4+、CD 8+、CD 4+/CD 8+水平的比较
治疗后,对照组患者的CD4+、CD4+/CD8+水平均明显低于本组治疗前,差异均有统计学意义(t=2.63、2.12,P﹤0.05)。治疗后,观察组患者的CD4+、CD4+/CD8+均较本组治疗前降低,但差异均无统计学意义(P﹥0.05)。治疗后,观察组患者的CD4+、CD4+/CD8+水平均高于对照组,差异均有统计学意义(t=2.20、2.01,P﹤0.05)。(表2)
表2 两组治疗前后CD 3+、CD 4+、CD 8+及CD 4+/CD 8+水平的比较(±s)
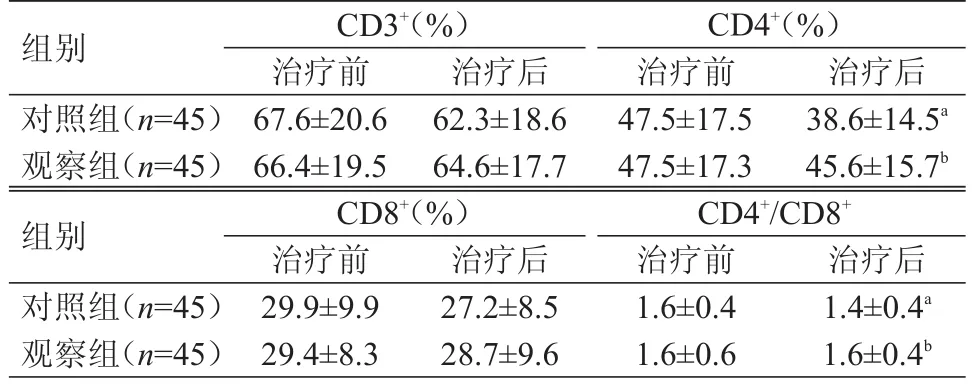
表2 两组治疗前后CD 3+、CD 4+、CD 8+及CD 4+/CD 8+水平的比较(±s)
注:a与本组治疗前比较,P<0.05;b与治疗后对照组比较,P<0.05
组别对照组(n=45)观察组(n=45)组别对照组(n=45)观察组(n=45)CD3+(%)治疗前67.6±20.6 66.4±19.5 CD8+(%)治疗前29.9±9.9 29.4±8.3治疗后62.3±18.6 64.6±17.7治疗后38.6±14.5a 45.6±15.7b治疗后27.2±8.5 28.7±9.6 CD4+(%)治疗前47.5±17.5 47.5±17.3 CD4+/CD8+治疗前1.6±0.4 1.6±0.6治疗后1.4±0.4a 1.6±0.4b
2.3 近期疗效的比较
治疗1个月后,观察组患者的治疗效果优于对照组,差异有统计学意义(Z=2.07,P﹤0.05)。(表3)
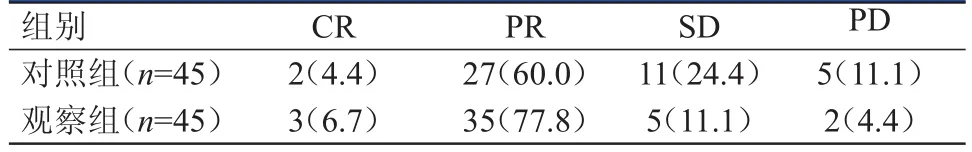
表3 两组患者的近期疗效[ n(%)]
3 讨论
食管癌本身及抗肿瘤治疗均能够引起患者营养不良。患者多存在不同程度的进食障碍,其热量、蛋白质、脂肪及维生素等摄入不足,造成营养不良[7-8]。Ⅲ~Ⅳ期食管癌患者多采用同步放化疗治疗,但治疗相关不良反应进一步加重了患者营养不良的程度,影响患者的治疗效果及生活质量[9-10]。放射治疗可以直接或间接地损伤患者的咽部、食管黏膜及胃黏膜,影响经口摄入食物。化疗药物的毒性作用一方面会直接损伤机体正常细胞,另一方面还会引起消化道症状,进而影响食物摄入,影响机体营养状态[11]。
机体的营养状态会影响患者的放化疗效果,当患者存在严重营养不良时,其可耐受的放射剂量降低,机体不良反应加重。有研究表明,营养支持治疗能够提高食管癌患者同步放化疗的依从性及顺应性[12]。而肠内营养治疗是目前临床应用效果最好的营养治疗方法之一。与肠外营养治疗比较,肠内营养治疗可将混合营养液通过肠内营养管送达十二指肠及空肠,符合肠道消化的生理过程,可以有效地维持和保护肠道生理功能及屏障作用[13-15]。相关研究表明,肠内营养治疗能够促进胃肠道相关激素的合成和释放,维持肠道血液供应,促进肠道黏膜屏障功能,维持胃肠道内、外分泌功能[16]。肠内营养液含有适当比例的糖类、蛋白质、脂肪、维生素,为患者提供足够的热量及营养素,纠正营养不良造成的负氮平衡[17]。血清ALB能够反映患者的营养状态,与肝脏合成功能及机体摄入有关。还有研究显示,ALB水平与食管癌患者的生存率相关,低水平ALB会增加患者的病死率[18]。但也有研究指出[19],ALB的半衰期长达21天,因此其并非一个可靠的反映营养不良的短期指标。本研究中,两组患者的ALB水平比较,差异无统计学意义(P﹥0.05),可能与随访时间较短有关。PA及TF均是能较敏感反映机体营养状态的指标,本研究结果显示,治疗前至治疗后1月,对照组患者的PA及TF水平均呈下降趋势,而观察组患者的PA及TF水平均呈先下降后上升趋势,且两组患者的PA及TF水平在组间、不同时点间、组间·不同时点间比较,差异均有统计学意义(P﹤0.05),提示肠内营养治疗能够改善患者的营养状态。在放化疗治疗过程中,患者机体免疫功能受到抑制,表现为CD4+T细胞减少,NK细胞活性降低。营养支持治疗在改善机体营养状态的同时,也能够改善患者机体免疫状态,本研究结果显示,观察组患者治疗后CD4+、CD4+/CD8+水平均高于对照组,提示采用早期肠内营养治疗能够明显改善食管癌患者同步放化疗过程中相关免疫细胞水平,从而保护机体的免疫功能。相关研究显示,食管癌对同步放化疗的反应性较高,可达80%~90%[20]。而本研究结果表明,在短期疗效方面,观察组患者的治疗效果优于对照组,提示有效的营养支持治疗能够提高同步放化疗的效果。
综上所述,在Ⅲ~Ⅳ期食管癌患者同步放化疗中,早期采用肠内营养治疗能够改善患者的营养状态及免疫功能,并提高短期疗效,具有较高的临床应用价值。
