局部进展期直肠癌手术前后放化疗的疗效对比
2019-01-16张红雁
杨 勇 张红雁
直肠癌是消化道最常见的恶性肿瘤之一,近年来其发病率和死亡率呈上升趋势[1]。手术是直肠癌主要治疗手段,但对于局部进展期直肠癌,单纯手术治疗复发率高,长期生存率低,目前多采用放化疗和手术相结合的综合治疗方案。放化疗方案分为术前放化疗、术后放化疗,NCCN指南推荐对T3~4N0~2M0的直肠癌患者行术前放化疗[2]。本文通过比较152例行根治术的局部进展期直肠癌患者术前放化疗与术后放化疗疗效和急性不良反应的差异,探讨局部进展期直肠癌行术前放化疗与术后放化疗的优劣。
1 资料与方法
1.1 一般资料 回顾分析2009年1月至2014年12月安徽省立医院收治的152例经病理证实的局部进展期直肠癌患者临床资料。所有患者均经多种临床检查和影像学(包括直肠指检、纤维结直肠镜,B超,胸片,盆腔CT或MRI)等检查。纳入标准:①术前临床分期(2002版国际抗癌联盟TNM标准[3])为T3~4N0~2M0的直肠癌患者;②手术方式为遵循直肠全系膜切除术原则进行根治性手术的患者;③一般状况评分(Karnofsky,KPS评分)≥70分。排除标准:既往有腹盆腔肿瘤病史或放疗的患者。根据放化疗方案选择的时机,分为术前放化疗组与术后放化疗组。其中术前放化疗组67例,男性39例,女性28例;年龄36~71岁,平均(53.4±7.2)岁,其中Ⅱ期32例(12例cT3N0,20例cT4N0),Ⅲ期35例,肿瘤下缘距肛缘2~11cm,平均(4.7±2.1)cm,直肠中分化腺癌56例,高分化腺癌8例,黏液腺癌3例。术后放化疗组85例,其中男性51例,女性34例;年龄21~74岁,平均(52.3±8.6)岁,其中Ⅱ期47例(21例cT3N0,26例cT4N0),Ⅲ期38例;肿瘤下缘距肛缘2~12 cm,平均(5.6±1.8)cm,直肠中分化腺癌69例,高分化腺癌11例,黏液腺癌4例,印戒细胞癌1例。两组患者性别、年龄、肿瘤类型、肿瘤下缘距肛缘距离及TNM分期的差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
1.2.1 术前放化疗组 术前放化疗组均完成术前同步放化疗,放疗采用IMRT放疗技术,6MV能量X射线。IMRT照射技术:在CT下行放疗定位,患者取仰卧位,膀胱充盈,真空袋固定。放疗靶区临床靶区(CTV)包括原发肿瘤、直肠系膜区、骶前淋巴结区、髂内血管区、部分髂外血管区、闭孔淋巴结区和/或坐骨直肠窝。计划靶区(PTV)在CTV的基础上外扩0.7 cm。照射剂量:常规分割量,1.8~2.0 Gy/d,5次/周,共25~28次,总照射剂量为45~50.4 Gy。正常危及器官限量:50%膀胱照射剂量小于50 Gy,照射50 Gy的股骨头体积小于5%,50%小肠照射剂量小于20 Gy,小肠的最大照射剂量小于52 Gy。同步化疗方案为卡培他滨(1 600 mg/m2·d,2次/天,放疗第1天至放疗结束)。放化疗结束后4~6周行手术治疗,术后完成4~6周期FOLFOX4方案治疗。
1.2.2 术后放化疗组 术后放化疗组先行手术治疗,术后4周行同步放化疗,放化疗方法同术前放化疗组,放疗后完成4~6周期FOLFOX4方案治疗。
1.2.3 根治手术及术后处理 所有患者均遵循直肠全系膜切除术原则进行根治性手术,其中86例行经腹直肠癌切除术(Dixon手术),66例行经腹会阴联合直肠癌根治术(Miles手术)。术后两组患者均接受FOLFOX4方案(奥沙利铂+亚叶酸钙+5-氟尿嘧啶)化疗4~6周期(奥沙利铂 85 mg/m2,第1天;亚叶酸钙200 mg/m2,第1天;5-氟尿嘧啶600 mg/m2;第1、2天)。
1.3 观察指标及评价标准 生存情况(总生存率、无瘤生存率,局部复发率),急性不良反应(包括消化道、血液系统及泌尿系统反应),近期疗效(保肛率、肿瘤缓解率)。无瘤生存期指从患者接受治疗开始至局部复发和/或远处转移的时间,总生存期从患者接受治疗开始至患者因肿瘤因素死亡的时间。急性不良反应按照美国肿瘤放射治疗协作组(RTOG )急性放射损伤分级标准[4]进行分级。
1.4 随访 患者术后每3~6月进行1次门诊随访,随访10~69个月,随访内容包括检查有无局部复发、 远处转移。通过直肠指诊、纤维结直肠镜、盆腔CT扫描、MRI 以及肠道肿瘤标志等方法来判断肿瘤的复发及转移。失访病例5例,总随访率96.7%。
1.5 统计学方法 运用 SPSS 19.0软件对数据进行统计分析,采用Kaplan-Meier法计算生存率并行Log-rank检验,计数资料用例或百分比表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者近期疗效及生存率比较 ①术后放化疗组保肛率为54.1%(46/85),术前放化疗组保肛率为59.7%(40/67),差异无统计学意义(P>0.05);②术前放化疗组:放化疗4周后复查提示临床完全缓解率为15例(22.4%),部分缓解33例(49.3%),无缓解18例(26.9%),术后病理完全缓解(pathological complete remission,pCR)12例(17.9%)。③术前放化疗组、术后放化疗组3年总生存率分别为75.8%、70.4%,差异无统计学意义(χ2=1.124,P=0.289);无瘤生存率分别为68.2%,65.4%,差异无统计学意义(χ2=0.826,P=0.363)。术前放化疗组局部复发率分别为5.9%,低于术后放化疗组16.4%,差异有统计学意义(χ2=3.975,P=0.047)。
2.2 两组患者急性不良反应比较 术前放化疗组发生的急性不良反应分级多为1、2级,患者均能耐受;术后放化疗组有4例患者因腹泻中断化疗,1例中断放疗。两组同期放化疗主要的不良反应为白细胞下降、腹泻、恶心呕吐及放射性直肠炎。术前放化疗组患者无论是胃肠系统、泌尿系统还是血液系统急性反应发生率均小于术后放化疗组,差异有统计学意义(P<0.05)。详见表1。
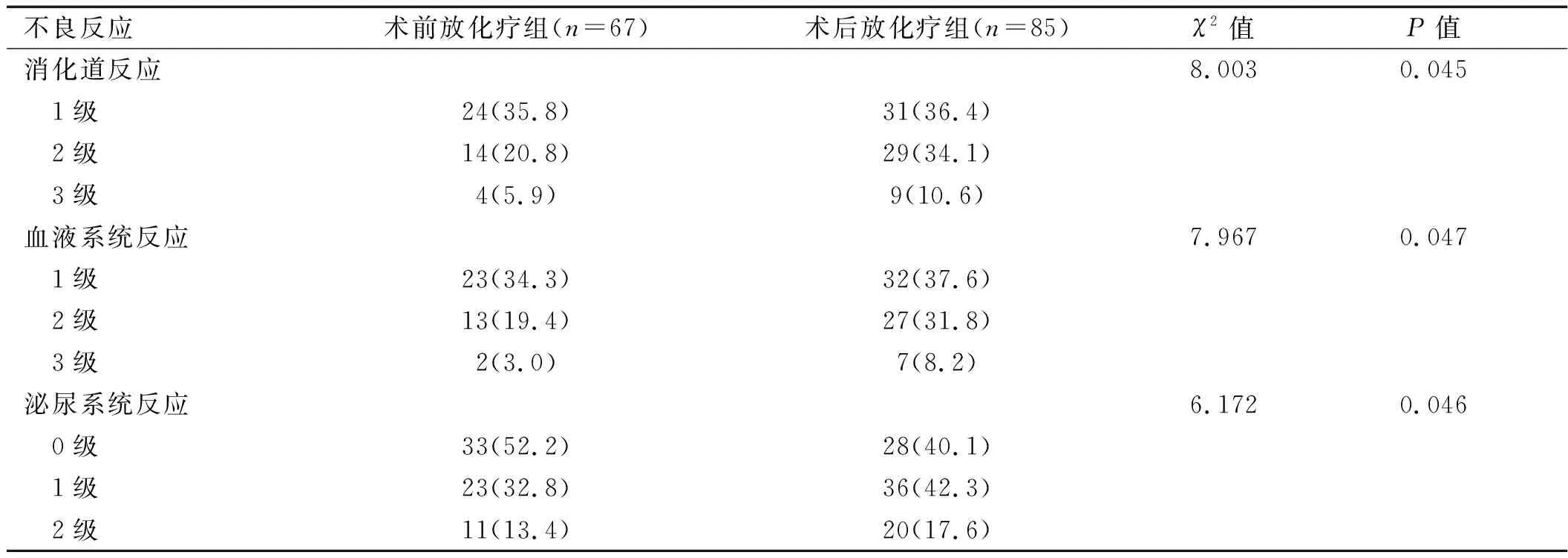
表1 两组患者急性不良反应比较[例(%)]
3 讨论
大量研究[5-8]证实,术前放化疗可取得与术后放化疗相同的长期生存率和无瘤生存期,且在肿瘤降期和病理缓解上有明显优势。Sauer 等[6]的研究结果提示,术前放化疗比术后放化疗降低了10年的局部复发率(7.1%比10.1%),而急性和晚期毒性反应率均明显低于术后放化疗(分别为6%比13%与27%比40%),但两者总生存率无显著差异(59.6%比59.9%)。最新的研究[9]显示,对于局部进展期直肠癌行IMRT联合Xelox方案术前放化疗并不显著降低放化疗期间胃肠道反应。本研究结果显示,术前放化疗组与术后放化疗组的3年总生存率和无瘤生存率差异无统计学意义(P>0.05),而术前放化疗组3年局部复发率低于术后放化疗组(P<0.05),表明两组患者3年总生存率及无瘤生存率无显著差异,但术前放化疗组却降低了局部复发率和治疗的毒性反应。与上述研究结果相符。本组资料中,术前放化疗组未出现严重的不良反应,未出现因毒副反应而中断放射治疗的患者。而术后放化疗组患者因严重腹泻中断化疗4例,中断放疗1例,在不良反应上,术前放化疗组急性不良反应(血液系统、消化道及泌尿系统反应)均低于术后放化疗组(P<0.05)。表明局部进展期直肠癌行术前放化疗可降低急性不良反应,提高治疗耐受性。
国内外多项研究[10-14]显示,对于局部进展期直肠癌,术前同期放化疗后pCR率为15%~34%,且术前放化疗组显著提高了保肛率。本研究中术前放化疗组pCR率为18%,与上述研究结果相符,术后放化疗组保肛率为54.1%,术前放化疗组保肛率为59.7%,后者高于前者,但无统计学差异,考虑可能与本组患者中低位肿瘤所占比例高有关。
综上所述,对于可切除的局部晚期直肠癌患者, 术前同期放化疗方案优于术后同期放化疗治疗方案。
