人类ARGONAUTE和DICER基因家族在结肠癌中的表达分析*
2018-09-14张成晨刘莉娟李楠郭秀丽章梦琦肖娟翟立红龚文容湖北文理学院湖北襄阳44053襄阳市中心医院肿瘤科湖北440
张成晨,刘莉娟,李楠,郭秀丽,章梦琦,肖娟,翟立红△,龚文容(.湖北文理学院,湖北襄阳44053;.襄阳市中心医院肿瘤科,湖北440)
结肠癌是人类常见的恶性肿瘤之一,全球各个地区的发病率存在明显差异,但发病率和病死率排名均靠前。其在西欧、北美等发达国家中的发病率高于亚洲、非洲。近些年,我国结肠癌发病率已超过发达国家,这与人们的高脂肪饮食习惯有关[1]。结肠癌在发生和演变过程中受不同基因诱导调控,ARGONAUTE蛋白和DICER酶是RNA诱导沉默复合体(RISC)的主要组分,在RNA干扰中发挥重要作用。人类ARGONAUTE家族分成AGO亚家族和PIWIL亚家族,共有八大成员,分别为 AGO1、AGO2、AGO3、AGO4、PIWIL1、PIWIL2、PIWIL3、PIWIL4基因。人类DICER家族有2位成员分别为DICER和DROSHA蛋白。近年来,相关研究表明,ARGONAUTE家族和DICER家族在人类肿瘤发生、发展过程中均有密切联系,可作为诊断肿瘤的新指标。本研究通过实时荧光定量聚合酶链式反应(PCR)检测分析AGO和DICER基因家族在正常结肠组织和癌组织中的表达情况,探讨其与结肠癌的关系,初步探索ARGONAUTE和DICER基因家族在结肠癌发生、发展中的作用及其在临床中的意义。现报道如下。
1 材料与方法
1.1 材料 本研究选取襄阳市中心医院肿瘤科术中结肠癌切除后即取配对的癌组织和癌旁组织,并经医院伦理委员会批准。
1.2 仪器与试剂 RNA提取试剂盒(艾德莱),逆转录试剂盒(TOYOBO),SYBR green qPCR mix(艾德莱),荧光定量PCR仪(ABI)。
1.3 方法
1.3.1 结肠癌组织和癌旁组织的cDNA获取 将取得的结肠癌组织和癌旁组织标本置于冻存管中,立即投入液氮中速冻,在液氮中保存。提取RNA时取约0.2 g冻存组织,按RNA提取试剂盒说明书提取组织总RNA,依据逆转录试剂盒说明书,将提取的RNA逆转录成 cDNA。RNA 热变性:12 μL 体系,RNase Free H2O 8 μL,Oligo(dt)20 μL,Total RNA 3 μL。PCR 条 件 :65℃、5 min,立即置于冰上;随后在离心机离心:3 500 r/min、1 s。逆转录反应:20 μL 体系,第一步 RNA 变性溶液 12 μL,5×RT Buffer 4 μL,dNTP Mixture 2 μL,RNase Inhibitor 1 μL,ReverTra Ace 1 μL。PCR 条件:95 ℃、3 min,42 ℃、20 min,99 ℃、5 min,4 ℃、5 min。随后在离心机离心:3 500 r/min、1 s。依据表1合成的引物检测,cDNA转录成功。

表1 qPCR所用引物序列
1.3.2 ARGONAUTE和DICER基因家族的引物合成 在NCBI上搜索目的基因,找到目的基因的mRNA,选择合适的编码序列。用Primer Premier 5软件将引物序列设计好并发送至上海生工生物工程技术服务有限公司合成。所用引物序列见表1。
1.3.3 实时荧光定量PCR检测ago和DICER家族表达 应用96孔PCR板,qPCR反应体系共25 μL,溶解曲线条件为 95℃、15 s,60℃、1 min,95℃、30 s,60℃,15 s。反应条件:95 ℃、10 min,95 ℃、15 s,60 ℃、1 min,40个循环。根据公式 ΔΔCt=(结肠癌 CtAGO家族−结肠癌CtGAPDH/β-actin)−(癌旁组织 CtAGO家族−癌旁组织 CtGAPDH/β-actin),每个标本重复试验3次,结果取平均值。
1.4 统计学处理 采用SPSS19.0统计学软件分析。采用Mann-WhitneyU检验AGO和DICER家族在癌症组织和癌旁组织中表达的差异。以P<0.05为差异有统计学意义
2 结 果
结肠癌及癌旁组织中AGO亚家族表达的实时荧光定量PCR结果,见图1。AGO2在结肠癌组织中的表达明显高于癌旁组织,差异有统计学意义(P<0.05);AGO1、AGO3、AGO4在结肠癌组织中的表达明显低于癌旁组织,差异均有统计学意义(P<0.05)。结肠癌及癌旁组织中PIWIL亚家族表达的实时荧光定量PCR结果,见图2。PIWIL亚家族成员在结肠癌中的表达明显低于癌旁组织,其中2种组织PIWIL1、PIWIL2表达比较,差异均有统计学意义(P<0.05)。结肠癌及癌旁组织中DICER家族表达的实时荧光定量PCR结果见图3。DICER家族成员在结肠癌中的表达低于癌旁组织,DICER、DROSHA表达比较,差异均有统计学意义(P<0.05)。
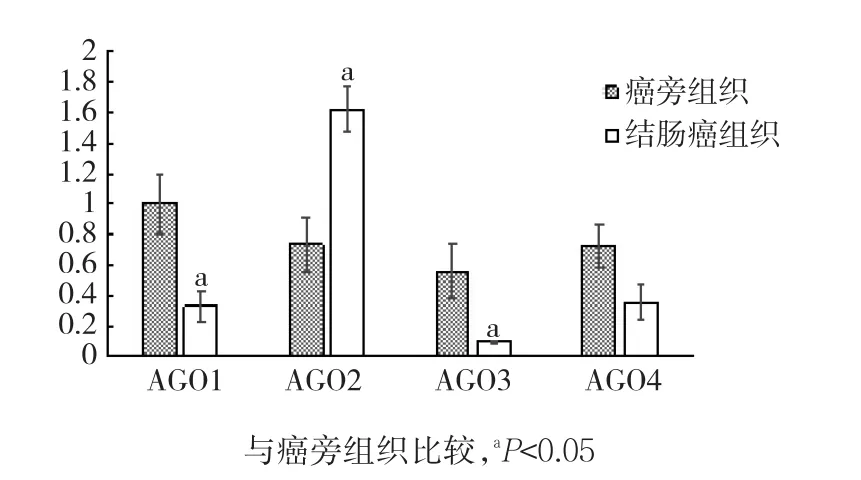
图1 2种组织中ARGONAUTE亚家族表达
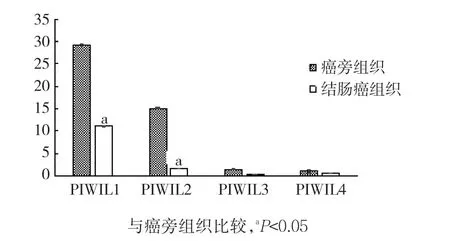
图2 2种组织中PIWI亚家族表达
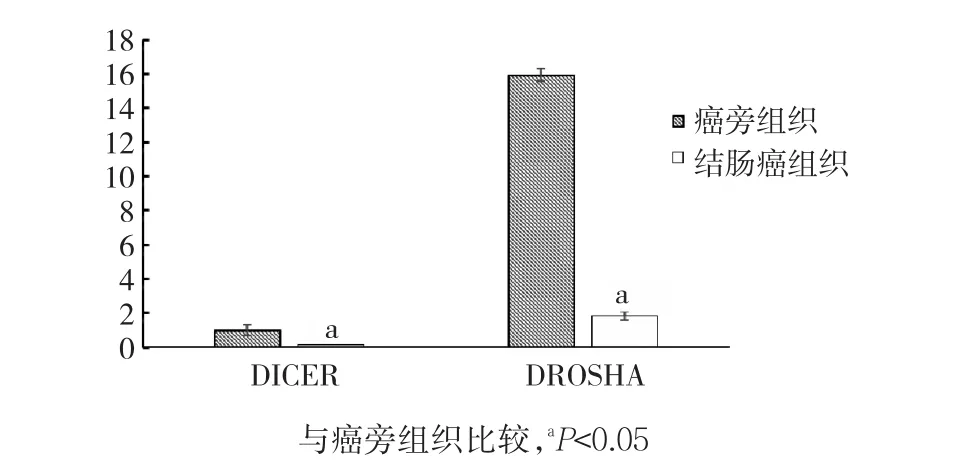
图3 2种组织中DICER家族表达
3 讨 论
ARGONAUTE蛋白家族是一类高度保守的碱性蛋白,共同结构有PAZ结构域、MID结构域和PIWI结构域[2]。PAZ结构域和PIWI结构域形成特殊分子结构,建立了一个供底物结合的沟槽,有助于siRNA和目标mRNA结合,并可以剪切 mRNA[3]。AGO2蛋白结合DICER酶等组成了RISC,DICER酶剪切dsRNA形成的siRNA并入RISC,随后高度特异性地结合并降解靶标基因mRNA。RISC在siRNAs或miRNAs引导的基因沉默过程中,通过AGO蛋白催化活性直接启动靶mRNAs的降解[4],这一过程是在RNAi中发挥重要作用的关键步骤。AGO2被发现在膀胱上皮癌[5]、头颈部鳞状细胞癌[6]、卵巢上皮癌中过度表达[7]。AGO2的过度表达已被证实与肿瘤细胞的生长、患者的总体生存率有关[8-9]。然而,也有报道称,在黑素瘤中,AGO2的表达明显降低[10],通过基因操作过度表达AGO2则可以抑制细胞和肿瘤的生长[11-12]。AGO2在不同组织的不一致表达水平可以解释为:由于不同的miRNAs表达模式,AGO2的表达水平会因癌症类型不同而不同[13-14]。此外,AGO2还被发现与癌症血管生成、转移等有关。这些过程的调控机制也会因癌症的类型和阶段不同而不同。癌症类型、癌症分期、miRNAs的表达模式和肿瘤发育调节机制是AGO2表达和功能的主要影响因素。有研究表明,AGO2直接与某些恶性肿瘤的已知肿瘤因素相互作用,而miRNA却不参与此过程。SHANE等[15]报道AKT3可以使在S387上的AGO2磷酸化,抑制AGO2与GW180结合进入P小体,从而抑制靶基因的表达。本试验AGO2的表达和其他研究结果一致,结肠癌中AGO2的过度表达,可能与miRNA参与或结肠癌的癌症因素作用有关,其上调表达背后的机制还需进一步研究阐明。
AGO1在人体组织中普遍表达,尤以皮肤中明显表达。VERA等[16]从核层次证实核AGO1调节了AGO1结合基因的表达,这些基因参与了包括细胞周期进展、生长和存活在内的致癌途径。研究发现,在黑素瘤细胞系中Mel Ei和Mel Ho细胞表现出最高的AGO1表达水平;在上皮结肠直肠癌细胞表现出AGO2的高表达和AGO1的低表达;在肝癌HepG2细胞表现出AGO1 mRNA高表达[17]。AGO3和AGO4在人体组织中都呈弱阳性表达,但AGO3、AGO4在某些恶性肿瘤中常发生缺失,暗示恶性肿瘤的发生、发展可能与AGO3和AGO4蛋白的低水平表达或沉默有关。本研究试验结果显示,AGO1、AGO3、AGO4均明显表达下调,可能与所在染色体的丢失或siRNA对AGO蛋白的沉默有关。
PIWIL亚家族蛋白质主要在生殖细胞中表达,其功能是维持生殖干细胞和减数分裂,以及干细胞自我更新。肿瘤干细胞的形成是肿瘤发生的起始。PIWIL亚家族也与恶性肿瘤有关。在乳腺癌[18-19]、胃癌[20]、食管癌和子宫内膜癌中都检测到PIWIL1的表达上调[21-22]。范正军等[23]研究表明,PIWIL1在肝癌组织中高表达暗示患者预后不良。同样,研究表明,在软组织肉瘤和胰腺导管腺癌中,PIWIL1高表达提示患者的预后不良[24-25],暗示这种关系也可能会出现在其他恶性肿瘤中。研究发现,PIWIL1在不同肝癌细胞系中上调或下调,其中的机制需要进一步研究[26]。PIWIL2在人体睾丸、卵巢、小肠、十二指肠组织中阳性表达,特别是在睾丸中明显阳性表达。有研究发现,PIWIL2表达上调会导致精原细胞瘤发生。在早期宫颈癌和乳腺癌中[27-28],PIWIL2表达上调且广泛,可以作为诊断肿瘤的标志物。研究发现,在非小细胞肺癌(NSCLC)中PIWIL1和PIWIL2高表达,并且PIWIL1和PIWIL2表达与肿瘤增殖呈正相关[29-30]。PIWIL2在预后差的NSCLC中表达过量,因此,PIWIL2可以作为判断NSCLC预后情况的1项指标。PIWIL3蛋白在人体睾丸中阳性表达,在其他组织中不表达,近期被发现在人星形细胞神经胶质瘤和脑脊膜瘤细胞质中表达。PIWIL4在人体组织中广泛表达,其中以睾丸和骨髓组织中阳性表达明显,但也在转移性肺癌、胃癌等癌细胞中表达。研究发现,PIWIL4在乳腺癌中高表达,降低表达会影响癌细胞的迁移能力[31]。PIWIL亚族成员在本研究癌组织中均是表达下调。PIWIL1和PIWIL2在不同的癌组织中上调或下调,表明可能有未知的通道或miRNA影响PIWIL蛋白的表达。
miRNA与肿瘤的发生、发展密切相关,而miRNA由DICER和Drosha酶剪接生成,因此,DICER和Drosha的异常表达也与肿瘤的发生、发展有关。本研究中DICER和Drosha的表达下调,这与已知研究结果一致。曹政[32]研究发现,DICER和Drosha蛋白在骨肉瘤中表达呈高阳性表达,而在骨软骨瘤中呈低阳性表达,且两者在骨肉瘤和骨软骨瘤中呈明显正相关,提示其可能共用同一途径发挥作用。现有文献表明,DICER和Drosha在人子宫内膜癌、鼻咽癌、乳腺癌、神经母细胞瘤等大多数肿瘤中表达下调[33-36]。有研究对 Be2C、NMB7、NB5等3种神经母细胞瘤细胞系进行操作,沉默DICER或Drosha基因后显示miR-17-5p和let-7a低表达,瘤细胞的增殖能力明显增强[36]。研究表明,对肺癌、卵巢癌、结直肠癌患者而言,DICER和Drosha表达下调意味着其预后不良[37-39]。
本研究中,人类ARGONAUTE和DICER基因家族在结肠癌中均为异常表达,呈明显上调或下调。在结肠癌中只有AGO2明显上调。虽然AGO2的功能复杂,其在结肠癌的作用机制尚不十分清楚,但这为以后结肠癌的治疗研究提供了方向,希望其可成为治疗结肠癌的新分子靶点。其他AGO蛋白均为表达下调,多数只在特别的癌组织中被激活通道表达,但其参与结肠癌的过程还不清楚。DICER和Drosha在结肠癌中表达下调,表明患者预后不良,可以作为患者预后的一个新标志物。今后,还需要进一步研究其与特定miRNA的作用关系,为治疗结肠癌提供新的分子靶点。
