榛子粕抗氧化肽的分离纯化及序列分析
2018-09-13吕春茂韩金晶姬昱佳付沁璇徐嘉一
陈 艳,吕春茂,*,韩金晶,姬昱佳,付沁璇,刘 璐,徐嘉一
(1.沈阳农业大学食品学院,辽宁沈阳 110000;2.内蒙古鄂尔多斯市东胜区食品药品监督管理局,内蒙古鄂尔多斯 017000)
在机体内,适当的自由基起着重要的生物学作用[1],然而机体内自由基和抗氧化物质失衡时,过量的自由基会对机体细胞和一些生物大分子进行攻击[2],导致细胞死亡和组织氧化性损伤。大量研究证明,自由基引发的氧化应激反应与心血管疾病、癌症、糖尿病等多种疾病密切相关[3-4]。适当的补充抗氧化剂能减少由自由基引发的机体氧化损伤和功能损伤。目前,人工合成的抗氧化剂丁基羟基甲苯(Butylated hydroxytoluene,BHT)、丁基羟基茴香醚(Butylated hydroxyanisole,BHA)等被怀疑可能致癌[5-8],而天然抗氧化剂由于具有良好的抗氧化活性且安全性极高,越来越受到广泛的关注[9-10]。
榛子营养价值丰富,种仁中含有15%~25%的蛋白质及8种必需氨基酸,具有抗氧化、增强肌体免疫力、消除疲劳等功效,是一种优质蛋白资源。目前国内对榛子的研究主要集中在榛子蛋白质和抗氧化肽的提取工艺和体外抗氧化活性,而国外对榛子的研究集中在过敏源和烘焙方面,对榛子抗氧化肽的氨基酸序列研究较少。本实验以平欧榛子粕为原料,利用中性蛋白酶提取榛子粕抗氧化肽,用超滤膜和葡聚糖凝胶分离纯化榛子粕抗氧化肽,以DPPH自由基清除率为指标,并采用高压液相串联四级杆质谱(Liquid charomatography-mass spectrometry,LC-MS/MS)分析榛子粕抗氧化肽的氨基酸序列,以期为榛子的精深加工与综合利用提供新的思路。
1 材料与方法
1.1 材料与仪器
榛子粕 榛子粉过80目筛,乙醚脱脂;中性蛋白酶(6000 U/g) 北京Solarbio科学技术有限公司;DPPH(2-2联苯基-1-苦基肼基) 美国Sigma-Aldrich公司;Millopore超滤膜 Millopore有限公司;葡聚糖凝胶G-10 鼎国昌盛生物技术有限公司;高效液相色谱淋洗剂乙腈 国药集团化学试剂有限公司;其他试剂 均为国产分析纯。
VARIAN紫外可见分光光度计 美国瓦里安技术中国有限公司;日立L-8900全自动氨基酸分析仪 日本日立有限公司;Amicon超滤杯 Millipore有限公司;Shim-pack GIS C18(φ2.1×75 mm)色谱柱 日本岛津公司;超高压液相色谱串联四级杆质谱LC-MS-8050 日本岛津有限公司。
1.2 实验方法
1.2.1 榛子粕蛋白的制备 碱溶酸析法:榛子粕溶于水,料液比为3.84 g/mL,用1% NaOH调节pH至8.5,在47 ℃超声波中振荡57 min,4000 r/min离心25 min,取上清液;冷却至室温,1% HCl调节pH至4.5,4000 r/min离心25 min,取其沉淀层,再将pH调至中性,获得榛子粕蛋白,在-80 ℃冰箱冷冻12 h,-40 ℃冷冻干燥机抽真空干燥,后放密封袋保存。
1.2.2 榛子粕抗氧化肽的制备 将榛子粕蛋白粉溶于水,料液比为2.5 g/mL,90 ℃水浴10 min,冷却至室温,调节pH至7.0,加入蛋白酶(17000 U/g),43.7 ℃酶解1.7 h后,溶液90 ℃灭酶10 min,冷却至室温,调节pH至7.0,于4000 r/min离心25 min,取上清液,得到榛子粕抗氧化肽,在-80 ℃冰箱冷冻12 h,-40 ℃冷冻干燥机抽真空干燥,干燥后放密封袋保存。
1.2.3 DPPH自由基清除率的测定 DPPH自由基清除率的测定[11]:取2 mL榛子粕抗氧化肽放入试管中,加入2 mL 0.04 g/L的DPPH无水乙醇溶液,混合均匀,反应25 min,10000 r/min离心分离10 min,取其上清液,517 nm处测混合液吸光度Ai;均匀混合2 mL蒸馏水水和无水乙醇2 mL,517 nm处测混合液的吸光度Aj,2 mL 0.04 g/L DPPH无水乙醇溶液和2 mL蒸馏水均匀混合为对照组,517 nm处测混合液吸光度记为A0。
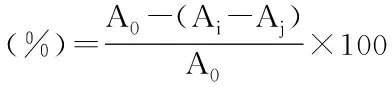
式中:A0:对照组吸光值;Ai:样品组吸光值;Aj:空白组吸光值。
1.2.4 榛子粕抗氧化肽的分离纯化
1.2.4.1 超滤分离 将中性蛋白酶水解产物用滤纸抽滤除杂质,然后在压力为0.2 MPa下进行分液截留。分别选用截留分子质量为5 kDa和1 kDa超滤膜对榛子粕抗氧化肽(Halnut meal antioxidant peptide,HMAP)进行分离,收集HMAP1(>5 kDa)、HMAP2(1~5 kDa)和HMAP3(<1 kDa)三个组分,在-80 ℃冰箱冷冻12 h,-40 ℃冷冻干燥机抽真空干燥,干燥后放密封袋保存。将三个组分的浓度配制为3 mg·mL-1,测定三个组分的DPPH自由基清除率。
1.2.4.2 葡聚糖凝胶纯化 将Sephadex G-10葡聚糖装成1.6 cm×80 cm的玻璃层析柱,然后用蒸馏水洗脱3个柱体积。上样浓度为10 mg·mL-1,上样量为5 mL,洗脱速度0.4 mL·min-1,每管收集3 mL,收集60管,225 nm下检测吸光值,并收集各洗脱峰,冷冻干燥;将每个洗脱峰配成终浓度为1 mg·mL-1,测定各组分的DPPH自由基清除率。
1.2.5 氨基酸组成的测定 酸水解:准确称取0.02 g榛子粕抗氧化肽于水解管中,加入10 mL 6 mol·L-1盐酸,加入正辛醇1~2滴,抽真空充入高纯度氮气,在充氮气状态下封口,再将水解管置于105 ℃烘箱内水解24 h,取出冷却。打开水解管,将水解液倒入50 mL容量瓶内用蒸馏水定容,用蒸馏水反复冲洗水解管,吸取2 mL于蒸发皿中,水浴蒸干,残留物用2 mL无离子水溶解,再蒸干,反复进行四次,最后蒸干,用2.5 mL 0.02 mol·L-1盐酸溶液溶解,混匀过滤,待用。
色谱条件:梯度洗脱,分离柱柱温57 ℃,反应柱柱温135 ℃,缓冲液流速0. 40 mL·min-1,茚三酮流速0. 35 mL·min-1,通道1:检测波长570 nm,通道2:检测波长440 nm,进样量20 μL。
1.2.6 LC-MS/MS测定氨基酸结构 液相色谱条件:Shim-pack GIS C18(φ2.1 mm×75 mm)色谱柱,进样量0.1 μL;柱温 40 ℃;流速 0.2 mL·min-1;液相色谱分离流动相为0.1% 甲酸-水(A)和0.1%甲酸-乙腈(B),按B:0~8 min,20%~40%;8~13 min,40%~80%;13~18 min,80%~20%进行梯度洗脱。质谱条件:电喷雾电离,正离子,离子喷雾压4 kV;干燥气为氮气,流速10 L/min,温度350 ℃;CID气压为270 kPa;质谱扫描范围为50~1000 Da。
1.3 数据处理
2 结果与分析
2.1 榛子粕抗氧化肽分离纯化
2.1.1 超滤分离 采用截留分子量不同的超滤膜对榛子粕抗氧化肽进行分离,获得三个组分,分别为HMAP3(MW<1 kDa)、HMAP2(5 kDa>MW>1 kDa)、HMAP1(MW>5 kDa)。各组分的DPPH自由基清除率如图1所示,HMAP3、HMAP2、HMAP1组分(3 mg·mL-1)的DPPH自由基清除率分别为80.375%±1.265%、72.205%±1.275%、48.855%±1.025%,且差异显著(p<0.05)。可见,小分子质量的HMAP3组分DPPH自由基清除率最高。
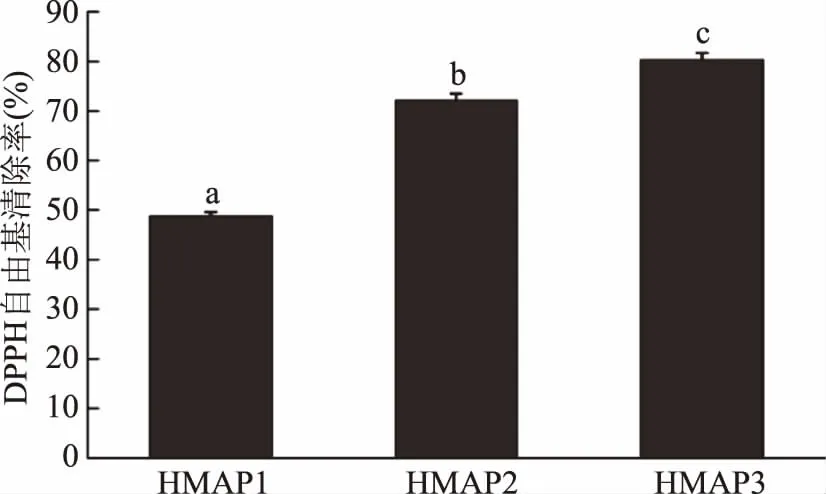
图1 不同超滤组分的DPPH自由基清除率
2.1.2 葡聚糖凝胶纯化 选用分离范围小于700 Da的Sephadex G-10葡聚糖凝胶进一步分离纯化HMAP3组分。HMAP3被分成四个主要组分,分别命名为P1、P2、P3、P4(图2)。P2、P3和P1(1 mg·mL-1)的DPPH自由基清除率高,分别为55.80%±3.025%、54.25%±2.935%、48.115%±2.305%,且差异不显著(p>0.05);P4的DPPH自由基清除率最低,为8.665%±0.385%(图3)。本文以清除率相对较高的P2为研究对象,进一步深入研究。
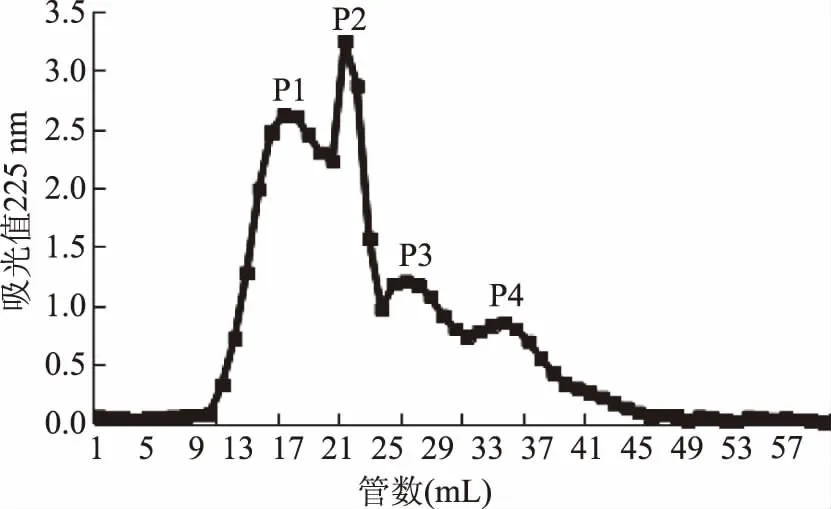
图2 葡聚糖凝胶Sephadex G-10分离纯化HMAP3
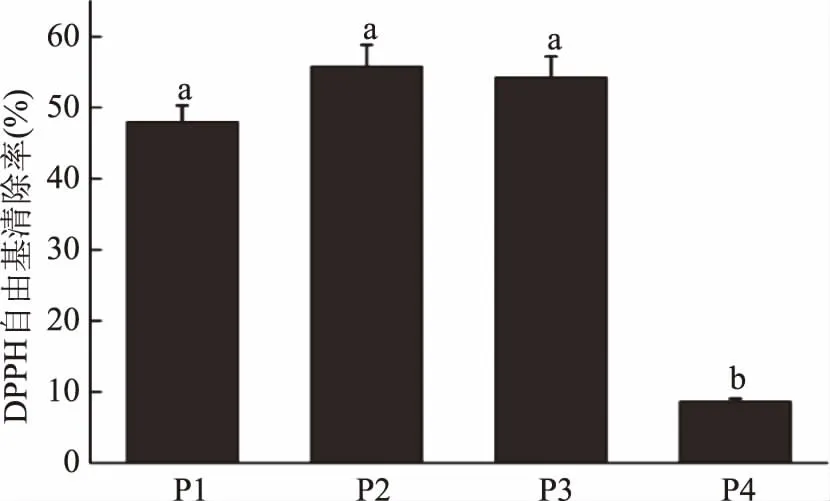
图3 葡聚糖凝胶分离纯化HMAP3后各组分的DPPH自由基清除率
2.2 P2的结构表征
2.2.1 P2的氨基酸组成 本实验主要以DPPH自由基清除率相对较高的P2为研究目标,分别测定榛子粕抗氧化肽和P2组分的氨基酸组成。由表2可知,榛子粕抗氧化肽的主要氨基酸分别为Glu、Arg、Asp、Ala、Leu,疏水性氨基酸占总氨基酸12.21%±0.850%。P2的主要氨基酸分别为Leu、Glu、Val、Tyr、ILe、Arg、Ala、Phe、Asp、Gly。榛子粕抗氧化肽纯化后,氨基酸含量由(42.995±2.005) g/100 g增加到(48.777±0.252) g/100 g,有7种氨基酸含量明显增加,其中包含6种疏水性氨基酸Ala、Val、ILe、Leu、Tyr、Phe,疏水性氨基酸占总氨基酸的56.55%±0.175%。

表2 榛子粕抗氧化肽和P2组分的氨基酸组成及含量
2.2.2 P2的氨基酸序列 利用超高压液相色谱对P2组分进行梯度洗脱,共分有9个峰;然后对每个峰离子强度最高的母离子进行碰撞诱导解析形成二级质谱,进行二级质谱解析。
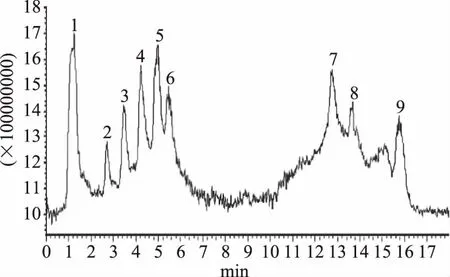
图4 榛子粕抗氧肽P2的超高效液相色谱图
所检测到的9个峰信息见表3,峰1的一级质核比131.15,为单一的氨基酸,Lhor等和Elias等研究表明,单一的氨基酸抗氧化性明显低于短肽的抗氧化性[12-13],故不用做二级质谱的母离子。峰8的一级质核比为814.45,与本实验中Sephadex G-10的分离范围不符,故也不作为二级质谱的母离子。峰2、3、4、5、6、7和9的质谱信息和氨基酸序列分别见表3和图5。

表3 肽P2的离子峰信息
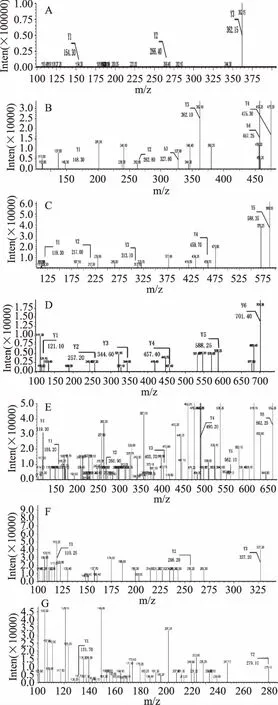
图5 肽P2的质谱图
3 结论与讨论
本实验采用超滤对榛子粕抗氧化肽初步分离,结果表明,相对分子质量小的肽比相对分子质量大的肽抗氧化能力更强,这与前人研究结果相一致[14-17]。相对分子质量小的肽更易参与自由基的氧化应激反应[18-19]。同时,利用Sephadex G-10葡聚糖凝胶将HMAP3分离成4个组分,其中,P2、P3和P1的DPPH自由基清除率高且差异不显著(p>0.05)。本文以清除率相对较高的P2为研究对象,利用超高压液相色谱—串联质谱法测定了其抗氧化短肽的氨基酸序列。P2中共鉴定到7个榛子粕抗氧化肽,其氨基酸序列分别为His-ILe/Leu-Pro(362 Da)、ILe/Leu-Val-Asp-Glu(475 Da)、Thr-Pro-Pro-His-Lys(588 Da)、His-ILe/Leu-His-Ser-Ala-Thr(662 Da)Cys-His-Ser-ILe/Leu-Met-ILe/Leu(701 Da)、Thr-His-Ala(327 Da)、Phe-ILe/Leu(279 Da),含有大量的疏水性(ILe/Leu、Val、Ala、Pro)和芳香性氨基酸(Phe)。有报道表明,疏水性氨基酸和芳香性氨基酸可以提高短肽的抗氧化能力[1,20],Garcia等[21]从樱桃中分离纯化的抗氧化短肽含有大量的疏水性和芳香性氨基酸。Xing等[22]认为疏水氨基酸的疏水基团更易与疏水自由基反应,短肽中的疏水氨基酸ILe/Leu、Val、Ala和Met有较强的自由基清除能力。含有吡咯烷环的疏水性氨基酸Pro更易猝灭单线态氧,因此含有Pro的短肽抗氧化能力更强[23]。芳香性氨基酸Phe和His对肽抗氧化活性也起着重要作用,由于它们含有咪唑环提供质子,起到清除自由基的作用[5]。同时,榛子粕抗氧化短肽还富含His、Met、Cys、Ser、Thr等氨基酸残基。Cys上-SH基团可以直接与自由基发生反应,提高这些氨基酸残基的抗氧化能力[24]。有研究表明,含Met、Cys、His等氨基酸残基的短肽抗氧化能力强[25],特别是含有为自由基提供质子的氨基酸Leu和Met肽抗氧化能力更强[26]。
本实验中,纯化后榛子粕抗氧化肽P2(1 mg·mL-1)的DPPH自由基清除率为55.805%±3.025%,后续实验将对该榛子粕抗氧化肽进一步进行体内抗氧化活性研究,同时,也将对P1和P3组分开展进一步的研究,为深入开发利用榛子粕抗氧化肽提供理论依据。
