2型糖尿病下肢动脉中膜钙化影响因素研究
2018-09-10罗葆明阮镜良
劳 钰 罗葆明 杨 川 任 萌 刘 丹 田 晶 阮镜良 严 励
血管钙化指血管壁内钙盐过量沉积,依据发生部位的不同可分为内膜钙化、中膜钙化、心脏瓣膜钙化、血管钙化防御4种主要类型[1]。中膜钙化发生于动脉的中膜,可独立于内膜钙化存在,在糖尿病患者下肢动脉病变中尤为常见[2-3]。本团队既往研究发现,糖尿病患者下肢动脉中膜钙化检出率较糖耐量正常者高,糖尿病是下肢动脉中膜钙化发生的独立危险因素。但糖尿病下肢动脉中膜钙化的病因及发生机制目前尚未完全明确,促进其发生发展的危险因素鲜有报道。故本研究将结合彩色多普勒超声检查结果初步探讨糖尿病下肢动脉中膜钙化的可能影响因素,为临床糖尿病下肢动脉中膜钙化的有效干预提供参考依据。
1 研究对象
选择在中山大学孙逸仙纪念医院内分泌科住院患者、门诊患者共400例。
纳入标准:年龄30~80岁;同意参与本次研究。
排除标准:①急性高血压、急性心肌梗死、心力衰竭、脑血管意外、手术等应激状态,或有感冒、肺炎等明确严重感染性疾病;②严重肾功能不全长期规律行血液透析或腹膜透析者;③严重肝功能障碍;④有既往服用避孕药、糖皮质激素等药物史;⑤1型糖尿病、特殊类型糖尿病;⑥明确肿瘤病史。
2 研究方法
2.1 入选对象记录资料
2.1.1 临床资料及体格检查 包括姓名、年龄、性别、身高、体质量、体质量指数(Body Mass Indes, BMI)、腰围、臀围、腰臀比、收缩压(Systolic Pressure,SBP)、舒张压(Diastolic Pressure,DBP)、高血压病史、吸烟史,糖尿病病程。
2.1.2 实验室检查结果 糖基化血红蛋白(Glycosylated Hemoglobin,HbA1c)、空腹血葡萄糖(0-hour Fasting Plasma Glucose, GLU-0 h)、餐后2小时血葡萄糖(2-hour Postprandial Plasma Glucose, GLU-2 h)、血尿素氮(Blood Urea Nitrogen, BUN)、血钙(Serum Calcium, Ca)、血磷(Serum Phosphate, P)、血肌酐(Serum Creatinine, SCr)、血尿酸(Uric Acid, UA)、胆固醇(Cholesterol, CHOL)、甘油三酯(Triglyceride, TG)、高密度脂蛋白胆固醇(High Density Lipoprotein Cholesterol, HDL-C)、低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol, LDL-C)、超敏C反应蛋白(High Sensitivity C-reactive Protein, hCRP)。
2.2 下肢动脉彩色多普勒超声检测
采用Esaote MyLab 60(2)彩色多普勒超声仪器,高频探头,频率4~13 MHz,由2位具有丰富下肢动脉彩超检测经验的超声科医师负责为所有患者检测双侧股浅动脉、胫前动脉、胫后动脉、足背动脉,观察平行于动脉走行截图。
3 主要诊断标准
3.1 估算肾小球滤过率(Estimated Glomerular Filtration Rate, eGFR)及慢性肾脏病(Chronic Kidney Disease, CKD)
估算肾小球滤过率使用MDRD公式 eGFR(mL/min·1.73 m2)=170×(Scr)-0.999×(Age)-0.176×(BUN)-0.17×(ALB)+0.318×0.762(女性)[4]; 按照美国肾脏病基金会K/DOQI专家组对CKD分期的建议分期:CKD1期,eGFR水平为≥90;CKD2期,eGFR水平60~89;CKD3期,eGFR水平为30~59;CKD4期, eGFR水平为15~29;CKD5期, eGFR水平为<15。CKD1-2期合并尿蛋白阳性、CKD3期或以上考虑存在慢性肾脏病。
3.2 彩超指标及动脉中膜钙化诊断标准
动脉中膜钙化在超声下表现为血管壁内连续、平滑、线性的高回声,内膜钙化表现为斑片状突出于管腔、不联系、不规则高回声,容易相鉴别(详见图1、图2)。参考Liu KH等[5]研究方法,每条动脉截取病变部位4 cm作为单位观察长度,依据该观察长度里中膜钙化长度评分:0分(未见中膜钙化),1分(0.1 cm
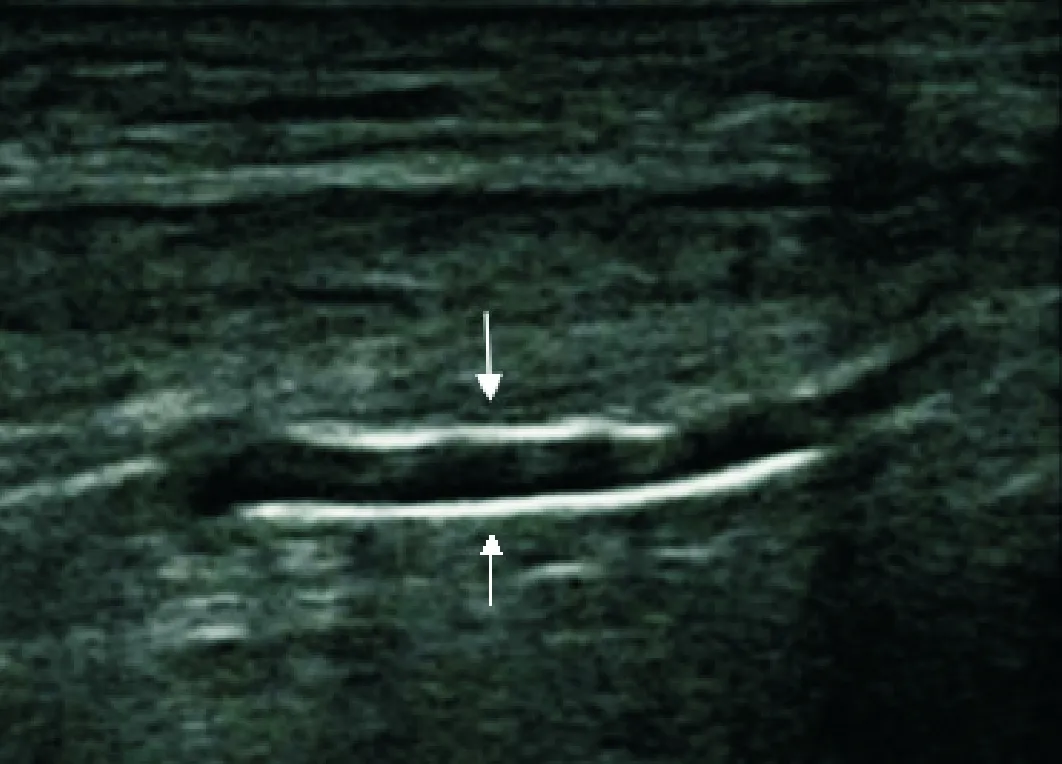
注:箭头所指为钙化部分
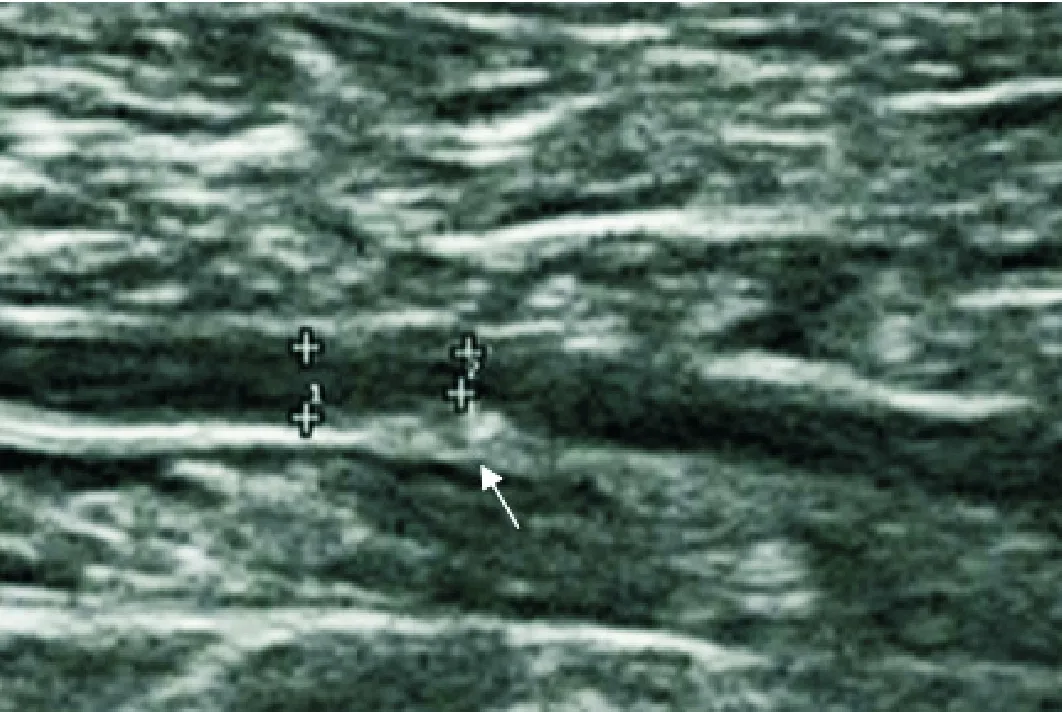
注:箭头所指为钙化部分

图3 53岁女性,左侧足背动脉正常血管壁,中膜钙化严重程度评分为0分
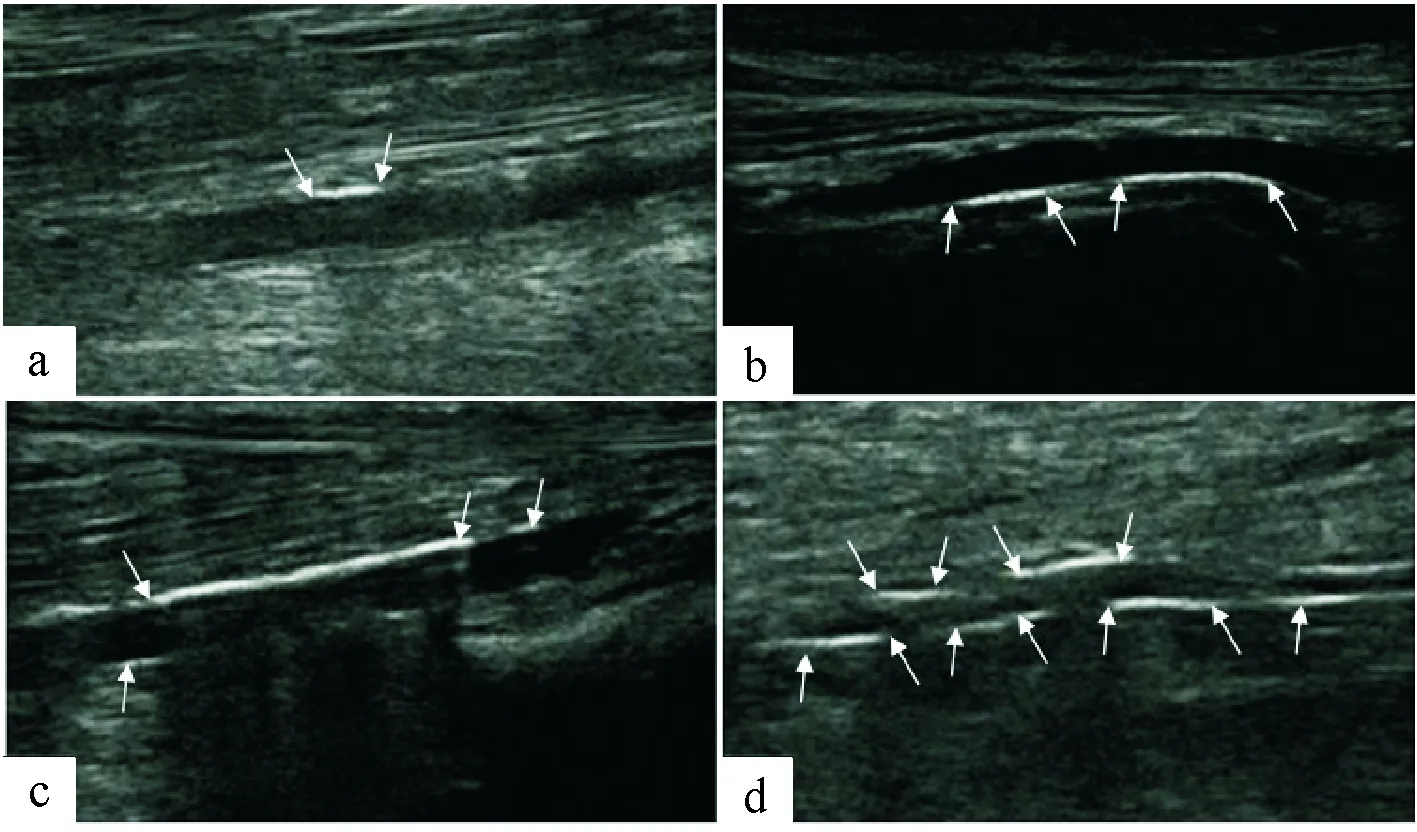
注:箭头所指为测量中膜钙化部分
图4 a.56岁男性左侧胫前动脉,l钙化长度≤1 cm,中膜钙化严重程度评分为1分;b.61岁男性左侧胫前动脉,1 cm
4 统计学方法
5 结果
5.1 总体患者一般资料
研究对象平均年龄(59.1±11.1)岁,男性220例(占55.0%),彩色多普勒超声检出动脉中膜钙化者共207例(占51.8%),详见表1。依据OGTT结果分为糖尿病足(DM group)和糖耐量正常组(NGT group),下肢动脉中膜钙化检出率高;依据下肢动脉是否检出中膜钙化分为中膜钙化组与无钙化组,结果显示两组之间年龄、体质量指数、血肌酐、高密度脂蛋白胆固醇、估算肾小球滤过率比例差异有统计学意义,而收缩压、血钙水平间差异有较明显趋势,然分析结果无统计学意义。各指标水平中体质量指数、估算肾小球滤过率为无钙化组高,其余为钙化组高,详见表2。糖尿病患者膝下动脉中膜钙化检出率高于比膝上动脉(37.7% vs. 31.6%,P<0.001)。另外,糖尿病患者重度中膜钙化检出率也高于糖耐量正常组,详见表3。

表1 本研究患者总体资料 n(%)
注:1)为中位数(四分位数间距P25~P75)表示

表2 糖尿病患者下肢动脉中膜钙化组与无钙化组基本资料比较
注:1)P有统计学意义,2)为中位数(四分位数间距P25~P75)表示,3)单位为mL·min·1.73m-2
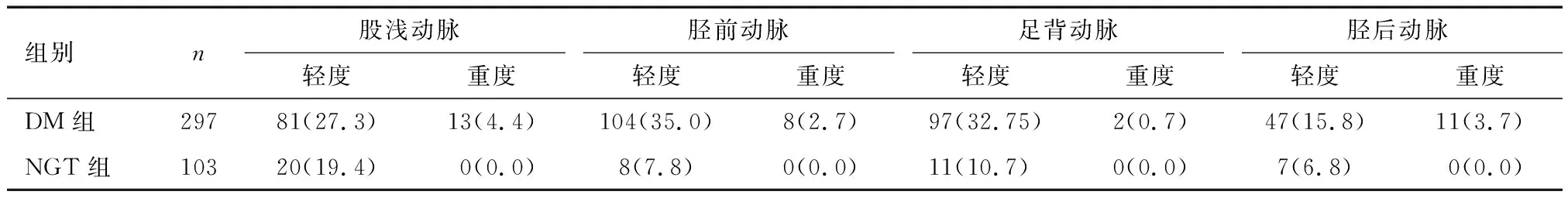
表3 糖尿病组与糖耐量正常组不同动脉中膜钙化严重程度比较 n(%)
5.2 糖尿病患者下肢动脉中膜钙化发生的影响因素分析
以有无下肢动脉中膜钙化为因变量行Logistic回归分析,得出糖尿病是下肢动脉中膜钙化发生的独立危险因素(Odds Ratio,OR), 3.1; 95%(Confidence Interval,CI), 1.6~5.7,P<0.05。将表2中变量与有无下肢动脉中膜钙化行Spearman秩相关分析,得出年龄、体质量指数、收缩压、血肌酐、血钙、高密度脂蛋白胆固醇、估算肾小球滤过率、与有无下肢动脉中膜钙化相关;再使用单因素Logistic回归分析后年龄、体质量指数、血钙、高密度脂蛋白胆固醇符合P<0.10,取上述变量放置于同一回归模型中,以有无下肢动脉中膜钙化为因变量行多因素Logistic回归分析,校正年龄、体质量指数、性别后,年龄、高密度脂蛋白胆固醇与下肢动脉中膜钙化仍存在关联(详见表4)。提示糖尿病患者中增龄、低高密度脂蛋白胆固醇血症可能与下肢动脉中膜钙化的发生相关。相同步骤观察表2中变量与下肢动脉重度中膜钙化的关系,最终取得收缩压放置于同一回归模型,以下肢动脉重度中膜钙化作为因变量行多因素Logistic回归分析,校正年龄、体质量指数、性别后收缩压与下肢动脉重度中膜钙化仍存在关联(详见表5)。提示高收缩压可能是下肢动脉重度中膜钙化发生的影响因素。

表4 糖尿病下肢动脉中膜钙化发生的影响因素筛查
注:1)P有统计学意义,其中r值为相关系数,B值为回归系数

表5 糖尿病下肢动脉重度中膜钙化发生的影响因素筛查
注:1)P有统计学意义,其中r值为相关系数,B值为回归系数
5.3 下肢动脉中膜钙化与内膜钙化
用彩色多普勒超声观察下肢动脉中膜钙化的同时亦收集了内膜钙化的数据,彩色多普勒超声检出下肢动脉内膜钙化有193例(64.8%)。进一步行Spearman秩相关分析得出两者之间存在正性相关关系(r= 0.56,P<0.001),提示两者的发生存在着伴随关系(详见表6)。

表6 下肢动脉内膜钙化与中膜钙化发生的相关性分析
注:1)P有统计学意义
6 讨论
下肢血管病变的防治越来越引起人们的重视。本团队既往研究发现,糖尿病患者下肢动脉中膜钙化检出率高,糖尿病是下肢动脉中膜钙化发生的独立危险因素。糖尿病下肢动脉中膜钙化是糖尿病患者下肢血管病变的重要表现,也是引起糖尿病患者下肢缺血、缺氧的重要原因,应引起高度重视,须及早诊断并予有效干预治疗。
动脉中膜钙化的发生机制仍未明确,其起始于中膜的弹性纤维,钙化环境多无脂质沉淀[2]。中膜钙化可独立于内膜钙化存在,两者的发生机制不完全一致。除了钙磷代谢紊乱、细胞凋亡、细胞外基质降解等可能机制外,目前研究关注的观点认为动脉中膜钙化形成是弹性纤维钙化、成骨信号分子上调促进血管壁内具有分化成骨或软骨细胞潜在能力的间充质细胞迁移增殖并向成骨细胞表型转化,介导异位骨形成的主动调节过程[1, 6-7]。而了解糖尿病下肢动脉中膜钙化发生及严重程度改变的危险因素,对指导治疗有重要的临床意义。
本团队既往研究已发现发现糖尿病为下肢动脉中膜钙化发生的独立危险因素。进一步分析结果提示增龄、高收缩压、低高密度脂蛋白胆固醇血症、进展的慢性肾脏病等影响因素可能参与了糖尿病患者下肢动脉中膜钙化发生以及钙化严重程度向重度中膜钙化发展。
动脉中膜钙化的形成传统机制主要一下几条:①细胞凋亡增多,凋亡小体形成:体外实验发现,凋亡的细胞刺激钙化的发生[6, 8];②钙磷代谢异常:体外实验表明钙、磷可诱导促进细胞凋亡,也会促进细胞外基质矿化[6, 8];③基质的降解或成分改变:血管壁细胞外基质对血管有着保护作用,且基质与血管壁细胞之间的相互作用,可影响细胞的迁移、分化功能,其组成和表达的变化参与血管钙化进程的主动调节[6, 9]。目前研究关注的主要机制认为动脉中膜钙化是在机体双向调节因素失衡状态下,成骨信号传导通路激活,具有分化成骨或软骨细胞潜在能力的间充质细胞(包括血管平滑肌细胞、钙化的血管壁细胞、周皮细胞、循环肝细胞)迁移增殖并向成骨细胞表型转化,并具备分泌碱性磷酸酶(Alkaline Phosphatase, ALP)、合成血管中膜钙化主要成分——羟磷灰石结晶的能力,于血管壁逐渐发展成板状的类骨质[1-2]。传统成骨信号传导通路——骨形态发生蛋白(Bone Morphogenetic Proteins, BMPs)信号通路与Wnt信号通路,在骨形成过程中,能够促进成骨细胞分化,促进成骨细胞分泌的细胞外基质矿化[10-12]。在动脉管壁中上述两条信号通路激活可以使间充质细胞分化成为成骨细胞,介导血管钙化形成;细胞实验中抑制上述通路信号传导可有效控制动脉中膜钙化的发生发展[11, 13-14]。外周血核因子κB受体因子(Receptor Activator of Nuclear Factor Kappa B,RANK)是破骨细胞表面分泌的Ⅰ型膜蛋白,通过与其上游配体RANKL相互作用调节破骨细胞的分化、激活及存活;骨保护素(Osteoprotegerin, OPG)则是由成骨细胞分泌,作为诱捕受体与RANKL结合,抑制RANK信号传导[15]。研究发现,在多种炎症因子的刺激与作用下,血管内皮细胞可分泌RANKL,激活血管平滑肌细胞成骨化分化,并与RANK相互作用,促进新生血管形成及动脉钙化[15-16]。
本次研究中糖尿病患者中糖尿病病程、血糖控制情况(如糖基化血红蛋白、静脉血葡萄糖等)、血胰岛素水平、炎症指标(超敏C反应蛋白)等均未得出与下肢动脉中膜钙化的相关关系,考虑原因为本研究属于横断面研究,不能完全体现既往病程中各项变量的水平,而下肢动脉中膜钙化的发生发展是一个慢性的过程。另外,糖尿病患者下肢动脉中膜钙化的发生发展还可能与高血糖“代谢记忆”有关。由于中国人群普遍缺乏体检意识及医从性差,糖尿病发现晚、血糖控制欠佳,故病情控制后下肢动脉中膜钙化仍可发生或继续发展[17]。因此,相关变量与下肢动脉中膜钙化的关系有待进一步前瞻性研究再予分析。
增龄导致动脉中膜钙化发生发展的可能原因有随着年龄增长,管壁内弹性纤维退行性变发生矿化,平滑肌细胞凋亡增多、凋亡小体形成;另一方面,年龄也反映了动脉中膜在其他影响因素中的累积暴露[18]。
高血压患者(尤其是高肾素型高血压)常存在肾素-血管紧张素-醛固酮系统功能障碍,醛固酮可通过刺激Wnt信号通路诱导动脉管壁血管平滑肌细胞成骨样转变[19]。本研究糖尿病患者只有高收缩压与下肢动脉重度中膜钙化的发生相关,舒张压、高血压病史等均无提示其与下肢重度中膜钙化之间存在相关关系。原因考虑可能由于本研究中入组对象大部分存在动脉硬化、血管弹性减弱导致舒张压不高;而高血压患者病程、是否服用药物治疗、治疗效果等混杂因素存在,需要完善资料、跟踪随访,以改善样本偏性后再行进一步分析。
脂肪代谢紊乱也是糖尿病病理生理特点,高密度脂蛋白胆固醇降低为主要表现之一。既往研究认为,高密度脂蛋白胆固醇具有抗动脉硬化作用;体外细胞实验显示未发生氧化修饰的高密度脂蛋白胆固醇可有抑制血管钙化的作用[20]。同时,高密度脂蛋白胆固醇水平降低常伴有血循环中瘦素水平升高,瘦素水平升高可上调BMPs成骨信号通路,刺激血管壁平滑肌细胞分化为成骨细胞,介导血管钙化形成[2]。
糖尿病患者常合并肾损害,慢性肾脏病患者常伴有钙磷代谢异常,血磷水平升高可促进血管平滑肌细胞表型转化[2]。另外,慢性肾脏病患者常合并骨质疏松症。RANK/RANKL/OPG之间的平衡是维持机体内钙分配稳定的重要机制之一。机体内钙的分配不平衡可导致其从骨质转移至动脉壁形成异位钙化,同时血管内皮细胞分泌RANKL可激活血管平滑肌细胞成骨化分化,并与RANK相互作用促进动脉中膜钙化形成[15, 21]。
本研究中,下肢动脉中膜钙化组血钙水平较无钙化组低(P=0.05),但回归分析结果无统计学意义,提示本研究结果未显示血钙水平与糖尿病下肢动脉中膜钙化的发生之间存在关联。既往研究通过动物实验、细胞实验证实,严重的动脉钙化往往伴随升高的血钙浓度,而细胞内、外钙浓度升高可诱导血管壁平滑肌细胞成骨样转变,促进血管钙化[22]。然而也有研究发现,钙磷代谢异常并非糖尿病中膜钙化的发生的必要因素[23]。因此,血钙与糖尿病下肢动脉中膜钙化间关系有待扩大样本量、排除如肾功能等因素影响后再行分析。
另外,吸烟、男性、高血尿酸水平等均有研究发现与动脉内膜钙化或全血管壁钙化(包含内膜钙化及中膜钙化)的发生相关[24-25]。但本研究结果未显示上述变量与下肢动脉中膜钙化发生之间存在关联。考虑本次研究为横断面研究、整体样本数量少、入组对象男性比例多等情况,须进一步扩大样本量分析再行分析上述指标是否糖尿病患者下肢动脉中膜钙化发生发展的危险因素。
本研究还发现下肢动脉中膜钙化的发生与内膜钙化存在正性相关关系。动脉内膜钙化发生发展机制与动脉中膜钙化不完全一致,但两者之间存在共享机制。糖尿病共同的病理生理因素刺激作用可加快病变进展,两者在下肢动脉病变的发生发展中可能起着协同的作用。
7 结论
增龄、高收缩压、低高密度脂蛋白胆固醇血症等影响因素可能参与了糖尿病患者下肢动脉中膜钙化发生以及钙化严重程度向重度中膜钙化发展。本研究发现糖尿病下肢动脉中膜钙化影响因素提醒临床上可予以相应的防治措施,然其中的作用机制尚不明确,有待完善前瞻性及动物、细胞学实验研究后进一步明确。糖尿病下肢动脉内膜钙化与中膜钙化发生发展的具体关系及两者对糖尿病下肢动脉病变、糖尿病足病情发展、预后的影响有待进一步前瞻性研究。
