脯氨酸衍生物催化蒽酮与硝基烯烃的不对称Michael加成反应
2018-09-08赵美君王黎明吴淑宝朴惠顺
赵美君,王黎明,丁 吉,吴淑宝,朴惠顺*,金 瑛*
(1.延边大学药学院,吉林 延吉 133000;2.吉林医药学院药物化学教研室,吉林 吉林 132013)
Michael 加成反应是有机合成中构建C-C键的重要方法之一,近年来许多手性有机小分子催化剂被应用于各类底物的不对称Michael加成反应[1-3]。蒽酮化合物作为亲核试剂用于不对称Michael加成反应的文献报道则较少[4-9]。2007年,SHI[5]首次报道了金鸡纳碱有机催化的蒽酮与β-硝基烯烃的不对称Michael加成反应,得到了80%~99%ee的对映选择性[10]。近年来,YUAN[7]和HE[8]分别报道了硫脲类催化剂在该反应中的应用。2001年,LIST首次报道了L-脯氨酸催化环己酮与硝基苯乙烯的Michael加成反应,开创了有机小分子催化不对称Michael加成反应的先河[9],此后,大量的脯氨酸衍生物被应用于不对称Michael加成反应[10-15]。但是,脯氨酸衍生物催化蒽酮与硝基烯烃的Michael加成反应未见报道。为扩大该反应的催化剂类型,本研究将脯氨酸衍生物催化剂1a~1f用于蒽酮与硝基苯乙烯的不对称Michael加成反应。
1 材料与方法
1.1 试剂和仪器
Bruker Avance-500型核磁共振谱仪(均以CDCl3为溶剂,TMS为基准物质,德国Bruker公司);MICROMASS Quattro Premier型质谱仪(美国Waters公司);LC-20A高效液相色谱仪(日本岛津公司),Daicel Chiralpak AD-H,Chiralcel OD-H手性色谱柱(日本大赛璐公司)。脲及硫脲衍生物为上海大赛璐药物手性技术(上海)有限公司产品,其他试剂均为市售分析纯产品。
1.2 不对称Michael加成反应
于5 mL圆底烧瓶中依次加入反式硝基苯乙烯(29.8 mg,0.2 mmol),催化剂(0.01 mmol),蒽酮(46.6 mg,0.24 mmol),甲苯3.0 mL,室温搅拌反应12~18 h,TLC监测。反应完毕后,经硅胶柱层析分离,Hex∶EtOAc(9∶1)洗脱,得到产品3a~3i。
10-(2-硝基-1-苯基乙基)-10H-蒽-9-酮3a:1H NMR(500 MHz,CDCl3)δ 8.07(d,J=8.0 Hz,1H),7.98(d,J=8.0 Hz,1H),7.67~7.59(m,2H),7.53~7.46(m,2H),7.45~7.40(m,2H),7.17~7.13(m,1H),6.95(t,J=7.5 Hz,2H),6.05(d,J=8.0 Hz,2H),4.89(dd,J=9.0,13.0 Hz,1H),4.60(dd,J=7.0,13.0 Hz,1H),4.55(d,J=3.5 Hz,1H),4.08~4.04(m,1H);HPLC(Daicel Chiralpak AD-H,Vhex∶ViPrOH=97∶3,0.6 mL/min,254 nm),tR:45.9 min(major),51.6 min(minor)。
10-[1-(2-氟苯基)-2-硝基乙基]-10H-蒽-9-酮3b:1H NMR(500 MHz,CDCl3)δ 8.13(d,J=7.5 Hz,1H),8.07(d,J=7.5 Hz,1H),7.66~7.61(m,1H),7.57~7.49(m,3H),7.48~7.44(m,1H),7.26~7.18(m,2H),6.88~6.78(m,2H),6.07(t,J=7.5 Hz,1H),4.74(dd,J=8.0,13.5 Hz,1H),4.60(d,J=9.0,1H),4.54(dd,J=8.0,13.5 Hz,1H),4.39~4.35(m,1H);HPLC(Daicel Chiralpak AD-H,Vhex∶ViPrOH=97∶3,0.6 mL/min,254 nm),tR:54.4 min(major),64.1 min(minor)。
10-[1-(2-氯苯基)-2-硝基乙基]-10H-蒽-9-酮3c:1H NMR(500 MHz,CDCl3)δ 8.18(d,J=7.5 Hz,1H),8.15(d,J=7.5 Hz,1H),7.70~7.64(m,2H),7.54~7.51(m,1H),7.47~7.43(m,1H),7.42~7.35(m,2H),7.23~7.19(m,1H),7.02(t,J=7.5 Hz,1H),6.80(d,J=7.0 Hz,1H),6.23(d,J=8.0 Hz,1H),4.72(bs,1H),4.66(d,J=3.5 Hz,1H),4.44~4.38(m,2H);HPLC(Daicel Chiralpak AD-H,Vhex:ViPrOH=97:3,0.6 mL/min,254 nm),tR:33.4 min(major),53.9 min(minor)。
10-[1-(2-溴苯基)-2-硝基乙基]-10H-蒽-9-酮3d:1H NMR(500 MHz,CDCl3)δ 8.22~8.18(m,2H),7.80(bs,1H),7.71~7.68(m,1H),7.61(d,J=6.5 Hz,1H),7.55(t,J=7.5 Hz,1H),7.49~7.45(m,1H),7.38(t,J=7.5 Hz,1H),7.17~7.13(m,1H),7.07(t,J=7.5 Hz,1H),6.72~6.71(m,1H),6.25(dd,J=1.5,8.0 Hz,1H),4.73(bs,1H),4.72(s,1H),4.36(d,J=6.0 Hz,2H);HPLC(Daicel Chiralpak AD-H,Vhex∶ViPrOH=97∶3,0.6 mL/min,254 nm),tR:42.3 min(major),61.9 min(minor)。
10-[1-(3-氟苯基)-2-硝基乙基]-10H-蒽-9-酮3e:1H NMR(500 MHz,CDCl3)δ 8.09(d,J=7.5 Hz,1H),8.02(d,J=7.5 Hz,1H),7.69~7.59(m,2H),7.55~7.40(m,4H),6.98~6.82(m,2H),5.88(d,J=7.5 Hz,1H),5.80~5.76(m,1H),4.86(dd,J=8.5,13.5 Hz,1H),4.59(dd,J=8.5,13.5 Hz,1H),4.55(d,J=3.5 Hz,1H),4.08~4.02(m,1H);HPLC(Daicel Chiralpak AD-H,Vhex∶ViPrOH=97∶3,0.6 mL/min,254 nm),tR:65.9 min(major),71.9 min(minor)。
10-[1-(3-甲基苯基)-2-硝基乙基]-10H-蒽-9-酮3f:1H NMR(500 MHz,CDCl3)δ 8.06(d,J=8.0 Hz,1H),7.97(d,J=8.0 Hz,1H),7.66~7.58(m,2H),7.52~7.47(m,2H),7.43~7.38(m,2H),6.95(d,J=7.5 Hz,1H),6.82(t,J=7.5 Hz,1H),5.86(d,J=7.5 Hz,1H),5.77(s,1H),4.85(dd,J=9.0,13.0 Hz,1H),4.57(dd,J=7.0,13.5 Hz,1H),4.52(d,J=3.5 Hz,1H),4.01~3.98(m,1H),2.02(s,3H);HPLC(Daicel Chiralpak AD-H,Vhex∶ViPrOH=97∶3,0.6 mL/min,254 nm),tR:36.1 min(major),53.0 min(minor)。
10-[1-(4-氟苯基)-2-硝基乙基]-10H-蒽-9-酮3g:1H NMR(500 MHz,CDCl3)δ 8.08(d,J=7.5 Hz,1H),8.00(d,J=7.5 Hz,1H),7.67~7.60(m,2H),7.53~7.42(m,4H),6.64(d,J=7.5 Hz,2H),6.02~5.99(m,2H),4.87(dd,J=9.0,13.0 Hz,1H),4.59~4.52(m,2H),4.06~4.02(m,1H);HPLC(Daicel Chiralpak AD-H,Vhex∶ViPrOH=97∶3,0.6 mL/min,254 nm),tR:53.3 min(major),58.6 min(minor)。
10-[1-(4-氯苯基)-2-硝基乙基]-10H-蒽-9;酮3h:1H NMR(500 MHz,CDCl3)δ 8.11(d,J=8.0 Hz,1H),8.03(d,J=8.0 Hz,1H),7.68~7.59(m,2H),7.54~7.44(m,3H),7.40(d,J=7.5 Hz,1H),6.95(d,J=8.5 Hz,2H),6.02(d,J=8.0 Hz,2H),4.85(dd,J=8.5,13.0 Hz,1H),4.57~4.52(m,2H),4.06~4.02(m,1H);HPLC(Daicel Chiralpak AD-H,Vhex∶ViPrOH=97∶3,0.6 mL/min,254 nm),tR:41.9 min(major),47.5 min(minor)。
10-[1-(4-甲基苯基)-2-硝基乙基]-10H-蒽-9-酮3i:1H NMR(500 MHz,CDCl3)δ 8.08(d,J=7.5 Hz,1H),8.00(d,J=7.5 Hz,1H),7.67~7.58(m,2H),7.53~7.49(m,2H),7.45~7.38(m,2H),6.76(d,J=8.0 Hz,2H),5.96(d,J=8.0 Hz,2H),4.84(dd,J=9.0,13.0 Hz,1H),4.57~4.52(m,2H),4.05~4.00(m,1H),2.22(s,3H);HPLC(Daicel Chiralpak AD-H,Vhex∶ViPrOH=97∶3,0.6 mL/min,254 nm),tR:34.0 min(major),36.3 min(minor)。
2 结果与讨论
2.1 催化剂1a~1f催化不对称Michael加成反应
将催化剂1a~1f用于反式硝基苯乙烯与蒽酮的不对称Michael加成反应,以甲苯为溶剂,室温反应,考察催化剂的催化性能。反应条件:反式硝基苯乙烯0.1 mmol,蒽酮0.3 mmol,催化剂0.01 mmol,甲苯0.5 mL。结果见表1。
由表1结果可以看出,6种脯氨酸衍生物催化剂均能以很高的产率(80%~98%),顺利地催化反式硝基苯乙烯和蒽酮的不对称Michael加成反应。其中催化剂1b催化该反应得到了最好的立体选择性(67%ee,样品2)。主要产品的构型,通过测定旋光值,对比文献报道[5]的旋光值确定主要产物的构型为S型。

表 1 不对称Michael加成反应结果
a分离产率;b高效液相色谱法手性AD-H色谱柱测定
2.2 反应条件的优化
将上述最好的催化剂1b用于反式硝基苯乙烯与蒽酮的不对称Michael加成反应中,反应条件:反式硝基苯乙烯0.1 mmol,蒽酮0.3 mmol,催化剂0.01 mmol,溶剂0.5 mL。考察溶剂、温度、催化剂用量等因素对反应立体选择性的影响,优化反应条件,以期获得更好的催化剂体系。结果如表2所示。
由表2可以看出:1)溶剂对反应的立体选择性有显著影响,甲苯是最佳溶剂得到了65%ee的对映选择性(样品1),而四氢呋喃作为溶剂仅得到了15%ee的立体选择性(样品6);2)降低温度对反应的立体选择性没有改善,将温度由室温将至0 ℃和-20 ℃,反应产率及产品的ee值均有所降低(样品7、8对比1);3)催化剂的用量由10 mol%增加至20 mol%或降至5 mol%,反应的立体选择性有所降低(样品9、10对比1)。综上所述,筛选出的最佳催化剂体系为:10 mol%的催化剂1b,甲苯为溶剂,室温反应。
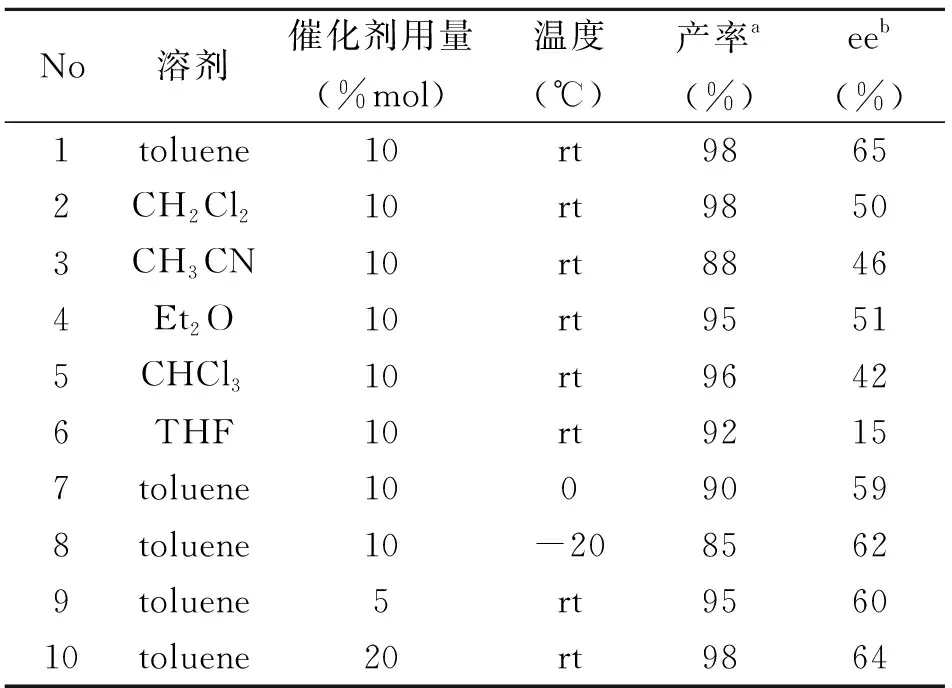
表 2 不对称Michael加成反应条件筛选
a分离产率;b高效液相色谱法手性AD-H色谱柱测定
2.3 底物的扩展
将筛选出的最佳催化条件应用于不同取代反式β硝基苯乙烯的不对称Michael加成反应中,反应条件:反式硝基苯乙烯0.1 mmol,蒽酮0.3 mmol,催化剂0.01 mmol,甲苯0.5 mL。考察催化剂体系的普适性。结果见表3。
结果表明催化剂对不同取代反式硝基苯乙烯与蒽酮的不对称Michael加成反应大部分能够顺利进行,以很高产率(88%~98%)得到相应的产品。但是4-OCH3取代的反式硝基苯乙烯为底物的反应未能进行,延长反应时间也没有产品生成,可见强供电子取代基对反应不利。筛选的催化剂体系在该反应中表现出优良的立体选择性。其中,以4-F取代硝基烯烃为底物的反应得到了最高的立体选择性(66%ee,样品7)。2-溴取代底物得到了最差的立体选择性(48%ee,样品4)。
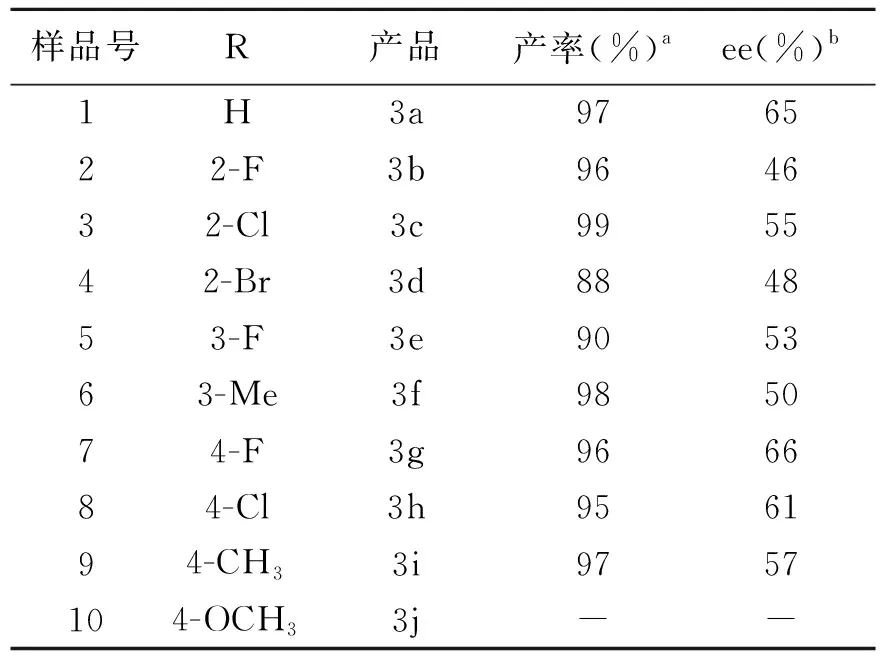
表 3 蒽酮和不同硝基烯烃的不对称Michael加成反应
a分离产率;b高效液相色谱法手性AD-H色谱柱测定
3 结 论
本研究首次将脯氨酸衍生物催化剂用于蒽酮与反式β-硝基烯烃的不对称Michael加成反应中,考察了溶剂、温度等的因素对反应立体选择性的影响,筛选出最佳的催化体系为:10 mol%的催化剂1b,甲苯为溶剂,室温反应,并将其应用于不同取代反式硝基苯乙烯的反应,得到很好的化学产率和最高达68%ee的立体选择性。
