体外长期培养的人神经干细胞对大鼠帕金森病模型的药效初探
2018-08-15陈世明董文心章瑾宣丹英顾丰华毛钟鸣陈婕美陈嘉刘翔陈鹏翾赵烨
陈世明,董文心,章瑾,宣丹英,顾丰华,毛钟鸣,陈婕美,陈嘉,刘翔,陈鹏翾,赵烨
帕金森病(Parkinson's disease,PD)是一种发生在中老年期常见的神经系统变性疾病,以中脑黑质多巴胺能(dopamine,DA)神经元变性坏死和纹状体区多巴胺能神经元水平减少为主要病理特点[1]。目前临床上的治疗方法都只能改善症状,无法阻止病情的发展。因此一些细胞移植的创新疗法成为近年来研究热点[2-3]。
人神经干细胞(human neural stem cells,hNSCs)存在于神经系统中,是一类具有自我更新复制,能分化为神经元、星型胶质细胞和少突胶质细胞的多潜能干细胞[4-5]。神经干细胞通过体外扩增培养,移植到病人体内,向神经系统病变部位趋行、聚集,并存活、增殖、分化为神经元和胶质细胞,从根本上补充缺失和缺损的多巴胺能神经元,成为治疗神经系统损伤和神经退行性疾病的新方法[6-7]。但由于技术原因,神经干细胞在体外培养存在易分化和易死亡的技术难题[8-9],目前获取途径主要是从胚胎或流产胎儿中分离并进行有限的扩增培养,这样的神经干细胞来源混杂,无法达到标准化,且存在着伦理问题。因而如何确保神经干细胞来源稳定、标准、用之不竭成为临床治疗帕金森病的关键[10-11]。本研究从流产胎儿中分离神经干细胞,在体外长期规模化培养和扩增,并探讨是否能改善帕金森模型大鼠旋转行为及其移植后脑内存活和分化情况,解决临床上人神经干细胞治疗帕金森病细胞来源困难这一关键问题。
1 材料和方法
1.1 材料
1.1.1 主要试剂 DMEM/F-12(1∶1)培养基购自美国 Hyclone 公司;重组人表皮细胞生长因子(rhEGF)、重组人碱性成纤维细胞生长因子(rhbFGF)、N2 神经细胞生长添加剂、B27、胰酶(TP-EDTA)均购自美国 Gibco 公司;6-羟基多巴胺(6-OHDA)、阿扑吗啡购自美国 Sigma 公司;水合氯醛、抗坏血酸购自国药集团化学试剂有限公司;胎牛血清购自浙江天杭生物科技有限公司。
1.1.2 实验动物 健康雄性 Wistar 大鼠 120只,体重约 300 g,购自上海斯莱克实验动物有限责任公司,许可证号:2007000535474。在二级清洁级大鼠饲养环境下饲养。
1.2 方法
1.2.1 PD 大鼠模型的建立 110 只大鼠经反复行为检测确认其无旋转行为。腹腔注射 12% 水合氯醛(0.3 ml/100 g)麻醉后,将大鼠固定于三维脑立体定向仪上。手术区域皮肤消毒,皮正中切口,暴露前囟,使用微量注射器将 6-OHDA 分两点(每点 2 μg/4 μl)注射进入脑内黑质致密体部位(参照Paxinos 和 Watson 鼠脑立体定位图谱)。注射位点:第 1 点:前囟后 5.2 mm,旁开 2.2 mm,颅骨下 8.3 mm(黑质-致密体部);第 2 点:前囟后5.2 mm,旁开 2.2 mm,颅骨下 7.8 mm(黑质-网状-背内侧层)。术毕,大鼠连续 5 d 肌肉注射青霉素以防感染,并单只单笼饲养至实验结束。于术后7、15、22 及 30 d 分别腹腔注射阿扑吗啡诱发大鼠向健侧单向旋转,并进行旋转行为检测。计数30 min,以旋转圈数 > 7 次/min 的大鼠作为成功模型。
1.2.2 细胞移植 根据文献[12-13]连续培养12 个月的神经干细胞球,加 0.25% TP-EDTA 消化液消化,离心,弃上清液,加 DMEM/F-12 重悬细胞并计数;取神经分化细胞,加 0.25% TP-EDTA 消化液消化,离心,弃上清液,加 DMEM/F-12 重悬细胞计数。
将 PD 成功模型大鼠随机分为 NSC 高剂量组(细胞浓度为 1.0 × 107/ml)、NSC 低剂量组(细胞浓度为 0.2 × 107/ml)、NSC 混合组(0.2 × 107/ml的神经干细胞 + 1.0 × 106/ml 的神经分化细胞)和生理盐水对照组。PD 模型大鼠在移植前 1 d进行旋转测试,并经口灌胃给予大鼠环孢菌素(10 mg/kg),连续给药 3 d。PD 模型大鼠经腹腔注射 12% 水合氯醛(0.3 ml/100 g)麻醉后,将大鼠固定于三维脑立体定向仪上。手术区域皮肤消毒,皮正中切口,暴露前囟,使用微量注射器将人神经干细胞分 2 点(每点 4 μl)注射进入脑内纹状体部位。第 1 点:前囟前 1.0 mm,旁开 2.5 mm,颅骨下 4.5 mm;第 2 点:前囟前 1.0 mm,旁开2.5 mm,颅骨下 5.5 mm。术毕大鼠连续 5 d 肌肉注射青霉素以防感染。对照组大鼠采用相同于治疗组的操作方法,在纹状体相应靶点注射等剂量的生理盐水。
1.2.3 行为学检测 神经干细胞移植 10 d 后,对每只大鼠进行旋转测试,计数 30 min。此后 3 个月内,第 2、4、5、6、8、9 周各计数 1 次,共计数 6 次。
1.2.4 脑组织切片染色 大鼠以 12% 水合氯醛(0.3 ml/100 g)麻醉后,颈部手术区域剃毛消毒。颈部正中切口,分离一侧颈部总动脉并插管,经插管向脑部灌流 4% 多聚甲醛溶液,断头取脑。用4% 多聚甲醛固定 20 min,PBS 洗 3 次,每次5 min;0.3% TritonX-100 作用 20 min,PBS 洗3 次,每次 5 min;10% 羊血清封闭 50 min,吸弃多余血清,加 MAP-2 一抗,4 ℃ 湿盒孵育过夜,PBS 洗 3 次,每次 5 min;滴加二抗(荧光标记),室温 50 ~ 60 min,PBS 洗 3 次,每次 5 min;甘油封片。倒置显微镜观察实验结果。
1.3 统计学处理
应用 Statistica 6.0 统计软件对移植组和对照组的组内及组间旋转行为测试结果进行分析,数据以±s表示,组内、组间均采用t检验,以P< 0.05 为具有统计学意义。
2 结果
2.1 PD 大鼠模型的建立
造模后大鼠存活率为 75.5%。1 个月后做旋转测试,存活大鼠造模成功率为 39.8%。模型成功鼠脑组织切片证实大鼠注药侧黑质纹状体区神经元染色明显减少,有 PD 特征性改变(图 1)。说明通过该方法建立的大鼠 PD 模型较稳定,可进行神经干细胞移植实验。
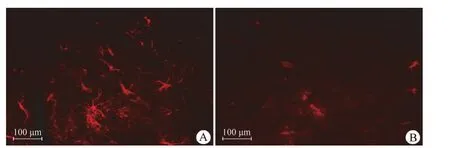
图 1 健康大鼠黑质部位(A)和模型大鼠 6-OHDA 毁损侧黑质部神经(B)Figure 1 Substantia nigra neurons of healthy rat (A) and substantia nigra neurons was damaged by 6-OHDA (B)
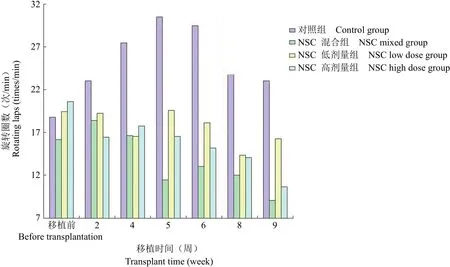
图 2 PD 模型大鼠旋转行为的改变情况Figure 2 Changes of rotational behavior-induced by apomorphine in PD model rats in four groups

图 3 模型大鼠干细胞纹状体移植侧神经元(A:× 40;B:× 100;C:× 200)Figure 3 Substantia nigra neurons after the cell transplantation (A: × 40;B: × 100;C: × 200)
2.2 神经干细胞移植
神经干细胞移植 3 个月内,各组仅出现 1 只大鼠在不同时间点死亡,存活率为82.2%。说明神经干细胞移植方法成熟,动物存活率高。
2.3 PD 模型大鼠行为学的改变
神经干细胞移植 10 d 后,每周做旋转测试,其中 42.9% 的 PD 模型大鼠在移植 10 d 后均出现了行为学的改善。在随后的 3 个月内,其余大鼠旋转次数也明显减少,且有进一步改善的趋势。而生理盐水对照组,大鼠旋转次数没有明显变化。NSC 高剂量组移植 8 周后与移植前比较有显著性差异(P< 0.05);其余各组移植前后比较均无显著差异(P> 0.05)。组间比较,PD 模型大鼠移植前相互比较无显著性差异(P> 0.05);NSC 混合组移植后 5、6、8、9 周与对照组比较有显著性差异。(P< 0.05);NSC 低剂量组移植后 6、8 周与对照组比较有显著性差异(P< 0.05);NSC 高剂量组移植后 6、8 周与对照组比较有显著性差异(P<0.05),详见图 2。
2.4 大鼠脑组织 MAP-2 抗体标记神经元切片结果
脑内定点移植 hNSCs 的 PD 大鼠模型,在纹状体移植侧可见一明显针道,针道两侧明显可见MAP-2 抗体标记的神经元,即移植存活的干细胞,(图 3),说明植入大鼠纹状体的 hNSCs 存活,且能分化为神经元。
3 讨论
干细胞是一类具有自我复制能力和多向分化潜能的细胞,是人体的种子细胞,被医学界称为“万用细胞”。以干细胞治疗为核心的再生医学,在神经、血液、心血管、生殖等系统和肝、肾、胰等器官的重大疾病治疗方面发挥作用,其中神经干细胞对神经系统的损伤修复和神经退行性疾病治疗方面展现出惊人的潜力[14]。与诱导性多能干细胞及间充质干细胞移植相比,人神经干细胞解决了潜在的致癌性、组织相容性和表观遗传性变异等问题[15-16],但神经干细胞自身存在来源困难和数量有限的难题,因此临床治疗工作还是难以开展。本研究从流产胎儿中分离出神经干细胞,在体外连续扩增培养长达 12 个月,遗传性稳定[12],可为神经干细胞移植提供可靠、用之不竭的细胞来源。体外培养 12 个月的神经干细胞球分化后,可见典型的神经元形态及新型胶质细胞形态,可判断此类细胞仍具有良好的增殖和分化能力。
帕金森病(PD)是一种起病隐匿的中枢神经系统变性疾病,主要特点为中脑黑质多巴胺能神经元的变性死亡,导致纹状体内乃至黑质的多巴胺能神经末梢减少,从而引起震颤、肌肉僵直、运动迟缓等一系列综合症状[17]。但是动物不会自然发生该病,因此,研究中需要建立大鼠 PD 模型。PD 大鼠模型的制备是采用颅内定位注射 6-OHDA,减少黑质 DA 神经元的数量,模拟人 PD 病理、行为学的改变,判定 PD 大鼠模型的成功[18-19]。本研究成功建立了大鼠 PD 模型,然后将长期连续培养的hNSCs 采用立体定向技术注射进入脑内纹状体部位,连续 3 个月观察移植后 PD 模型大鼠的旋转行为,证实了神经分化细胞联合神经干细胞移植更有利于 PD 的治疗。这与神经分化细胞能够分泌神经营养因子(BDNF),促进神经干细胞的存活和分化有关[20-21]。结果表明,hNSCs 能持续数月在大鼠脑内发挥作用,降低 PD 模型大鼠的旋转次数,达到改善 PD 症状的目的。而在用神经干细胞治疗PD 模型大鼠的实验中,治疗效果与移植细胞的种类和数量密切相关。
本研究用于移植的 hNSCs,在体外未经任何特殊处理,但通过 MAP-2 抗体对神经元进行标记,在纹状体移植侧发现了神经元,即移植存活的hNSCs,可推测脑内含有诱导神经干细胞分化成DA 神经元的机制。实验中被移植的大鼠没有出现明显的排斥反应,也无炎症反应,说明 hNSCs 免疫排斥反应小,适合长期在受体中存活,能起到细胞替代作用,此外,移植后该细胞还可以分化成 DA神经元,在 PD 诊疗方面具有很大的应用价值。
然而,本次研究仅仅在移植部位发现了存活和分化的 hNSCs,未观察到移植 hNSCs 向周围脑组织的迁移现象。在接下来的研究中,应对未迁移的原因及移植后多巴胺能神经元的存活时间做进一步的探讨,挑选出 hNSCs 移植的最佳部位、最佳时间和生存环境,为临床治疗帕金森病提供更有力的依据。
