红薯糯米酒发酵与贮存阶段品质分析
2018-08-09肖国生曲留柱刘美丽
陈 林, 肖国生, 顾 欣, 曲留柱, 李 迪, 刘美丽
(重庆市生物与食品基础实验教学中心/渝东北特色生物资源开发利用工程中心/重庆三峡学院生物与食品工程学院,重庆 404100)
红薯含有丰富的淀粉和膳食纤维,在我国主要用作辅助食品或动物饲料,其深加工产品相对较少,因而其功能性并未完全开发[1]。红薯酒又称地瓜酒、番薯酒,其保健功效在20世纪80年代得到一些学者的实验证实[2]。红薯酒在农村地区较为常见,其口味甘甜、质地清冽,但酒度高、易醉。糯米富含淀粉,其中糯淀粉米中支链淀粉占98% ~99%,具有易吸水糊化、易糖化的特点,因此也常被用来酿酒[3-4]。由于淀粉酶对支链淀粉的分解不完全,易形成糊精和低聚糖,增加黏稠度,使得酒柔和不刺激。目前,关于红薯与糯米结合制酒,国内外鲜有报道,本研究以红薯和糯米为原料进行混合发酵,结合两者特点制备一种酒精度低、口味丰富,且具有抗氧化活性的米酒产品。测定不同环境、不同贮存阶段红薯糯米酒各成分变化以及抗氧化活性,获得适宜贮存条件,以期为红薯糯米酒的工业化生产提供工艺参数和理论依据。
1 材料与方法
1.1 材料与试剂
红薯,产自重庆万州;糯米、白砂糖,均购于重庆万州永辉超市;酵母,购于北京安琪酵母股份有限公司;糖化酶,购于诺维信生物技术有限公司;果胶酶,购于上海如吉生物科技有限公司;芦丁、没食子酸、Folin试剂,购于广州市齐云生物技术有限公司;DPPH(1,1-二苯基-2-三硝基苯肼)、ABTS(2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸),购于今品化学技术(上海)有限公司;甲醇(标准品)、异戊醇(标准品),购于北京胜达惠友科贸有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Agilent Technology 7890B型气相色谱仪,安捷伦科技有限公司;HH.BLL.600-S型恒温培养箱,上海一恒科学仪器有限公司;PHB-10型酸度计,上海虹益仪器有限公司;YRE200A型旋转蒸发仪,巩义市予华仪器有限公司;日本爱拓PAL-1型可溶性固形物测定仪,北京阳光亿事达贸易有限公司。
1.3 实验方法
1.3.1 红薯糯米酒生产工艺流程
红薯糯米酒生产工艺见图1。

图1 红薯糯米酒生产工艺Fig.1 Manufacturing flowchart of sweet potato glutinous rice liquor
操作要点:红薯和糯米分别蒸煮后,按照质量比为2∶3拌匀;拌料(g)与无菌水(mL)以 1∶2比例混合,常温依次加入质量分数为0.5%的糖化酶、乳酸菌、酵母菌,混合均匀后,在30℃的恒温箱中发酵7 d。为增进红薯糯米酒的风味和质量,将发酵获得的酒液过滤后加入0.5%活性炭,处理24 h,过滤后贮藏发酵7 d。
为研究红薯糯米酒贮存阶段在不同条件下甲醇和异戊醇含量差异,本实验设计5种贮存方法,如表1。

表1 红薯糯米酒贮存方法Tab.1 Post-harvest storage method of sweet potato glutinous rice liquor
1.3.2 红薯糯米酒感官评定方法
感官评分主要分为外观、香气、口感和整体感觉,总分为100分。各指标分别评分,取各指标和为总分。评分标准如表2。

表2 红薯糯米酒感官评定标准Tab.2 Sensory evaluation criteria of sweet potato glutinous rice liquor
1.3.3 可溶性固形物测定
采用手持折光仪测定样品可溶性固形物(SSC)含量。每种测3组平行,获得平均值及标准偏差。
1.3.4 红薯糯米酒酒精度测定
采用酒精比重计法。量取100 mL红薯糯米酒上清液,通过旋转蒸发仪蒸馏出酒样中的酒精,收集后蒸馏水定容至100 mL,用酒精度计测定酒精度。每种测3组平行,获得平均值及标准偏差。
1.3.5 维生素C测定
采用2,6-二氯酚靛酚钠盐标定法。量取酒样10 mL,离心后取上清液,用蒸馏水定溶至10 mL。用标定的0.26 g/L 2,6-二氯酚靛酚钠盐溶液滴定至样品呈微弱的玫瑰色,并持续5 s,以颜色不褪为终点,记录2,6-二氯酚靛酚钠盐溶液消耗量。以10 mL经10%盐酸酸化的蒸馏水做空白对照,每种测3组平行,获得平均值及标准偏差。
1.3.6 总酯测定
采用中和滴定(指示剂)测定方法[5]。取酒样10 mL与30 mL蒸馏水混匀。加入酚酞指示剂1~2滴,用0.1 mol/L氢氧化钠标准溶液滴定至溶液呈微红色,记录消耗量,计算酒样中总酸的含量;准确加入0.1 mol/L氢氧化钠标准溶液15 mL,在沸水浴中回流加热30 min,进行皂化,冷却后加入0.1 mol/L硫酸标准溶液15 mL,用0.1 mol/L氢氧化钠标准溶液滴定至溶液呈微红色,计算酒样中总酯含量,同时做空白对照。每种测3组平行,获得平均值及标准偏差。
1.3.7 黄酮测定
采用分光光度计法测定红薯糯米酒黄酮含量[6]。 分别量取 0.25、0.50、1.00、1.50、2.00 mL 0.1 mg/mL的芦丁标准液与2 mL甲醇、2.5 mL 2%三氯化铝-甲醇溶液混匀,室温反应10 min,于415 nm处测定吸光度。根据反应液中芦丁的质量浓度(mg/mL)与吸光度A415nm制作标准曲线(式(1))。

样品总黄酮含量测定:取0.5 mL酒样代替芦丁,测定吸光度。每种测3组平行,获得平均值及标准偏差。
1.3.8 总酚测定
采用Folin酚法测定红薯糯米酒总酚含量[7]。取8个 10.0 mL容量瓶,依次加入 0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL 的 500 μg/mL 没食子酸溶液,然后依次加入1.5 mL 20%碳酸钠缓冲液和0.5 mL Folin显色剂,蒸馏水定容。在室温下放置2 h,于760 nm处测定吸光度。线性回归方程见式(2)。

式(2)中,x为没食子酸溶液质量浓度,μg/mL;y为A760nm。取样品2.0 mL,按标准曲线步骤反应后,测定吸光度,将所得结果单位换算为单位体积酒样中所含总酚相当于没食子酸的质量,mg/mL。每种测3组平行,获得平均值及标准偏差。
1.3.9 红薯糯米酒抗氧化活性测定
1)DPPH·清除率的测定。按照参考文献[8]测定DPPH·,并进行改进。准确量取3.9 mL 25.6 mg/L的DPPH·溶液,加入70%的乙醇0.1 mL,混匀,在517 nm波长处测吸光度值(Ac)。将各待测样品配成0.75、1.50、3.00、6.00、12.00 μg/mL 溶液后,分别量取0.1 mL样品溶液与3.9 mL DPPH·溶液均匀混合,避光反应30 min后于517 nm处测定吸光度(Ai)。以70%乙醇作对照,加入同体积样品溶液并测定吸光度(Aj)。每种测3组平行,获得平均值及标准偏差,见式(3)。
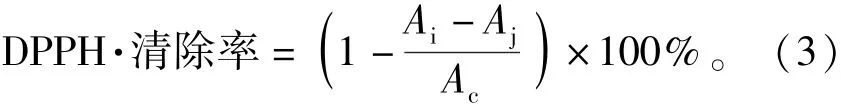
2)ABTS+清除能力的测定。参考文献[9]测定ABTS+,并改进。取7.0 mmol/L的ABTS+溶液5.0 mL,加入88.0μL 140.0 mmol/L的过硫酸钾,室温下置于暗处反应12~16 h,形成ABTS+自由基储备液。在734 nm处,用70%乙醇将储备液稀释至吸光度为0.70±0.02备用。准确量取0.1 mL样品溶液,加入3.9 mL ABTS+溶液,混匀,在室温下反应6 min后于734 nm测定吸光度AE。同时吸取3.9 mL ABTS+溶液,加入0.1 mL体积分数70%的乙醇溶液于734 nm处测定吸光度AB。每种测3组平行,获得平均值及标准偏差见式(4)。

3)总还原能力测定。样品的抗氧化能力体现在能使铁氰化钾的三价铁还原成二价铁(亚铁氰化钾),二价铁(亚铁氰化钾)进一步再和三氯化铁反应生成在700 nm处有最大吸光度的普鲁士蓝[10],因此测定700 nm处吸光度的高低可以间接反映抗氧化剂的还原能力大小[11-12]。吸光度越大,还原能力越强。
1.3.10 甲醇和异戊醇测定
红薯糯米酒中的甲醇主要由红薯中果胶在甲酯酶作用下水解和甘氨酸转化而成,杂醇油以异戊醇为代表,主要由蛋白质和糖类代谢物转化形成。本实验采用气相色谱法测定红薯糯米酒贮存7 d后甲醇和异戊醇含量,每种测3组平行,获得平均值及标准偏差[13-14]。
气相色谱条件:色谱柱为Agilent cp97753 cp-Wax 57cb(50 m×0.32 mm×0.2μm);升温程序35流比40∶1;进样口温度180℃;检测器温度250℃;载气N2(纯度99.999%)。
1.3.11 甲醇和异戊醇混标溶液的配制
分别准确称取甲醇、异戊醇各500 mg及400 mg乙酸乙酯,以少量水洗入50 mL容量瓶中,并加水稀释至刻度,混匀。准确吸取混标溶液1.0 mL至10 mL容量瓶中,用10%无甲醇的乙醇溶液定溶至刻度,混匀;准确吸取混标溶液 0.1、0.3、0.5、0.7 mL于10 mL容量瓶中,用10%无甲醇的乙醇溶液定容至刻度,混匀后与试样分别上机测定,根据标准溶液校正曲线计算出试样的杂醇油含量。
2 结果与分析
2.1 发酵过程中可溶性固形物、p H值及酒精度变化
图1为红薯糯米酒发酵过程中可溶性固形物、pH值及酒精度变化曲线。从图1可以看到,发酵第3天可溶性固形物、pH值及酒精度均有明显变化,由此推断第3天红薯糯米处于酒酿发酵的关键时刻。酵母菌经过大量繁殖后在糖化酶的帮助下开始分解消耗红薯和糯米中的淀粉,此时酵母菌处于繁殖能力最强的对数生长期,酒精度不断提高最后保持在22°左右,此时pH值也稳定在3.4左右。
2.2 不同贮存条件下红薯糯米酒各成分差异以及感官评价
红薯糯米酒经过7 d发酵后进行7 d后熟,不同贮存条件下成分和杂醇油变化如表3。从表3可以看到,5种不同贮存条件下贮存7 d的样品,pH值逐渐稳定在3.53左右,可溶性固形物、总酯、总酚含量变化不大,酒精度、黄酮、维生素C受温度及果胶酶含量的变化影响,差异明显。通过感官评定发现,25℃贮藏的红薯糯米酒色泽和口感较差,而低温贮藏下总酯较高的红薯糯米酒口感比较好。

图1 7 d发酵红薯糯米酒可溶性固形物、酒精度及pH值的变化Fig.1 Change of soluble solids contents,alcohol contents and pH in sweet potato glutinous rice liquor during 7 days fermentation
通过气相色谱分析不同贮存条件下甲醇、异戊醇含量发现,贮存温度不同对甲醇、异戊醇生成影响比较大。25℃贮存下甲醇含量明显高于4℃,异戊醇相反;但添加果胶酶后异戊醇含量明显降低,两种醇类随果胶酶添加量的增大而逐渐降低。感官评价结果显示,4℃不加果胶酶口感最好,但是由于两种醇类含量较高,而添加果胶酶能明显降低醇类含量,添加2%果胶酶得到的贮存酒样口感得到提升。综合评价:4℃,添加2%果胶酶进行酒样贮存效果好。
2.3 不同贮存条件下红薯糯米酒总还原能力和抗氧化性分析
清除DPPH·和ABTS+能力是目前衡量产品抗氧化性常用指标。表4为不同贮存条件下红薯糯米酒总还原能力和抗氧化能力情况。从表4结果可知,不同贮存条件下红薯糯米酒对自由基的清除能力不同,而且随着果胶酶添加量的增加,清除能力增加;酒样总还原能力变化不大,但在果胶酶添加量为2.0%条件下,还原能力变化明显。由此推断果胶酶能提高酒样的总还原能力和抗氧化能力,因此选择4℃,添加2%果胶酶条件下进行红薯糯米酒贮存。

表3 红薯糯米酒贮存后成分差异及感官评分Tab.3 Effect of different post-harvest storage conditions on components and sensory evaluation values of sweet potato glutinous rice liquor

表4 红薯糯米酒贮存后总还原能力和抗氧化性分析Tab.4 Antioxidant activity of sweet potato glutinous rice liquor after storage
3 结 论
1)分析了红薯糯米酒发酵过程以及各贮存阶段成分变化情况。其中可溶性固形物、酒精度及pH值随着发酵时间均产生明显变化,其中发酵第3天为红薯糯米酒发酵关键时期。
2)通过不同条件下贮存发酵酒样实验可知,可溶性固形物、总酯、总酚含量变化不大,而酒精度、黄酮、维生素C含量受温度及果胶酶含量的变化有明显差异。常温贮藏的红薯糯米酒色泽和口感较差,而低温贮藏能提高红薯糯米酒总酯含量,进而增进口感。
3)气相色谱分析测得不同贮存条件下甲醇、异戊醇含量发现,贮存温度和果胶酶添加量与红薯糯米酒各成分以及甲醇、异戊醇生成相关,其中4℃,2%果胶酶添加量条件下,能保存红薯糯米酒品质和风味,降低甲醇及异戊醇生成。
4)不同贮存条件下的红薯糯米酒对自由基清除能力不同,并随着果胶酶添加量增加而增大,其中添加2.0%果胶酶能明显提高红薯糯米酒的抗氧化能力。
红薯糯米酒不仅保留了米酒独特的风味,而且增加了红薯的香甜,适合多类人群食用,具有广阔的市场前景。
