黑鲷×真鲷杂交子代与真鲷的Calmodulin基因克隆与表达分析
2018-08-07陈淑吟张志勇吉红九赵永超张志伟
陈淑吟,张志勇,吉红九,李 鹏,赵永超,张志伟
(1.江苏省海洋水产研究所,江苏南通 226007;2.南京师范大学生命科学学院,江苏南京 210023)
钙调蛋白也称钙调素(calmodulin,CaM),是真核细胞中最重要的 Ca2+结合蛋白[1-2]。作为Ca2+信号传导途径中的主要信号转导分子,CaM介导调控由Ca2+引起的一系列生理生化反应,对细胞增殖、神经传导、激素分泌、基因表达等重要的生理过程具调节功能[3-6]。关于CaM基因与物种的生长、生殖等经济性状相关的研究已有不少报道,如CaM基因座可能是影响京海黄鸡新品种产蛋数和蛋壳质量性状重要候选基因[7];CaM与三疣梭子蟹(Portunus trituberculatu)生长蜕皮[8]有密切关系;参与对贝类外壳形成的调控[9-11],CaM一些位点突变对长牡蛎(Crassostrea gigas)贝壳重有显著性影响[12];CaM的上调表达与鱼类的抗寒能力有关[13];RNAi实验显示出CaM对血吸虫(Schistosoma mansoni)幼虫早期发育的 重 要 作 用[14]。此 外,在 赤 点 石 斑 鱼(Epinephelus akaara)雌性转雄性过程中,CaM是促使性转变的重要功能基因之一[15];莫桑比克罗非鱼(Oreochromis mossambicus)体内的类固醇生成受 Ca2+/CaM调节[16]。这些研究表明 CaM基因在物种的生长发育与性腺发育等过程中扮演重要作用。
真鲷 (Pagrus major)、黑鲷 (Acanthopagrus schlegelii)分别为鲷科(Sparidae)的赤鲷属和棘鲷属中名贵经济鱼类,黑鲷肉质细腻、味道鲜美又有较好抗逆性,真鲷生长速度快且体色靓丽,均是中国不同海区的重要养殖对象[17-18]。为选育优良海水养殖新品种,利用黑鲷与真鲷进行的杂交育种已有不少研究[19-21];关于黑鲷、真鲷及杂交子代(F1)的核型、遗传相似性、抗逆性或营养成分比较等方面已有一些报道[22-25],而尚未有从功能基因上进行相关研究的报道。近年来,通过筛选出与杂种优势形成有关的基因,揭示基因表达差异正成为探寻杂种优势分子机理新的切入点[26]。由黑鲷(♂)×真鲷(♀)中得到的杂交子代F1(AP),1~2龄鱼的生长速度已显示了较好的杂种优势。本文首次克隆了APCaM和PmCaM基因序列,并借助于功能基因分析,研究了两基因序列差异水平及其表达模式,为CaM基因功能研究及鲷科鱼类育种提供基础资料。
1 材料与方法
1.1 样本准备
实验用鱼均来自江苏省海洋水产研究所人工繁育及养殖。其中,杂交F1与真鲷的仔鱼样本为同样室内条件下培育的30日龄仔鱼,杂交F1仔鱼体长、体质量分别为(1.10±0.01)cm、(0.040±0.001)g,真鲷仔鱼体长、体质量分别为(0.98±0.01)cm、(0.039±0.001)g;成鱼样本取自同一口池塘混合养殖、随机选取的2龄健康个体,杂交F1成鱼体长、体质量分别为(25.15±0.06)cm、(472.1±53.8)g,真鲷成鱼体长、体质量分别为(23.82±0.15)cm、(376.81±26.8)g。
因仔鱼样本个体太小,仔鱼取整体和成鱼的脑、肌肉、鳃、肝、肾、性腺等组织约5~15 mg分别放入装有RNAlater RNA Stabilization Reagent(QIAGEN)的1.5 mL离心管内,并用灭菌后的小号剪刀剪成粒径小于0.2 mm碎粒,置于4℃冰箱(海尔BCD-649WE)过夜,然后转20℃保存备用。用RNeasy Mini Kit(QIAGEN)分别提取仔鱼和成鱼组织样本的总RNA。通过分光光度计(Eppendorf)和琼脂糖凝胶电泳检测总RNA的浓度和纯度。使用 PrimerScriptTMRT reagent Kit with gDNA Eraser RR047A试剂盒(TaKaRa)进行反转录获得cDNA模板。
1.2 APCaM与PmCaM基因cDNA全长序列克隆
采用已知的鱼类CaM基因的序列设计、合成扩增 CaM序列简并引物 CaMF/CaMR(表1),以cDNA第一链为模板进行基因中间片段的扩增。PCR反应体系(50μL)包括:25μL 2×Ex-Taq Buffer(TaKaRa),1μL dNTP Mix(10 mM),15μL无菌水,1μL Taq DNA聚合酶(5 units·μL-1),3 μL简并引物(10μM)和 5μL cDNA,最后用50 μL矿物油覆盖。PCR反应条件如下:94℃4 min预变性;然后94℃ 30 s,55℃ 30 s,72℃ 2 min;35个循环;72℃额外扩展10 min。PCR产物经2%的琼脂糖凝胶分离检测,用已经纯化的PCR产物克隆入pMD18-T载体(TaKaRa),转化入大肠杆菌感受态细胞DH5α(TaKaRa),经PCR验证后取3个阳性克隆进行测序。
根据克隆获得的CaM基因中间片段,设计并合成 5′-RACE和3′-RACE基因特异引物 GSPAPCaM5′、GSP-PmCaM5′、GSP-APCaM3′、GSPPmCaM3′(表 1)。用 5′RACE System for Rapid Amplification of cDNA Ends(Invitrogen)及SMARTer RACE cDNA Amplification Kit试剂盒,按试剂盒说明书进行操作,利用设计特异引物与通用引物配合进行PCR,扩增APCaM与PmCaM的5′-端及3′端cDNA序列。PCR产物经检测、克隆、验证及测序列等步骤后,获得该基因的5′端及3′端序列。应用DNAStar Lasergene 7.1软件,分别组装APCaM与PmCaM基因的5′-RACE片段、中间片段和 3′-RACE片段,拼接生成APCaM与PmCaM基因的cDNA全长序列。
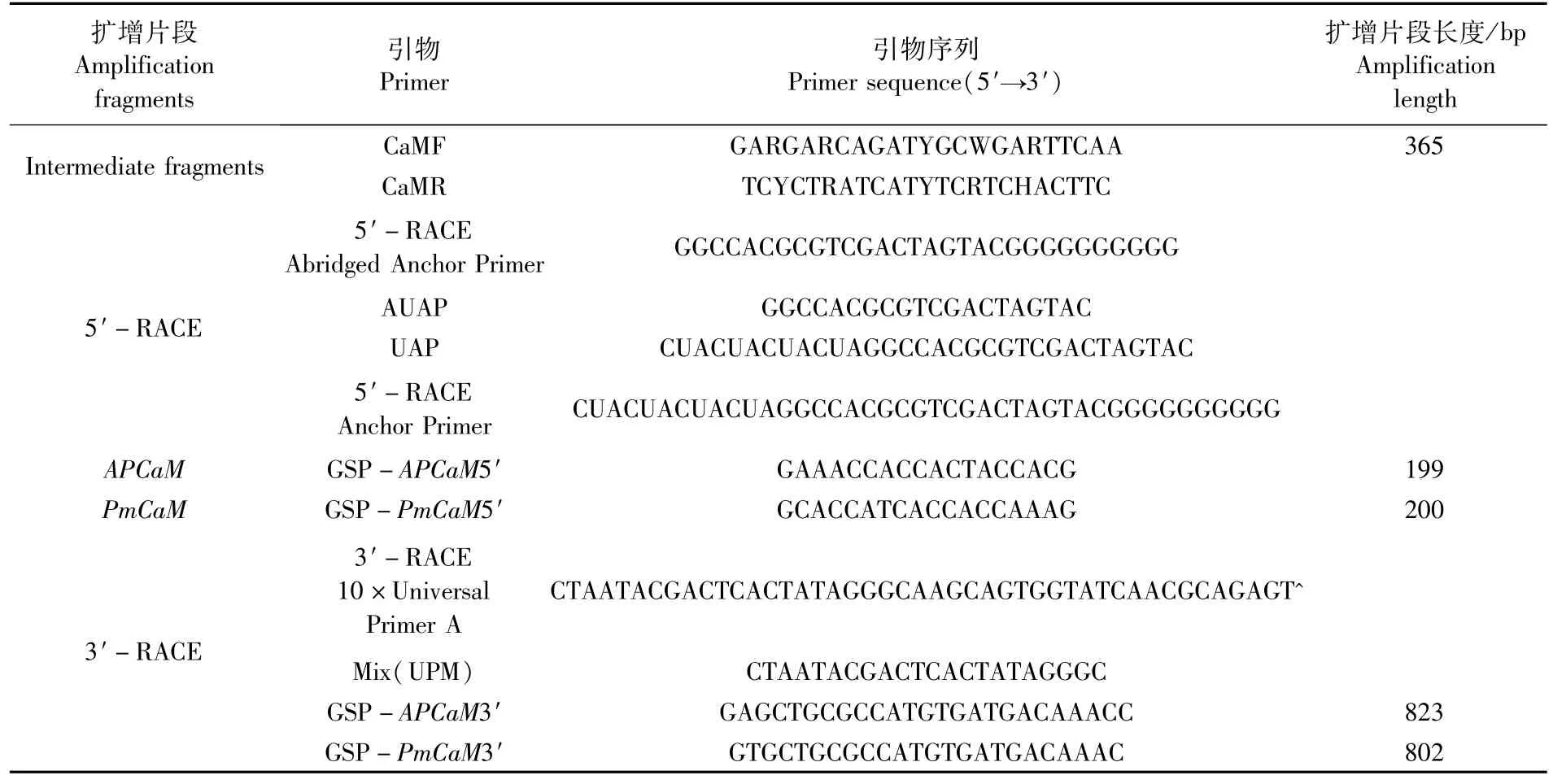
表1 CaM基因cDNA片段扩增与荧光定量PCR的引物与扩增片段长度Tab.1 Primers used for CaM genes cloning and the length of PCR amplifications
1.3 APCaM与PmCaM基因与蛋白的序列分析
CaM基因cDNA的开放阅读框(open reading frame,ORF)查找用 ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/)。分子量与理论等电点预测采用ExPASy在线服务器的Compute pI/Mw工具 (http://www.expasy.org/tools/pi_tool.html)。结构域分析及Ca2+结合位点使用NCBI Conserved domains(https://www.ncbi.nlm.nih.gov/Structure)。信号肽预测分析采用 SignalP(www.cbs.dtu.dk/services/SignalP)[27-28]。CaM的亚细胞定位采用 PSORTⅡ软件(http://psort.ims.u-tokyo.ac.jp/form2.html)。CaM的跨膜区预测使用 TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)。潜在的糖基化位点使用 Asn-X-Ser/Thr工具进行预测(http://cbs.dtu.dk/services/NetNGlyc/)。磷酸化位点分析使用 NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)。二级结构预测使用DNAman软件。三级结构预测使用 SWISSMODEL 服 务 器 (http://www.expasy.org/swissmod/SWISS-MODEL.html)[29]。APCaM与PmCaM基因全长cDNA序列比对使用clustalX软件;序列的同源性分析及CaM基因的氨基酸序列相似性搜索,采用在NCBI网站运行BLAST程序[30]。
1.4 APCaM与PmCaM基因的mRNA表达差异分析
根据已得到的APCaM与PmCaM基因全长cDNA序列,分别设计两对特异性引物APCaM F/APCaM R和PmCaM F/PmCaM R(表2),用于实时荧光定量PCR。内参基因引物为actin F/actin R(表2)。通过 IO-RAD CFX ConnectTM荧光定量PCR检测系统,测定CaM基因在AP与Pm不同组织样本中的表达情况。荧光定量PCR反应体系为20μL,以各样本的cDNA为模板,反应程序为:95℃预变性3 min;95℃变性10 s,58℃变性20 s,72℃变性20 s,75℃ 变性5 s并采集荧光信号;40个循环;添加溶解曲线生成程序:95℃到65℃每降0.5℃(5 s)采集一次荧光。样品和内参均设3个重复。实验结束后,用溶解曲线分析产物专一性,结果用2-ΔΔCT法进行初步数据统计分析。用SPSS19.0分析软件进行数据统计并分析数据的差异性。

表2 荧光定量PCR引物Tab.2 Primers used for fluorescence real-time quantitative PCR
2 结果与分析
2.1 APCaM与PmCaM基因cDNA全长序列的克隆与分析
以设计的简并引物扩增获得365bp的CaM基因中间片段,再以此片段设计基因的5′及3′引物,进行PCR扩增及测序等步骤,获得APCaM和PmCaM的5′及3′序列,软件拼接获得APCaM与PmCaM的cDNA片段长度分别为1 230 bp和1 210 bp;cDNA全长序列经BLAST比对验证均属CaM基因。其中,APCaM基因的全长cDNA序列具有一个450 bp(从序列的96 bp至545 bp处)的开放阅读框(ORF),编码一个具149个氨基酸的多肽;具有一个 95 bp的 5′-非翻译区(untranslated region,UTR),3′-UTR长度为 685 bp,包含有 AATAA加尾信号及 poly(A)尾巴;APCaM基因序列中A+T和C+G的百分比分别为56.75%和43.25%。PmCaM基因的全长cDNA序列ORF长度同为450 bp(从序列的97 bp至546 bp处),编码的多肽同为149个氨基酸;5′-UTR长度比 APCaM多 1bp,3′-UTR长度比APCaM少21 bp,同样包含有AATAA加尾信号及poly(A)尾巴(图1);基因序列中 A+T和 C+G的百分比分别为56.20%和43.80%。

图1 真鲷PmCaM基因的cDNA全长序列和推导的氨基酸序列结构Fig.1 Nucleotide and deduced amino acid sequences of PmCaM gene from Pagrus major注:推导的氨基酸序列显示在对应的核苷酸序列下方;起始密码子与终止密码子用红色标注,5′RACE引物用绿色标注,3′RACE引物用蓝色标注,N-糖基化位点用加粗下划线标注,蛋白激酶C磷酸化位点加粗标注,十四烷基位点用阴影标注,酪蛋白激酶II磷酸化位点用方框标注Notes:Translated aminoacid sequenceisshown under nucleotide sequence and in bold character;initial codon and terminal codon are marked in red,5′RACE primers in green thin under line,3′RACE primers in blue and thick underline,N-glycosylation site marked with bold underline,protein kinase C phosphorylation site bolded,myristyl with shadow marking and double underline,Casein kinase II phosphorylation site marked with box
对基因的氨基酸motif搜索表明APCaM与PmCaM都含有4个 EF-hand结构域(EF-hand calcium-binding);多肽链都含有1个N端糖基化(Asn糖基化)位点,5个酪蛋白激酶Ⅱ(casein kinaseⅡ,CK2)磷酸化位点,2个十四烷基位点,2个蛋白激酶C磷酸化位点(图1)。
APCaM与PmCaM的ORF序列有7个碱基差异,分别为 C/T,C/G,C/A,A/T,G/A;两基因蛋白多肽有5个氨基酸差异(图2),分布在第70、105、117、124及 131位点。序列同源相似性搜索比对得出,APCaM与PmCaM基因在核苷酸水平与其它鱼类CaM基因相似性最高达95%(表 3);APCaM基因与墨西哥脂鲤(Astyanax mexicanus,XP_022517811.1)、大西洋鲱(Clupea harengus,XP_012679224.1)及底鳉(Fundulus heteroclitus,XP_012724361.2)等鱼类仅有一个氨基酸差异,相似性达99%,PmCaM基因与这些鱼类有4~5个的氨基酸位点差异,相似性为97%。基因比对结果说明APCaM和PmCaM都属于CaM基因家族,也反映了CaM基因序列的高度保守。另外,杂交F1的APCaM和黑鲷父本(As)该基因AsCaM已知序列比较,长度同样是149个氨基酸的蛋白多肽,两序列在第124位点有一个氨基酸不同(K-E),见图2,此差异程度明显小于杂交F1与真鲷母本的。
2.2 APCaM与PmCaM蛋白质基本属性与功能结构分析
对两种钙调蛋白理化性质分析得出,APCaM蛋白分子量约为16.84 kDa、理论等电点 pI为4.15,脂肪系数为65.50,分子式为C720H1134N190O254S10;PmCaM蛋白分子量约为16.80 kDa、理论等电点pI为4.10,脂肪系数为61.54,分子式为 C719H1129N189O256S10。在组成APCaM与PmCaM两种蛋白的18种氨基酸中,谷氨酸(Glu)所占的比例最高,达到13.4%,组氨酸(His)所占的比例最低,为0.7%。APCaM与PmCaM蛋白的不稳定指数略有差异,分别为29.83与 28.21,根据 GRP(Guruprasad-Reedy-Pandit)方法得出两者均属蛋白稳定。亲水性检测得出GRAVY分别为-0.656(APCaM)与-0.653(PmCaM),均具亲水性。信号肽预测结果说明两蛋白属非分泌型蛋白。PSORTⅡserver分析得出蛋白的亚细胞定位于细胞之中的可能性最大为52.2%;子程序NNCN预测分析表明两CaM蛋白94.1%可能性定位于细胞质中。

图2 APCaM与PmCaM、AsCaM蛋白氨基酸序列差异比较Fig.2 Alignment of APCaM with PmCaM and AsCaM amino acids sequences注:阴影表示相同氨基酸Notes:Consistency sequences are presented by shadow

表3 杂交F1和亲本的CaM与其它鱼类CaM基因序列的同源性比较Tab.3 Blastn homology search results of CaM gene sequence with other fishes
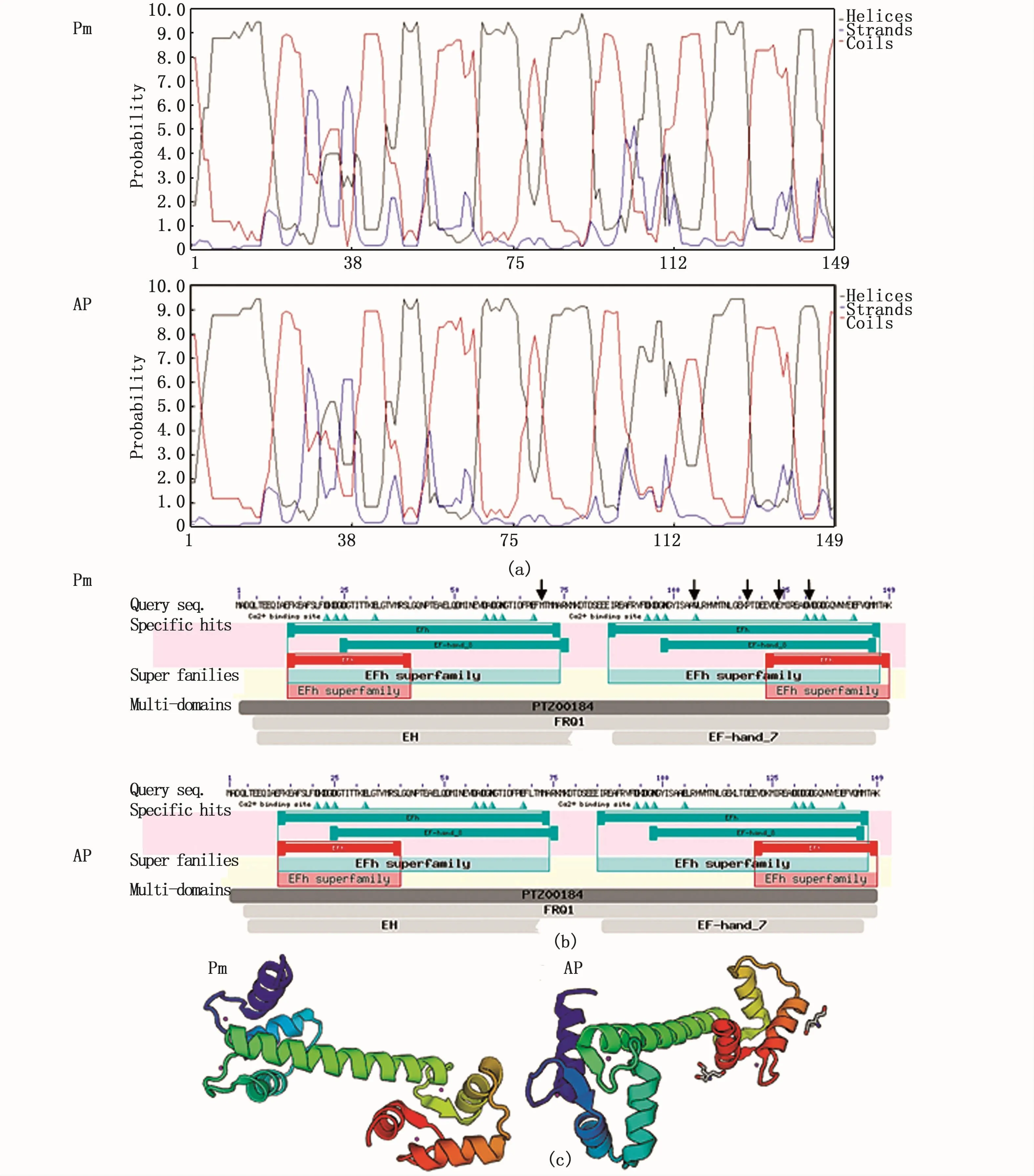
图3 杂交子代APCaM与真鲷PmCaM预测的蛋白二级结构(a)、功能域(b)及三维结构(c)Fig.3 Predicted results of the secondary structure(a),domains(b)and the predicted three-dimensional structure(c)of CaM protein search from Pagrus major(Pm)and the hybrids F1(AP)of Acanthopagrus schlegelii(♂)×Pagrus major(♀)注:(b)-Pm中箭头所示为两基因氨基酸差异位点Notes:Arrowhead of the(b)-Pm indicates different amino acids loci of two genes
对APCaM和PmCaM蛋白的二级结构预测结果如图3-a所示,其中,helix表示α螺旋(黑线),strands表示延伸链(蓝线),coil表示无规则卷曲(红线);蛋白的二级结构组分以α螺旋为主,占61.74% >45.00%,无规则卷曲占32.89%,属不完全α型蛋白。两CaM基因的4个EF-hand功能结构域有16个Ca2+结合位点,见图3-b。两基因的蛋白三维结构预测结果空间结构相似、保守,在不规则卷曲略有不同(图3-c),CaM均由N端和C端两个结构域(又称N-lobe和C-lobe)通过一个中间linker连接组成,包括7个α螺旋,且α螺旋相对位置都很保守。
2.3 CaM基因的mRNA差异表达分析
定量分析得出CaM基因在仔鱼及成鱼6种组织中均有表达(图4),表达水平在不同的品种、生长阶段及组织中均存在明显差异,且有较强的组织特异性;表达量较高的为脑与性腺,肝及肾中的表达量较低。基于SPSS19.0软件分析得出,杂交 F1中,APCaM在脑组织的表达量(19.44)与其它组织相比有极显著性高表达(P<0.001);肌肉、鳃及性腺的组织间表达量无显著差异(P>0.05),但其与肝、肾的低表达比较呈极显著差异(P<0.01)。真鲷中,PmCaM在性腺的表达水平(7.51)与其它组织相比均有极显著高表达(P<0.001),脑与鳃组织间的表达量无显著差异(P>0.05),但其与肝、肾和肌肉中的表达量有极显著差异(P<0.01),肝、肾和肌肉中的表达量较低且不存在显著差异。杂交F1APCaM与真鲷PmCaM相比,两种仔鱼CaM的表达水平无显著差异(P>0.05);在6个检测组织中,脑、性腺及肌肉3种组织中CaM表达量存在极显著差异(P<0.001),其中,APCaM在脑及肌肉中的表达量极显著高于PmCaM,而在性腺中的表达量极显著的低于PmCaM的水平,鳃中CaM的表达水平显著差异(P<0.05),成鱼的肝、肾中的基因表达没有显著差异(P>0.05)。黑鲷亲本中,已知AsCaM在性腺中表达水平(7.49)显著高于脑(5.26)和仔鱼(4.92)(P<0.05),极显著高于肝、肾、鳃及肌肉组织(P<0.01),肝、肾、鳃与肌肉组织间不存在明显差异表达[32]。杂交F1和黑鲷父本相比,两者仔鱼CaM的表达水平有极显著差异(P<0.01),APCaM在仔鱼中的表达量相对较低;在检测的6种组织中,鳃中CaM的表达水平显著差异(P<0.05),APCaM的表达水平高于AsCaM的,其它组织中杂交 F1与黑鲷父本的CaM表达情况,与在真鲷中的差异水平基本一致(图3)。

图4 CaM在杂交子代与亲本中的定量表达差异比较Fig.4 Relative expression results in various tissues of CaM in the hybrid and parents注:数值用平均值±标准差;垂线段表示标准差Notes:Values are expressed as mean±sd.Uprightness line mark standard deviation
3 讨论
随着对钙调蛋白功能重要性的认识加深,CaM成为真核细胞内所有Ca2+结合蛋白中研究得最为透彻的一类[32-35]。越来越多的CaM基因在动物、植物、真菌和原生动物中被分离和克隆出来[36]。不同物种的CaM序列结构在进化上呈很强的保守性[37-38],研究表明动植物间的 CaM基因氨基酸序列的相似度在90%以上[12],脊椎动物中有些种类的CaM氨基酸水平完全一致[39]。本研究得到的杂交子代APCaM或真鲷PmCaM氨基酸序列与许多其它鱼类的相似性分别达99%或97%,两基因的ORF区域编码149个氨基酸的序列长度及包含有4个EF-hand的结构域,与牙鲆(Paralichthys olivaceus)PoCaM、点带石斑鱼 (Epinephelus coioides)EcCaM、花刺参(Stichopus monotuberculatus)StmCaM及扶桑绵粉蚧(Phenacoccus solenopsis Tinsley)PsCaM 等的ORF区域一致[39-43]。
本研究得到的APCaM与PmCaM基因之间相差5个氨基酸位点,其差异程度不小于种间水平,例如,花刺参 CaM与中间球海胆(Strongylocentrotus intermedius)CaM相比只有 3个氨基酸位点发生变换,与合浦珠母贝(Pinctada martensii)相比也仅为4个氨基酸位点发生变换[40]。有研究表明CaM基因不同亚型的差异部位可能只存在于非编码区[44],包括鱼与哺乳动物间的CaM差异位点也主要在3′-UTR[45]。基因的5′-或3′-UTR可以独自或者协同作用调节基因表达[46],也可以启动基因的组织特异性表达[47]。实际上,这些非编码DNA才是遗传的中心,正是由它们决定基因何时何地何量表达,以及如何高效生产出各种蛋白质[48-49]。APCaM与 PmCaM基因间的3′-UTR还存在21 bp的插入缺失差异,在真鲷母本与杂交子代F1间,是否有导致功能性状变化的效果,还有待于更多详细研究。
定量分析表明,CaM基因在仔鱼及成鱼所检测的组织中均有表达,在杂交子代与亲本间的表达存在明显不同之处,其中,杂交F1APCaM在脑及肌肉中有极显著的高表达,在性腺中是极显著的低表达,而在仔鱼期及成鱼的鳃中表达水平处于父、母本的中间。真鲷及黑鲷亲本中,均是性腺的CaM表达量最大,其次是脑。杂交F1中,APCaM在脑中的表达量最高,其次是肌肉组织,在性腺中的表达处于中间水平。相关研究表明CaM在脊椎动物脑中的含量最丰富[50];CaM表达对神经元的生长和发育起着重要作用[51]。CaM依赖的蛋白质激酶就是神经系统信号转导的重要激酶[41]。大脑是动物机体的重要生命中枢,说明CaM在维持大脑正常功能中具有重要作用。CaM基因在脑中的超高表达,有助于促进下丘脑-垂体-生长轴相关基因表达来提高生长性能。关联到杂交F1的杂种生长优势,推测APCaM与PmCaM、AsCaM相比在脑、肌肉中的极显著性高表达可能与生长优势有关。基因的高表达量为杂种优势的体现[26]。借助NRK细胞模型研究得出,高表达钙调素加速细胞的生长[52]。相反,就低表达情况而言,APCaM相比于PmCaM及AsCaM在性腺中表达呈极显著差异,样本解剖及性腺切片结果表明,其生殖细胞发育明显滞后于亲本,且杂交 F1的2龄鱼性腺指数(gonadosomatic index)仅约为同期真鲷或黑鲷的1/3;这一结果也证明CaM可能参与性腺发育的调控过程[11,27]。对四川白鹅CaM表达量研究也表明该基因在大脑组织中也显著高于其它组织,并且CaM可能通过影响卵泡细胞增殖和类固醇激素合成来参与调控动物繁殖[53]。类似于APCaM在杂交F1的脑及性腺中的这种表达量超高或低于双亲表达量范围的情况,有研究关注并认为这种新的基因表达模式是导致杂种优势的原因[26]。杂交F1的这种性状态势一定程度上体现了鱼类属间杂交导致的可育性的不确定,也是基因调控的结果;再者可能是由于生长与生殖在一定程度上有互为负调控的关系。鱼类的鳃为与细胞免疫相关的器官[37],在鳃组织中 APCaM显著性低于PmCaM的表达,可能也与杂交F1的免疫水平相对低于真鲷的情况相关,这也是该育种研究需进一步探索的内容。
另外,不同鱼类CaM的表达情况多种多样,有与本研究得到的基因表达结果相似的,也有明显不同的,如青岛文昌鱼(Branchiostoma belcheri tsingtaunese)在鳃及性腺中均是高表达[41],本研究的结果与之相近;七鳃鳗(Lampetra japonica)主要在肠、鳃、髓及肾中表达,而心、肝组织中几乎不表达[37],本文中真鲷及杂交F1的肝中均有表达,但表达量较低,而点带石斑鱼的肝为高表达[43];赤点石斑鱼的脑、心、肝、脾及肾中均有表达,且在精巢中表达最高,肌肉中表达最弱[15],而杂交F1的肌肉有较高表达量。从这些研究表明,CaM的表达水平只随鱼类品种不同、生长阶段不同而有不一样的结果,总体来说,在鱼体主要器官组织中多有较高表达,尤其在脑及性腺中的表达水平更显著。这些结果加深了对CaM基因调控鱼类的生长及性腺发育等作用的进一步认识。
