高钙和缺钙环境对花鳗鲡血液生理指标及其NCXs和PMCAs基因表达的影响
2018-08-07曹全全胡亚东张宏叶李欣茹尹绍武
曹全全,胡亚东,王 涛,张宏叶,顾 杰,王 丹,李欣茹,尹绍武
(1.南京师范大学生命科学学院,海洋科学与工程学院,江苏南京 210023;2.江苏大学生命科学学院,江苏镇江 212000)
花鳗鲡(Anguilla marmorata)属鳗鲡目(Anguilliformes),鳗鲡科(Anguillidae),鳗鲡属,广泛分布于太平洋周围的热带和亚热带区域,为降海洄游性鱼类。因其肉质鲜美细嫩,市场需求大,导致捕捞过度,被《中国濒危动物红皮书》列为濒危物种,并于上20世纪90年代被我国列为二级保护动物[1]。在自然条件下,鳗鲡因具特殊的生活史洄游于淡水和海水之间且频繁地面对渗透压的挑战。盐度和钙离子浓度是影响鱼类渗透压最重要的两个外界指标[2]。钙离子是海水中的重要组成部分之一,且其浓度在海水表层与深水中变动较大,而在鱼体内却维持在一个较窄的范围内[3]。因此维持钙稳态对于鳗鲡属鱼类来说具有重要的意义。
钠钙交换体NCX是一种膜内在蛋白[4],其中NCX1、NCX2和NCX3这3种亚型已在哺乳动物如 鼠 (Rattus norvegicus)[5]、豚 鼠 (Cavia porcellus)[6]和狗(Canis lupus familiaris)[7]中克隆得到。NCX1在机体组织中广泛分布,而NCX2和NCX3主要分布于脑和骨骼肌中[8]。在鱼类研究中,NCX1在虹鳟(Oncorhynchus mykiss)[9]、莫桑比克罗非鱼(Oreochromis mossambicus)[10]和斑马鱼(Barchydanio rerio)[11]等鱼类中已被克隆。NCX的主要功能是将钙离子从细胞内排出以防止胞内储存的钙离子超负荷输出,从而维持胞浆中钙离子浓度的恒定[12]。质膜 Ca2+泵(PMCA)是一种Ca2+-Mg2+-ATP酶,通过水解ATP来维持Ca2+的输出从而达到维持细胞低浓度钙离子的目的。PMCA包含10个跨膜结构域、5个推测的胞外域和3个主要细胞结构域蛋白。这些结构域均属于功能位点,是钙离子绑定位点,被钙调蛋白激活;也是ATP绑定位点,对于酰基磷酸酐的形成和水解有着重要的作用[12-13]。人类PMCA分为4个亚型,分别为 PMCA1、2、3和4。PMCA1和 PMCA4在哺乳动物中具有广泛分布,被誉为维持细胞内钙稳态的看家亚型,而PMCA2和PMCA3的表达模式具有组织特异性[14]。
钙离子转运体NCX、PMCA等通过上皮细胞Ca2+的运输和转运,来控制钙离子进出体内的净含量,进而影响多个生理学进程。此外,钙离子的循环量受到机体严格的限制,鱼类需具备感知外界钙离子的能力进而调节钙离子的稳态[15]。在哺乳动物的肾脏中,钙离子通过钙通道透过质膜,然后依托钙结合蛋白扩散穿出质膜[16]。FLIK等[17]在鱼鳃中提出一个模型,与哺乳动物肾脏钙离子的重吸收相似,Ca2+依附胞液钙结合蛋白从胞液排出到血液中,需细胞底外侧PMCA和NCX以及顶膜钙离子泵(ECaCs)的参与,但关于这些钙转运体对整个钙离子吸收进程的相对重要性并没有阐述。
为了探究花鳗鲡NCXs和PMCAs基因在极性钙环境下(高钙10 mM和缺钙0 mM)的表达规律,本研究测量了花鳗鲡成鳗从对照组转移到高钙组和缺钙组时的血清钙浓度、血清渗透压和5项血液指标(白细胞数目、红细胞数目、葡萄糖浓度、血红蛋白浓度和血小板数目),并采用qRTPCR技术对NCXs和PMCAs基因在花鳗鲡13种不同组织(脑、鳃、头肾、后肾、前肠、中肠、后肠、肝、心、肌肉、鳔、脾和皮肤)中的表达进行了分析,最后研究了花鳗鲡应对极性钙浓度下(高钙10 mM和缺钙0 mM)NCXs和PMCAs基因在鳃组织中的mRNA表达水平变化规律。以期为进一步解析花鳗鲡钙稳态的分子机制提供基础资料。
1 材料与方法
1.1 实验材料
花鳗鲡体质量(550±10)g,取自中国海南文昌金山花鳗鲡科技有限公司(公司具有中华人民共和国水生动物捕捞资格),暂养于玻璃循环缸中15 d,每日定期投喂饲料,摄食30 min后虹吸排污,每日换1/3水体。实验用水为曝气24 h的自来水,养殖水温保持在25~27℃。确定鱼体健康无病后开始实验。
1.2 总RNA的提取及cDNA第一链的合成
用北京百泰克公司的高纯总RNA快速抽提试剂盒(离心柱型)提取花鳗鲡组织总RNA,用RNA浓度测定仪测定每个样品的RNA浓度及纯度,确保 OD 260/280在1.9~2.1范围内。用1%琼脂糖凝胶电泳检测其完整性。所有样品冻存于-80℃冰箱中备用。以总RNA为模板,根据 HiScriptTM1ST strand cDNA Synthesis kit(南京诺唯赞生物科技有限公司)的说明进行反转录,获得cDNA第一条链。
1.3 花鳗鲡NCXs和PMCAs基因的组织表达分析
随机取缸内3尾花鳗鲡成鳗,MS-222(Sigma)(150 mg·L-1)麻醉后解剖取 13种组织(脑、鳃、头肾、后肾、前肠、中肠、后肠、肝、心、肌肉、鳔、脾和皮肤),提取总RNA后,反转录获得cDNA第一链。根据花鳗鲡转录组及其近缘物种的NCXs和PMCAs序列,分别用Primer 5设计特异性引物 NCX1-F、NCX1-R、NCX2-F、NCX2-R、NCX3-F、 NCX3-R、 PMCA2-F、 PMCA2-R、PMCA4-F、PMCA4-R以及作为内参基因的花鳗鲡actin基因特异性上下游引物actin7、actin8(表1)。以获得的13种组织的cDNA为模板,进行实时荧光定量 PCR分别检测花鳗鲡 NCXs和PMCAs在13种组织中mRNA的表达量。PCR反应体系为20μL:Faststart Universal SYBR Green Master 10μL,正反引物(2μmol·μL-1)各3μL,cDNA模板(5 ng·μL-1)4μL。反应程序为95℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环;72℃ 延伸5 min,4℃保存。

表1 花鳗鲡NCXs和PMCAs基因荧光定量的引物Tab.1 Primers used for Anguilla marmorata NCXs and PMCAs in qRT-PCR
1.4 人工钙离子水的配置
参照CHEN等[18]所描述的钙离子溶液的配置方法,用 CaSO4、MgSO4、NaCl、K2HPO4、KH2PO4和去离子水(Milli-RO60,Millipore,Bedford,MA)配置不同钙梯度的水溶液。实验钙浓度分为:1)组 A:对照组(pH=7,2 mM Ca2+);2)组B:缺钙组(pH=7,0 mM Ca2+);3)组 C:高钙组(pH=7,10 mM Ca2+),其它3种溶液的钙离子浓度相同([Na+],0.5 mM;[Mg2+],0.16 mM;[K+],0.3 mM)。实验用鱼先放置在组A中驯化1周,1周后把鱼放置到组B和组C中进行相关的时序表达实验。为保持水中钙浓度稳定,每6 h换1次相应浓度的钙离子水,换水量为50%,实验过程中持续充氧。
1.5 Ca2+胁迫对花鳗鲡NCXs和PMCAs基因表达的影响
为进一步探究花鳗鲡在不同钙胁迫下、不同时段的鳃组织中NCXs和PMCAs基因表达水平的变化规律,实验各组分别于第1、4和7天,每个缸内随机取3尾鱼,用MS-222(Sigma)麻醉,取其鳃组织,液氮速冻10 min后于-80℃保存。随即用注射器经主动脉抽出血液,静置后取血清,用原子吸收光谱法(SpectrAA-220FS,Varian,US)测量钙离子浓度。血清渗透压用蒸汽压渗透压计(Wescor,5500XR,Logan,UT)测量其渗透压值。用自动血液分析仪(BC-2800vet,Manrui,China)测量红细胞数目、白细胞数目和血小板数目。葡萄糖浓度和血红蛋白浓度用标准试剂盒测定(Jiancheng Bioengineering,Nanjing,China)。提取鳃组织总RNA并检测NCXs和PMCAs基因的相对表达量。
1.6 数据处理
所有数据采用均值±标准差(Means±SD)表示。采用 2-ΔΔCt法进行数据处理[21]。利用统计学软件SPSS 23对时间和钙离子浓度进行双因子方差分析(two-way ANOVA)(表2),组织表达用单因子方差分析(one-way ANOVA),通过t检验计算P值,若P<0.05,则差异显著。用Origin 8.6绘制柱状图。

表2 时间和钙离子浓度的双因素分析Tab.2 Two-way ANOVA of time and Ca2+concentration
2 结果与分析
2.1 不同钙离子胁迫下花鳗鲡血清钙浓度和血清渗透压的变化规律
如图1所示,血钙浓度(图1-A)和血清渗透压(图1-B)与周围钙浓度成正相关。在高钙离子环境中,血钙浓度和血清渗透压随着时间的延长成下调趋势;在缺钙环境中,血钙浓度和血清渗透压随着时间的增加成上调趋势。3种钙浓度组血钙浓度和血清渗透压在第7天差异均不显著(P>0.05)。
2.2 不同钙离子浓度下对花鳗鲡血液学指标的影响
如图2所示,白细胞数目(图2-A)、红细胞数目(图2-B)、血小板数目(图2-C)、血红蛋白浓度(图2-D)和葡萄糖浓度(图2-E)和周围钙浓度成正相关。在高钙与缺钙环境中,白细胞数目、红细胞数目、葡萄糖浓度、血红蛋白浓度和血小板数目随着时间的延长成下调趋势,且较对照组在第1、4天具有显著性差异(P<0.05)。而在第7天白细胞数目、红细胞数目、葡萄糖浓度、血红蛋白浓度和血小板数目各组的差异并不显著(P>0.05)。
2.3 NCXs和PMCAs基因在花鳗鲡不同组织表达分布
qRT-PCR结果显示(图3),NCXs和 PMCAs基因在花鳗鲡脑、鳃、头肾、后肾、前肠、中肠、后肠、肝、心、肌肉、鳔、脾和皮肤这13种组织中均有表达,具有广泛表达的特点。其中,花鳗鲡NCX1(图3-A)和 PMCA4(图3-E)基因在头肾中表达量最高,NCX2(图3-B)和 NCX3(图3-C)在皮肤中表达量最高,PMCA2(图3-D)在后肾中表达量最高,而在前肠中5个基因表达量则最低。
2.4 不同钙处理、不同时段下花鳗鲡NCXs和PMCAs基因的表达模式
在急性高钙胁迫下,花鳗鲡NCX1(图4-A)和PMCA4(图5-B)基因在鳃组织的mRNA表达在第1天均显著上调;在缺钙环境中,其mRNA表达量显著下调。对于NCX1基因,随着适应时间的延长,在第4天和第7天高钙环境下的mRNA表达量显著上升,而在缺钙环境中mRNA表达量显著降低,在第7天各处理组差异显著(P<0.05);对于 PMCA4,随着适应时间的延长,在第4天和第7天高钙环境下PMCA4基因的mRNA表达量显著下调,而在缺钙环境中mRNA表达上调,在第7天各处理组无显著差异(P>0.05)。但对于 NCX2(图 4-B)、NCX3(图 4-C)和PMCA2(图5-A),其表达量随时间无明显的变化。
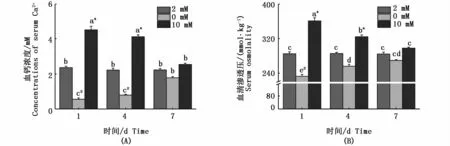
图1 不同钙浓度下花鳗鲡胁迫1、4和7 d的血钙浓度和血清渗透压Fig.1 Serum osmolarity and Ca2+concentration in Anguilla marmorata adapted to different Ca2+ concentrations for 1 day,4 or 7 days注:不同时间点和不同钙离子浓度的差异显著性用不同字母表示。同一时间点不同处理组之间的差异性用不同符号*(高钙组与对照组具有显著性差异)和#(缺钙组与对照组具有显著性差异)表示(P<0.05,two-way ANOVA)Note:Significant differences between Ca2+concentrations and different time points are identified by different letters;and different symbols*and#indicate significant differences between groups at the same time point(P<0.05,two-way ANOVA)
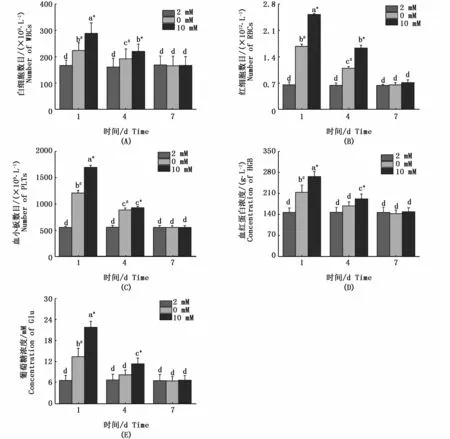
图2 不同钙浓度下花鳗鲡胁迫1、4和7 d的各项血液指标Fig.2 Hematology index in Anguilla marmorata adapted to different Ca2+ concentrations for 1 day,4 or 7 days注:不同时间点和不同钙离子浓度的差异显著性用不同字母表示。同一时间点不同处理组之间的差异性用不同符号*(高钙组与对照组具有显著性差异)和#(缺钙组与对照组具有显著性差异)表示 (P<0.05,two-way ANOVA)Note:Significant differences between Ca2+concentrations and different time points are identified by different letters;and different symbols*and#indicate significant differences between groups at the same time point(P<0.05,two-way ANOVA)
3 讨论
Ca2+是自然海水的重要组成成分,对鱼类的神经元兴奋性、肌肉收缩、细胞渗透性、细胞分化、激素释放和骨组织的矿物化等生理功能均具有重要影响[19]。海水中钙离子浓度约为10 mM,淡水中钙离子浓度约为2 mM,洄游性鱼类在洄游过程中需要面对不断变化的钙离子浓度[17]。因此,研究洄游性鱼类体内控制钙离子的进出机制及钙离子的稳态具有非常重要的意义。CRUZ等[20]提出在鱼类鳃细胞表面的跨膜转运是由上皮钙通道调节,而这个钙通道则由质膜钙ATP酶PMCA和钙转运体 NCX组成。HOENDEROP等[15]研究表明钙离子的流出需一个较大的电化学梯度,位于吸收细胞质膜上的两个钙离子转运体需NCX和PMCA负责将钙离子排出。考虑到NCX和PMCA是主要的运输Ca2+的跨膜蛋白,因此我们选择NCX和PMCA为靶蛋白,通过极性钙浓度胁迫来测定NCX基因3个亚型和PMCA基因2个亚型的mRNA时序表达,其次,测定了这5种基因亚型的组织表达分布,以及极性钙浓度环境下花鳗鲡血清中的钙浓度、渗透压和血液生理指标,为鱼类钙稳态的研究提供基础资料。
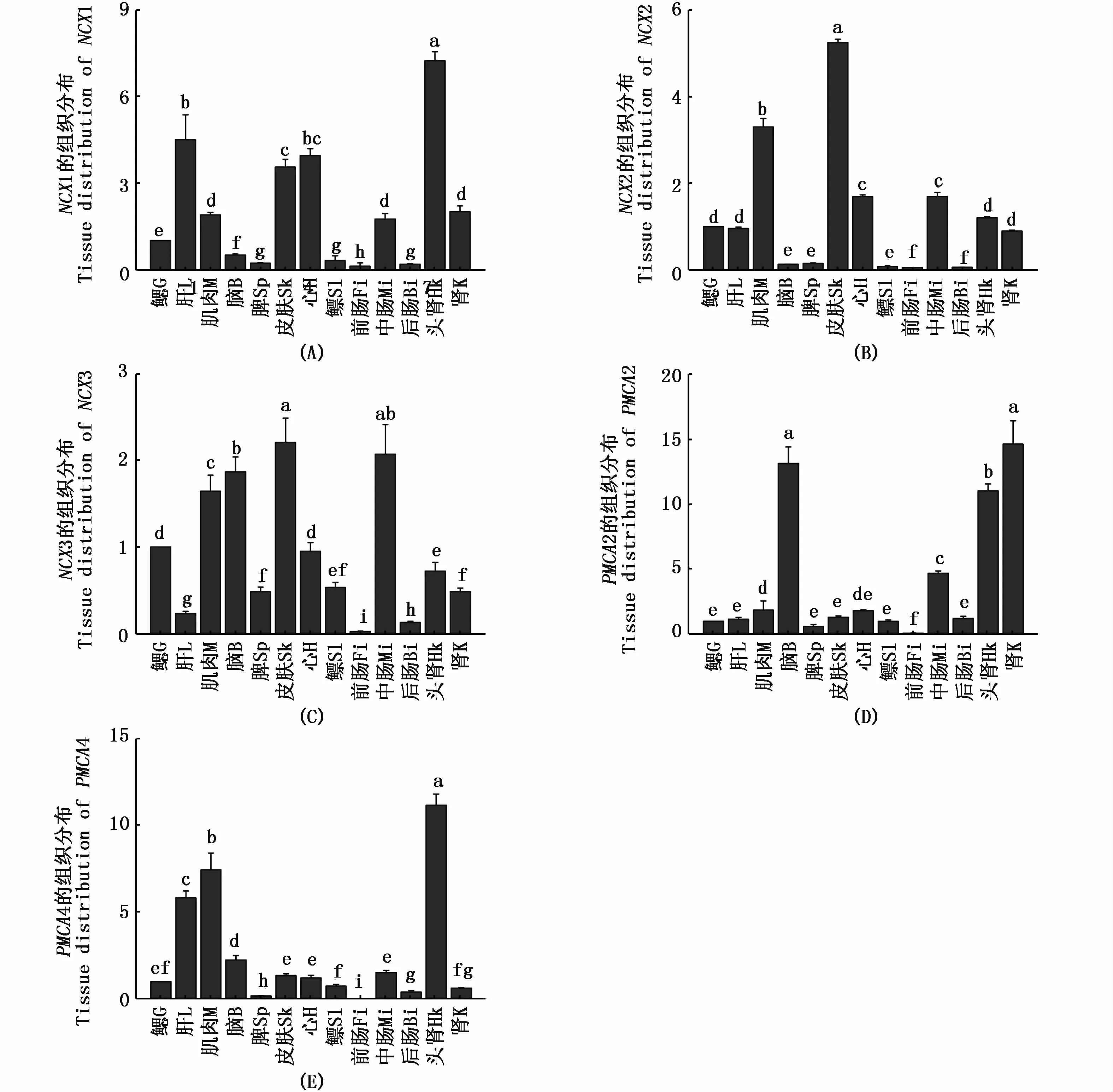
图3 花鳗鲡 NCX1(A)、NCX2(B)、NCX3(C)、PMCA2(D)和 PMCA4(E)在不同组织中的表达规律Fig.3 Tissue distribution analysis of NCX1(A),NCX2(B),NCX3(C),PMCA2(D),and PMCA4(E)at the mRNA level注:不同组织相对表达的差异显著性用不同字母表示 (P<0.05,一维方差分析)。G:gill;L:liver;M:muscle;B:brain;Sp:spleen;Sk:skin;H:heart;Sl:swim bladder;Fi:front intestine;Mi:middle intestine;Bi:back intestine;Hk:head kidney;K:kidneyNote:Significant differences among different tissues are indicated by different letters(P <0.05,one-way ANOVA).G:gill;L:liver;M:muscle;B:brain;Sp:spleen;Sk:skin;H:heart;Sl:swim bladder;Fi:front intestine;Mi:middle intestine;Bi:back intestine;Hk:head kidney;K:kidney
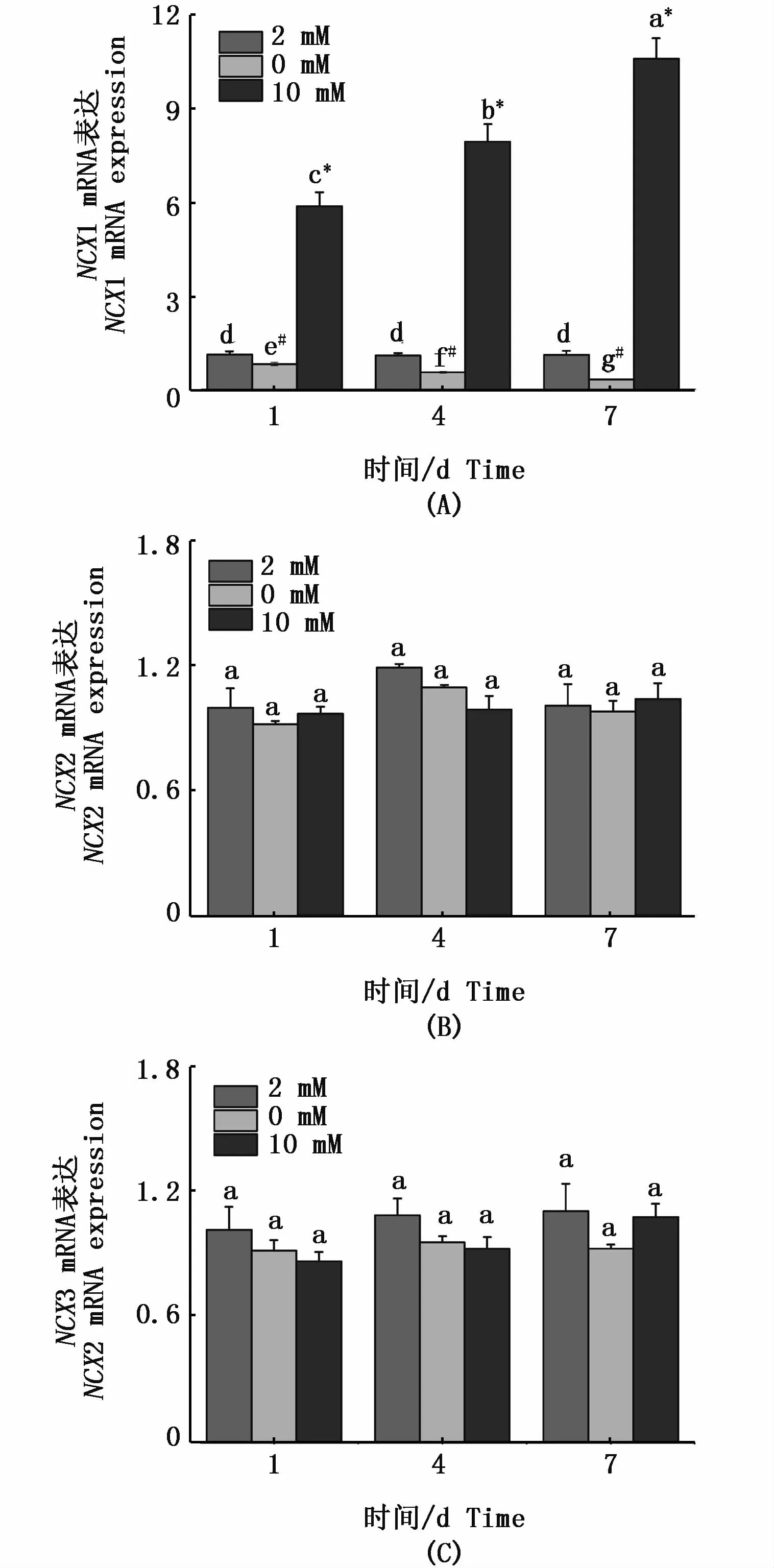
图4 花鳗鲡 NCX1(A)、NCX2(B)和 NCX3(C)在鳃中不同时间点应对不同钙浓度的表达规律Fig.4 Expressions of NCX1(A),NCX2(B)and NCX3(C)in gill of Anguilla marmorata in response to different Ca2+concentrations at different time points注:不同时间点和不同钙离子浓度的差异显著性用不同字母表示。同一时间点不同处理组之间的差异性用不同符号*(高钙组与对照组具有显著性差异)和#(缺钙组与对照组具有显著性差异)表示 (P<0.05,two-way ANOVA)Note:Significant differences between Ca2+ concentrations and different time points are identified by different letters;and different symbols*and#indicate significant differences between groups at the same time point(P<0.05,two-way ANOVA)
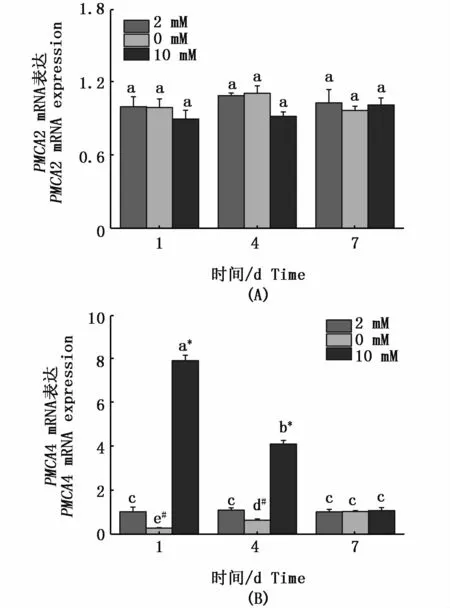
图5 花鳗鲡PMCA2(A)和PMCA4(B)在鳃中不同时间点应对不同钙浓度的表达规律Fig.5 Expressions of PMCA2(A)and PMCA4(B)in gill of Anguilla marmorata in response to different Ca2+concentrations at different time points注:不同时间点和不同钙离子浓度的差异显著性用不同字母表示。同一时间点不同处理组之间的差异性用不同符号*(高钙组与对照组具有显著性差异)和#(缺钙组与对照组具有显著性差异)表示(P<0.05,two-way ANOVA)Note:Significant differences between Ca2+ concentrations and different time points are identified by different letters;and different symbols*and#indicate significant differences between groups at the same time point(P<0.05,two-way ANOVA)
目前国内对于鱼类渗透压的研究主要集中在盐度胁迫,王丹等[22]研究了如花鳗鲡AQP3基因在不同盐度下表达规律。而钙胁迫对鱼类血清渗透压的影响报道不多。褐牙鲆(Paralichthys olivaceus)低钙条件下血清渗透压在6 h时显著上升,而12 h后下降至正常水平并维持稳定[23]。在本研究中也出现了稳态现象,缺钙环境下血清渗透压和钙离子浓度起初较低,但随着时间的增加显著地上升,在第7天3种环境下的钙离子浓度达到稳态。同样在高钙环境胁迫1 d后,血清渗透压和血钙浓度逐渐下降到稳定状态,此结果表明,随着周围环境钙浓度的增加,花鳗鲡主动或被动地减少了钙离子的吸收。CARRIER等[24]认为,水中Ca2+浓度的变化可增强鳃上皮细胞对水和离子的通透性。血细胞对鱼体自身生理状态的变化及外界环境因子刺激非常敏感,其血液指标能反映鱼类的正常生理状态[25]。笔者测定了各项血液指标(白细胞数目、红细胞数目、葡萄糖浓度、血红蛋白浓度和血小板数目),处理组相较对照组各项指标随时间呈先升高后下降的趋势,在第7天各项指标呈稳定状态。以上结果均表明花鳗鲡体内存在一种钙离子调节机制以维持机体内的钙离子稳态。
组织表达结果显示,花鳗鲡NCX和PMCA基因的各个亚型在肾脏中均呈现高表达,在肾脏中通过过滤吸收钙离子致使肾组织表达量相对较高,这与肾脏作为动物吸收钙离子的主要器官相吻合[16]。另外,动物主要通过食物来获得钙,其全身的钙守恒主要通过肠的吸收和肾脏的重吸收来维持进行[26]。本实验中一些钙通道蛋白皮肤组织的表达量较高,如NCX1和NCX2,笔者推测鱼类主要通过皮肤和鳃来增强钙离子的吸收,由于皮肤和鳃与外界的水环境直接接触且皮肤和鳃是离子交换的主要场所[26]。LIN等[27]研究显示鱼类从淡水中获得钙离子主要通过鳃和肠,而鳃是钙离子吸收的主要场所。LAFONT等[16]通过对斑马鱼上皮钙离子通道NCX1和PMCA2特异性表达的研究,结果显示两个基因在富含线粒体的鳃细胞中表达量最高。本研究中鳃组织表达量并不高,笔者推测是由于钙离子的吸收机制发生在鳃中富含线粒体的细胞,其中钠钙交换体NCX与质膜钙离子泵PMCA参与钙离子的吸收,它们从质膜中排出钙离子到血液中,故钙离子在鳃中的浓度降低,所以鳃中的表达量并不高。综上,本文以鳃为靶器官作为研究,探索外界钙离子浓度变化时花鳗鲡NCX和PMCA哪些亚型的表达发生了变化,为鱼类洄游中钙稳态的研究提供了一定的基础资料。
鳃组织中钙离子转运体的mRNA表达量反应了鳃中的钙含量。在本研究中,随着缺钙环境时间的延长,NCX1亚型基因mRNA表达量逐渐减弱,高钙环境下NCX1亚型基因mRNA表达量显著增长,而其它NCX亚型在外界钙浓度环境改变下表达量均未发生改变。有研究报道,控制钙离 子 的 排 出 主 要 靠 NCX1 亚 型[28],LANGENBACHER等[11]认为在鱼肠上皮细胞NCX1是细胞膜排出钙离子的主要蛋白,高钙环境下可以通过质膜钙离子泵NCX1将Ca2+排出。由此,笔者推测:为了维持花鳗鲡机体内钙离子稳态,在高钙环境下,鳃组织中的NCX1表达量持续升高,促使鳃细胞将过多的钙离子排出胞外;而在低钙环境下,NCX1表达量持续降低,以减少鳃细胞中钙离子的流失。而PMCA4亚型基因在缺钙环境下表达量逐渐增强,高钙环境下表达量逐渐降低,在第7天3种钙浓度下出现钙稳态状态。推测低钙环境可以诱发PMCA钙运输能力的增强,这在虹鳟、莫桑比克罗非鱼、斑马鱼、金鱼 (Carassius auratus)和香鱼 (Plecoglossus altivelis)中都有报道[26-30]。HOENDEROP等[15]研究表明,PMCA4在钙离子的排出机制中具有重要作用,本研究的时序表达验证了PMCA4在低钙环境下控制钙离子的排出,高钙环境下加快钙离子的排出,证实了PMCA4具有钙稳态调控器的作用。而在斑马鱼中,LARONT等[16]研究发现上皮钙离子通道PMCA2在鳃中MR细胞选择性表达,并参与跨膜钙离子吸收,本研究的结果并没有证实PMCA2在钙离子的调控作用,笔者推测不同物种间PMCA不同亚型扮演的功能有所不同。在小龙虾(Procambarus clarkia)钙离子的输送机制研究中,WHEATLY等[31]阐述了 NCX家族基因在钙转运过程扮演“驮马”的功能,而PMCA在钙离子转运过程中并不扮演任何作用。
本研究显示,在极性钙浓度环境下,花鳗鲡鳃组织的NCX1和PMCA4在胁迫不同时段中呈现不同的表达变化模式,并且在各时段中,NCX1和PMCA4基因的表达水平均呈显著的差异。进一步说明,NCX1和PMCA4在花鳗鲡钙稳态调节过程中扮演了重要角色。
