离子液中K2CO3催化邻炔基苯氨衍生物环化合成吲哚类化合物研究*
2018-08-03黄炳南蒋珍珍金琦琦陆佳艳孟陈婷吴家守
刘 熠,黄炳南,蒋珍珍,金琦琦,陆佳艳,孟陈婷,吴家守
(台州学院 医药化工学院, 浙江 台州 318000)
吲哚及其衍生物是自然界中广泛存在的一类物质,在很多具有生物活性的天然或非天然化合物中都能找到吲哚的身影[1-2]。因此,该类化合物合成一直来是人们研究的热点。自从1883年Fischer和Jourdan发现了首例吲哚合成法即著名的“Fischer吲哚合成法”[3],很多关于吲哚类化合物的制备方法相继被报道[4-5]。在众多的吲哚合成方法中,通过邻炔基苯胺类化合物的环化来构建吲哚骨架是合成吲哚类化合物最方便、有效的方法之一,该方法常需要加入各种过渡金属,在有机溶剂中进行[5-9]。然而使用有机溶剂和过渡金属催化剂并不符合绿色化学发展的理念,因此,在人们对自身生存环境的日益关注的大背景下,发展更具环境友好型的该类反应是很有意义的。在2015年,国内一课题组以水为绿色溶剂,实现了N活化的邻氨基苯炔类化合物的环化反应,但该反应仍需使用固载的过渡金属铜催化剂[7]。最近,我们课题组开发了水相简单无机碱催化的邻炔基苯胺类化合物的环化反应[10],并以高产率得到相应的吲哚衍生物。虽然反应以水为溶剂且无需过渡金属,优点明显,但水相130℃的封管反应条件较为苛刻。除水以外,离子液体作为绿色溶剂在有机合成中也有着广泛的应用。离子液具有热稳定性高、溶解性好、蒸气压极低、可回收循环使用等诸多优点[11]。有鉴于此,我们希望能在离子液中进行活化的邻炔基苯胺类化合物的环化反应,从而实现在敞口无需密封条件下制备吲哚衍生物。
1 实验部分
邻炔基苯胺类化合物的环化反应实验步骤:将邻氨基苯炔化合物1(0.3 mmol)和碳酸钾(4.2 mg,0.03 mmol)加入到反应瓶内,随后加入1,3-二甲基咪唑六氟磷酸盐(0.5 mmol)空气氛下直接加热反应10 h。反应结束后,冷却,用乙酸乙酯和石油醚的混合溶剂(体积比1:1)萃取(5 mL×6)。合并有机相,蒸去溶剂后,经柱层析得产物。2a-2m均为已知化合物。
2a:1H NMR(400 MHz,CDCl3): δ8.29(d,J=12.0 Hz,1H),7.43-7.40(m,3H),7.35-7.31(m,1H),7.28-7.22(m,5H),7.03(d,J=8.0 Hz,2H),6.51(s,1H),2.74(q,J=8.0 Hz,2H),2.27(s,3H),1.31(t,J=8.0 Hz,3H)ppm;13C NMR(100 MHz,CDCl3): δ 144.8,144.4,142.4,138.2,134.7,130.6,130.3,129.7,129.1,127.0,126.8,124.6,124.2,120.6,116.7,113.3,28.7,21.5,15.3 ppm;
2b:1H NMR(400 MHz,CDCl3): δ 8.30(dd,J=8.0 Hz,J=0.8 Hz,1H),7.43-7.40(m,3H),7.35-7.31(m,1H),7.23-7.21(m,3H),7.03(d,J=8.0 Hz,2H),6.97-6.93(m,2H),6.47(d,J=0.8 Hz,1H),3.88(s,3H),2.28 (s,3H)ppm;13C NMR (100 MHz,CDCl3): δ 160.0,144.4,142.0,138.2,134.8,131.7,130.6,129.2,126.8,124.7,124.5,124.2,120.5,116.7,113.0,112.9,55.3,21.5 ppm。
2c:1H NMR(400 MHz,CDCl3): δ 8.31(d,J=8.0 Hz,1H),7.51-7.48(m,2H),7.45-7.40(m,4H),7.37-7.33 (m,1H),7.28-7.24 (m,3H),7.03 (d,J=8.0 Hz,2H),6.53 (s,1H),2.27 (s,3H)ppm;13C NMR (100 MHz,CDCl3): δ 144.5,142.1,138.3,134.7,132.4,130.5,130.3,129.2,128.6,127.5,126.8,124.8,124.3,120.7,116.7,113.6,21.5 ppm。
2d:1H NMR(400MHz,CDCl3): δ 8.30(dd,J=8.0 Hz,J=0.8 Hz,1H),7.57-7.54(m,2H),7.45-7.43(m,1H),7.39-7.34(m,3H),7.29-7.25(m,3H),7.04(d,J=8.0 Hz,2H),6.54(s,1H),2.28(s,3H)ppm;13C NMR(100 MHz,CDCl3): δ 144.7,140.9,138.4,134.5,131.7,131.4,130.8,130.4,129.3,126.7,125.1,124.5,123.1,120.8,116.7,114.0,21.5 ppm。
2e:1H NMR(400 MHz,CDCl3): δ 8.30(dd,J=8.4 Hz,J=0.8 Hz,1H),7.73-7.71(m,2H), 7.66-7.63(m,2H),7.46(d,J=7.6 Hz,1H),7.42-7.38(m,1H),7.31-7.27(m,1H),7.25-7.22(m,2H),7.05(d,J=8.0 Hz,2H),6.64(d,J=0.4 Hz,1H),2.29(s,3H)ppm;13C NMR(100 MHz,CDCl3): δ 145.0,140.0,138.7,137.1,134.1,131.4,130.6,130.3,129.4,126.7,125.7,124.8,121.2,118.7,116.8,115.6,112.1,21.5 ppm。
2f:1H NMR(400 MHz,CDCl3): δ 8.16(d,J=8.4 Hz,1H),7.61(d,J=8.4 Hz,2H),7.41-7.39(m,1H),7.26-7.16 (m,4H),6.37 (s,1H),2.98(t,J=8.0 Hz,2H),2.32 (s,3H),1.76-1.69(m,2H),1.49-1.39 (m,2H),0.95(t,J=7.2 Hz,3H)ppm;13C NMR(100 MHz,CDCl3): δ143.5,141.5,136.2,135.3,128.8,128.7,125.2,122.7,122.4,119.0,113.8,107.6,30.0,27.7,21.4,20.5,12.9 ppm。
2g:1H NMR(400 MHz,CDCl3): δ 8.05-7.99(m,1H),7.44-7.38(m,3H),7.19-7.13(m,2H),7.10(d,J=8.0 Hz,2H),6.60 (d,J=0.4 Hz,1H),2.28 (s,3H),1.58 (s,9H)ppm;13C NMR (100 MHz,CDCl3): δ 152.8, 144.0,139.0,136.9,129.5,129.2,126.0,124.1,123.6,120.3,116.1,110.7,35.0,31.4,21.5 ppm。
2h:1H NMR(400 MHz,CDCl3): δ 8.21(dd,J=8.4 Hz,J=0.8 Hz,1H),7.73-7.69(m,2H),7.38(dd,J=7.6 Hz,J=0.8 Hz,1H),7.28-7.24(m,1H),7.21-7.17(m,3H),6.18(s,1H),2.48-2.40(m,1H),2.34(s,3H),0.99-0.94(m,2H),0.61-0.57(m,2H)ppm;13C NMR(100 MHz,CDCl3): δ 144.6,144.1,137.4, 136.6,129.6,129.3,126.6,123.9,123.4,120.2,114.51,106.0,21.5,9.4,8.4 ppm。
2i:1H NMR(400 MHz,CDCl3): δ 8.42(dd,J=8.8 Hz,J=0.4 Hz,1H),7.75-7.74(m,1H),7.59(dd,J=8.8 Hz,J=1.6 Hz,1H),7.49-7.40(m,5H),7.28-7.24(m,2H),7.07(d,J=8.0 Hz,2H),6.59(d,J=0.4 Hz,1H),2.31(s,3H)ppm;13C NMR(100 MHz,CDCl3): δ 145.1,143.7,139.7,134.8,131.6,130.5,130.0, 129.5,129.1,127.6,126.8,126.5(q,J=32.1 Hz,1H),124.5(q,J=270.3 Hz,1H),121.4(q,J=3.6 Hz,1H), 118.1(q,J=4.0 Hz,1H),116.7,112.7,21.6 ppm。
2j:1H NMR(400 MHz,CDCl3): δ 8.62(s,1H),7.56-7.50(m,2H),7.49-7.41(m,5H),7.27-7.23(m,2H),7.06(d,J=8.0 Hz,2H),6.58 (s,1H),2.30(s,3H)ppm;13C NMR(100 MHz,CDCl3): δ 145.1,144.7,137.4,134.6,132.9,131.6,130.5,129.4,129.2,127.6,126.9,126.7(q,J=32.1 Hz),124.7 (q,J=270.4 Hz),121.0,120.9(q,J=3.9 Hz),114.0(q,J=4.4 Hz),112.6,21.6 ppm。
2k:1H NMR(400 MHz,CDCl3): δ8.17(d,J=8.0 Hz,1H),7.51-7.48(m,2H),7.43-7.39(m,3H),7.27-7.25(m,2H),7.21(s,1H),7.16(dd,J=8.6 Hz,1.4 Hz,1H),7.03(d,J=8.0 Hz,2H),6.46(s,1H),2.41(s,3H),2.27(s,3H)ppm;13C NMR(100 MHz,CDCl3): δ 144.4,142.3,136.5,134.7,134.0,132.5,130.8,130.3,129.1,128.6,127.5,126.8,126.2,120.6,116.4,113.6,21.5,21.3 ppm。
2l:1H NMR(400 MHz,CDCl3): δ 7.97(d,J=8.0 Hz,1H),7.76(d,J=8.0 Hz,2H),7.56(d,J=4.0 Hz,1H),7.52(d,J=8.0 Hz,1H),7.32-7.28(m,1H),7.25-7.19(m,3H),6.64(d,J=4.0 Hz,1H),2.32(s,3H)ppm;13C NMR (100 MHz,CDCl3): δ 144.9,135.4,134.8,130.7,129.8,126.8,126.3,124.5,123.2,121.3,113.5,109.0,21.5 ppm。
2m:1H NMR (400 MHz,CDCl3): δ 8.41 (d,J=8.2 Hz,1H),7.78-7.71 (m,2H),7.65-7.58(m,2H),7.55-7.51(m,2H),7.43-7.36(m,1H),7.36-7.28(m,2H),6.62(d,J=3.7 Hz,1H)ppm;13C NMR(100 MHz,CDCl3): δ 168.7,136.0,134.6,131.9,130.8,129.2,128.6,127.6,124.9,124.0,120.9,116.4,108.6 ppm。
2 结果与讨论
以邻炔基苯胺类化合物1a为标准底物,以30 mol%的氢氧化钾催化剂,在反应温度为90℃时,首先对离子液进行了筛选(见图1和表1)。结果表明1,3-二甲基咪唑六氟磷酸盐为最佳离子液。随后对温度和碱及其用量也进行了筛选,结果表明,以1,3-二甲基咪唑六氟磷酸盐离子液为反应介质,在反应温度为110℃时,以10 mol%的碳酸钾为催化剂,1a能基本定量地环化生成2a(见表1,entry 13)。
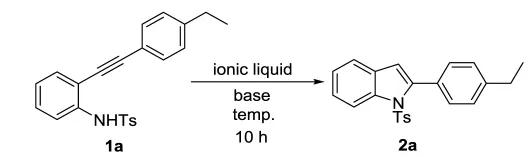
图1 离子液中化合物1a的环化反应Fig.1 The cyclization reaction of 1a in ionic liquid
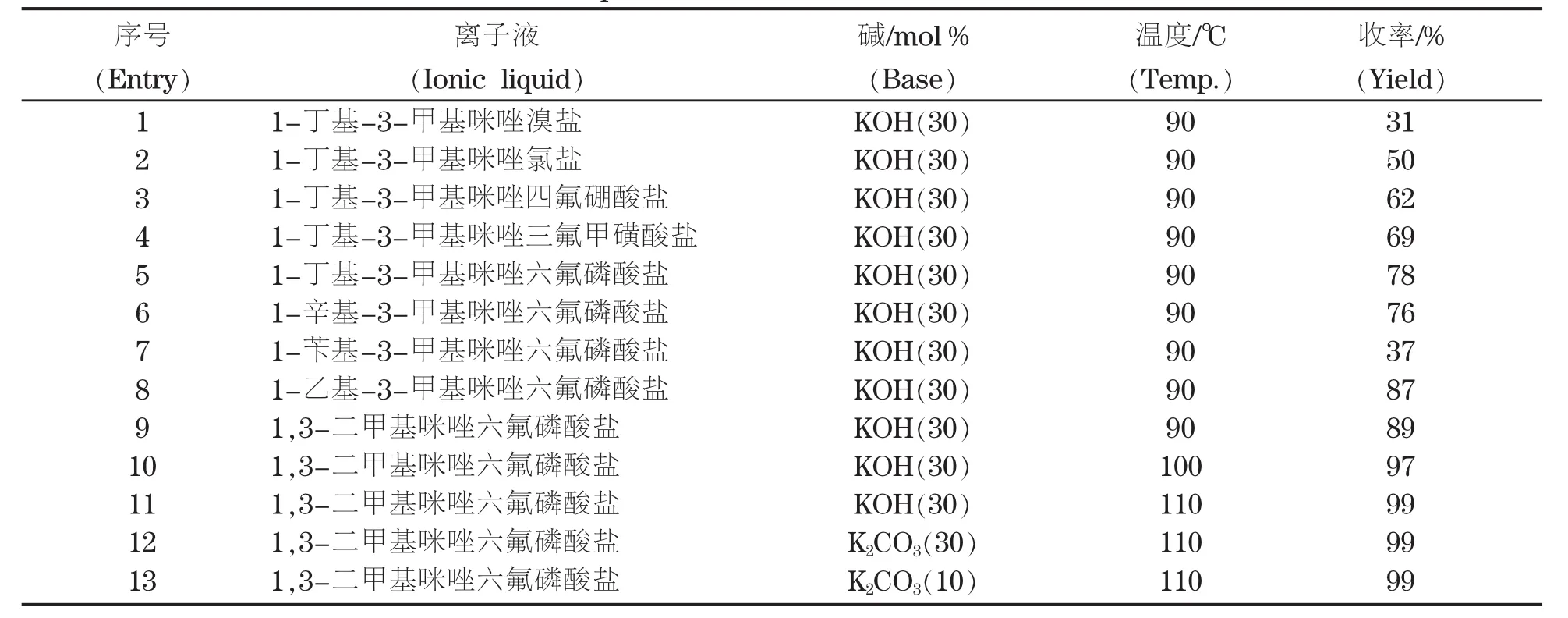
表1 反应条件的优化Table.1 Optimization of the reaction conditions
对底物适用范围的筛选结果表明(见表2),苯胺芳环上取代基的性质对反应影响并不大,无论是含吸电子基的还是供电子基的底物,反应都能顺利地进行。而对于炔基这边的取代基对反应影响会比较大点:如果是苯基取代的底物,反应在110℃下都能给出高的产率;对于烷基取代的底物则需要更高的反应温度才行。值得指出的是,对于氮上苯甲酰及取代的底物1m在以前的水相反应体系中是不会发生环化反应的,但在目前的离子液反应条件下也能发生环化反应,虽然只有中等水平的产率。

表2 离子液中邻氨基苯炔的环化反应合成吲哚化合物Table.2 Synthesis of indoles by cyclization reaction of 2-alkynylanilines in ionic liquid
3 结论
本文以1,3-二甲基咪唑六氟磷酸盐离子液为反应介质,在空气氛下以催化量的碳酸钾为催化剂,成功实现了邻炔基苯胺类化合物的环化反应,并高产率地制备了一系列具有潜在生理活性的吲哚类化合物。与已有文献报道的方法相比,本方法无需有机溶剂和金属催化剂,具有绿色、操作更加简便等优点。
