明胶-壳聚糖组织工程神经支架材料与骨髓间充质干细胞的相容性研究
2018-07-26陈晚华卜冰倩周权常臻张军东吴剑英
陈晚华 卜冰倩 周权 常臻 张军东 吴剑英


摘 要 目的:观察明胶-壳聚糖神经支架材料与大鼠骨髓间充质干细胞细胞相容性。方法:将明胶-壳聚糖组织工程神经支架材料或浸提液与SD大鼠骨髓间充质干细胞共同培养作为实验组,以体积分数10% FBS培养液培养骨髓间充质干细胞作为对照组。观察细胞在支架材料上生长存活情况。结果:MTT检测结果显示,共培养5、7 d,实验组吸光度值高于对照组(P<0.05);扫描电镜观察结果显示骨髓间充质干细胞在明胶-壳聚糖组织工程神经支架材料上生长良好。结论:明胶-壳聚糖组织工程神经支架材料与骨髓间充质干细胞具有良好的相容性,可作为优良的载体用于构建人工仿生神经。
关键词 壳聚糖 组织工程 间充质干细胞
中图分类号:Q813.12 文献标志码:A 文章编号:1006-1533(2018)11-0089-04
Study on the compatibility of mesenchymal stem cells with the gelatin-chitosan tissue engineering nerve scaffold material CHEN Wanhua1*, BU Bingqian1, ZHOU Quan2, CHANG Zhen1, ZHANG Jundong2, WU Jianying2**(1. Shanghai Medical Absorption Bio-Material Innovation and Transformation Promotion Center, Shanghai 200052, China;2. Shanghai Haohai Biological Technology Co., LTD., Shanghai 200030, China)
ABSTRACT Objective: To observe the cellular compatibility of gelatin-chitosan nerve scaffold material with rat bone marrow mesenchymal stem cells. Methods: The gelatin-chitosan nerve tissue engineering scaffold material or leaching solution with SD rat bone marrow mesenchymal stem cell co-culture was taken as an experimental group and bone marrow mesenchymal stem cells incubated in 10% FBS nutrient solution as a control group. The growth and survival of cells on scaffold materials were observed. Results: MTT assay results showed that absorbance value of the experimental group was higher than that of the control group after 5 and 7 days of co-cultivation (P<0.05). Scanning electron microscopy observations showed that bone marrow mesenchymal stem cells grew well on the gelatin-chitosan tissue engineering scaffolds. Conclusion: Gelatin-chitosan tissue engineered nerve scaffolds have good compatibility with bone marrow mesenchymal stem cells, and can be used as a good carrier to construct artificial bionic nerve.
KEy WORDS chitosan; tissue engineering; mesenchymal stem cell
目前,周圍神经的损伤及修复仍然是尚未解决的全球性医学难题。对于短节段(<30 mm)神经损伤,手术可以直接吻合损伤的神经残端,使近端神经纤维能够朝向远端发育生长。然而,对于长节段(>30 mm)的神经缺损,手术无法进行无张力直接缝合,国际上治疗“金标准”是将未损伤的非重要区域的自体神经移植到受损伤区来修复桥接损伤的神经[1-2]。但是,临床上手术应用自体神经移植受到各种限制:供区需进行二次手术;供区神经来源不足,造成继发的医源性供区神经功能丧失以及供区神经在组织的结构和尺寸的大小上与需修补神经匹配不良等问题。运用组织工程学方法制备组织工程移植物修复桥接长节段神经缺损获得越来越多的关注。本实验在既往广泛研究的明胶-壳聚糖组织工程材料的基础上[3-4],成功制备了高仿真明胶-壳聚糖神经支架材料。在此基础上添加了骨髓间充质干细胞构建人工仿生神经,探讨此材料与细胞的生物相容性。
1 材料和方法
1.1 明胶-壳聚糖导管的制备
1.1.1 试验材料与设备
明胶(生物级,天津市科密欧化学试剂有限公司);Alpha 2-德国Christ实验室工艺冷冻干燥机(长春宝辰科技发展有限公司);壳聚糖(脱乙酰度95%,美国Sigma公司);冰醋酸、氢氧化钠、碳酸钾、氯化钠均为市售分析纯。试剂及仪器:α-MEM培养基、胎牛血清、体积分数0.25%乙二胺四乙酸胰蛋白酶消化液、MTT、二甲基亚砜(武汉博士德生物工程有限公司);神经生长因子3(海特生物制药股份有限公司)。
CO2培养箱(美国From Scientific公司);SW-CJIFD型净化工作台(万净集团安泰公司);IX-70型倒置相差显微镜、JSM-5610LV型扫描电镜(日本Olympus公司)。ZQPW-70恒温振荡培养箱(常州金坛精达仪器制造有限公司);ELx800酶联免疫检测仪(美国BioTek公司)。
1.1.2 明胶-壳聚糖悬浊液的制备
将明胶溶于去离子水后在40 ℃水浴加热,配成10%明胶溶液;将壳聚糖溶于2%的醋酸溶液中制备成2%的壳聚糖溶液。将两种溶液按质量分数明胶-壳聚糖=4∶6的比例混合,既往研究显示,明胶/壳聚糖在4/6比例时,吸湿性较好,同时具有较好的拉伸强度[4]。然后再次放入40 ℃水浴中搅拌混匀,同时加入神经生长因子3,静置24 h。将制备成功的悬浊液缓慢注入内径为10 mm、外径为12 mm、长200 mm的硅胶套管中,用铅丝严密密封两端。
1.1.3 明胶-壳聚糖悬浊液注模成型
采用冷淋技术,将注模成功的样品缓慢浸入深低温冷淋剂(液氮)中,当完全浸入液面后保留30~60 min,再放入-80 ℃冰箱中保留30~60 min。使混悬液中沉淀物周围形成连续、相互沟通的溶剂冰晶网架构。
1.1.4 冷淋干燥成形处理
将制备成功的200 mm长的明胶-壳聚糖悬浊液的硅胶管冷冻体,精确切成30 mm短节段,放置于预冷好的铝弯盘中,置入Alpha 2冷冻干燥机,在-60 ℃、1×104 pa下冷冻干燥24 h。支架中的溶剂冰晶发生升华,得到具有微孔结构的支架架构。真空状态下升温至0 ℃并维持6 h,继续升温至22 ℃维持30~60 min,解除真空状态,最后升至常温,即可制得干燥成形的高仿真明胶-壳聚糖支架材料。
1.2 支架材料与骨髓间充质干细胞的相容性
1.2.1 材料
实验动物:健康清洁级4周龄雄性SD大鼠4只,中科院上海实验动物中心,质量许可编号:SCXK(沪)2015-0012,体质量180~200 g。
1.2.2 实验方法
1)明胶-壳聚糖支架材料浸提液的制备 取支架材料100 mg装入15 ml离心管,然后加入3 ml细胞培养液。将离心管置于37 ℃恒温振荡培养箱于100 r/min培养24 h后取出浸提液,按1∶9稀释比例加入α-MEM培养液内混匀,浸提液制备过程确保无菌。
2)骨髓间充质干细胞的分离与培养 无菌条件下,抽取SD大鼠骨髓,置于无菌离心管中,1 120 g离心10 min后,弃上清液,重悬计数,调整细胞浓度为1×109/L。以1.5×107接种量接种于25 ml培养瓶(含培养液15 ml)中,置于37 ℃、5% CO2、饱和湿度培养箱孵育。24 h后换液,平均每3 d换液1次,至细胞基本铺满瓶底后用2.5 g/L胰酶消化,按1∶2比例传代,进行扩增、纯化培养[5]。
3)MTT法检测骨髓间充质干细胞活性 取第3代骨髓间充质干细胞以5×107/L细胞浓度接种于24孔培养板,培养液为3 ml,细胞数为1.5×105。实验组加明胶-壳聚糖支架材料浸提液0.2 ml,对照组加含体积分数10%胎牛血清的培养液0.2 ml,置于37 ℃、5% CO2、饱和湿度下孵育。隔天半量换液,连续培养7 d。分别取培养1,3,5,7 d细胞进行MTT法检测[6-7],应用酶联免疫检测仪于570 nm波长测定吸光度值,记录实验数据。
4)扫描电镜观察骨髓间充质干细胞在材料表面的生长情况 将无菌的明胶-壳聚糖支架材料剪成12孔培养板孔洞大小,与细胞浓度为1×109/L骨髓间充质干细胞共置于12孔培养板中、37 ℃、体积分数5% CO2及饱和湿度条件下孵育。将培养7 d后的材料取出,PBS冲洗3次,体积分数2.5%戊二醛4 ℃固定1 h。用体积分数30%,0%,75%,80%,90%,100%叔丁醇脱水,前4级脱水各1次,每次10 min,后2级脱水各2次,每次10 min。保留样本内叔丁醇于-20 ℃冷冻4 h,真空生华干燥2 h;喷金,在扫描电镜下观察材料表面细胞生长状况。
5)主要观察指标 与明胶-壳聚糖支架材料或浸提液共培养的骨髓间充质干细胞生长情况、细胞活力及细胞凋亡率。
2 结果
2.1 分离培养的骨髓间充质干细胞形态
原代骨髓间充质干细胞接种后24 h内开始出现贴壁现象,此时细胞大多呈圆形,72 h后多数细胞呈梭形,细胞核较大,扁圆形。经过3代培养后得到的骨髓间充质干细胞为长梭形,融合后排列成漩涡状、网状、辐射状结构(图1)。
2.2 明胶-壳聚糖支架材料浸提液对骨髓间充质干细胞形态的影响
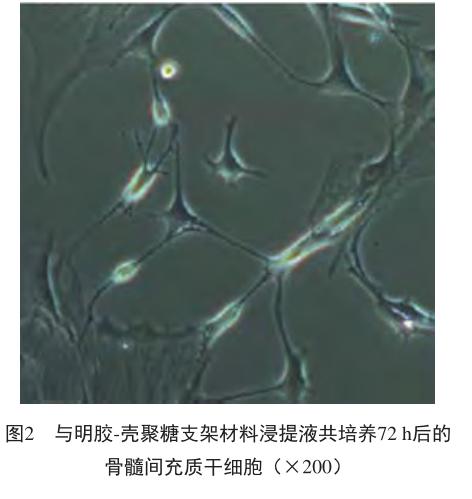
骨髓间充质干细胞与明胶-壳聚糖支架材料浸提液共培养72 h后,呈典型神经细胞样改变,有两个或多个突起,细胞突起之间相互连接成网状,胞质回缩,胞体呈多角形或不规则形,折光性明显增强(图2)。
2.3 明胶-壳聚糖支架材料浸提液对骨髓间充质干细胞活力的影响
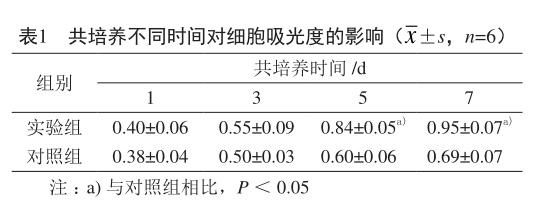
实验采用MTT法检测实验组和对照组细胞吸光度值,结果发现,在共培养后第5、7 天,实验组的吸光度值明显高于对照组(P<0.05,表1)。隨着培养时间的延长,根据吸光度值描绘的生长曲线发现,实验组和对照组吸光度值逐渐增大,表明细胞活性逐渐增加,实验组吸光度值明显大于对照组,即实验组细胞活性高于对照组(图3)。表明明胶-壳聚糖支架材料浸提液对骨髓间充质干细胞无毒性作用,同时,能显著增加细胞活性。
2.4 明膠-壳聚糖支架材料对骨髓间充质干细胞生长的影响
扫描电镜观察见共培养7 d,明胶-壳聚糖支架材料部分降解,其表面细胞数较多,细胞生长状态良好,体积较大,胞体发出多个突起,并且细胞之间相互连接交织成网状,其轴突较长而且较粗,呈典型神经元样细胞表现(图3),说明其降解产物无细胞毒性,支架材料释放的神经营养因子3具有促进骨髓间充质干细胞向神经元样细胞分化的作用,细胞相容性良好。
3 讨论
目前,周围神经损伤的修复仍是医学界面临的巨大难题。对于长段、粗大的神经缺损,临床上主要采用自体神经移植以恢复患肢功能[5]。然而,此法会造成供体神经支配区感觉、功能障碍,且自体神经来源有限。组织工程学研究为解决这一问题提供了新思路。种子细胞和导管支架制成的复合体是构建组织工程的核心[6],构建组织工程化人工神经已成为国内外研究的热点[7-8]。
组织工程中研究较多的种子细胞有:骨髓间充质干细胞、神经干细胞以及胚胎干细胞等[8]。研究发现,骨髓间充质干细胞具有多相分化潜能,可诱导分化为类雪旺细胞,在体外可形成髓鞘磷脂成分,分泌神经营养因子[10-12]。Cuevas等[9,13]将骨髓间充质干细胞注入5 mm的坐骨神经缺损处,于术后18~180 d分别检测神经功能恢复与细胞表型的变化,发现术后18 d神经功能恢复了36%,33 d恢复了78%,180 d恢复了96%,证实种子细胞可以有效的修复神经损伤。未来对于神经细胞形态和功能的模拟、重建以及神经移植等将是研究的重点。
目前,应用于临床的组织工程神经导管分为可降解型和非可降解型[14],包括:生物型神经导管、人工合成导管、复合组织导管。Takagi等[7]研究表明,神经再生和神经营养因子作用关系密切,当神经缺损超过一定距离后,由于营养物质供应的缺乏,导致神经残段不能重新连接。黄继锋等[16-17]用精氨酸-甘氨酸-天门冬氨酸多肽接枝聚(羟基乙酸-L-赖氨酸-乳酸)/聚乳酸/β-磷酸三钙/神经生长因子复合神经导管修复大鼠10 mm坐骨神经缺损,结果显示神经导管对坐骨神经缺损具有良好的桥梁作用,并能促进神经生长。理想的组织工程神经支架材料要有良好的生物相容性、可降解性、可塑性以及一定的机械强度[15,18-20]。研究者们希望在神经导管内添加干细胞、神经生长因子及内部支架结构组成复合神经导管用于更长段距离的神经缺损。
参考文献
[1] Nectow AR, Marra KG, Kaplan DL. Biomaterials for the development of peripheral nerve guidance conduits[J]. Tissue Eng Part B Rev, 2012, 18(1): 40-50.
[2] Tan A, Rajadas J, Seifalian AM. Biochemical engineering nerve conduits using peptide amphiphiles[J]. J Control Release, 2012, 163(3): 342-352.
[3] Pulieri E, Chiono V, Ciardelli G, et al. Chitosan/gelatin blends for biomedical applications[J]. J Biomed Mater Res A, 2008, 86(2): 311-322.
[4] 宋慧君, 孟春丽, 汤克勇. 明胶-壳聚糖复合膜的制备与性能[J]. 高分子材料科学与工程, 2011, 27(8): 165-167, 171.
[5] Gu X, Ding F, Yang Y, et al. Construction of tissue engineered nerve grafts and their application in peripheral nerve regeneration[J]. Prog Neurobiol, 2011, 93(2): 204-230.
[6] Pabari A, Yang SY, Mosahebi A, et al. Recent advances in artificial nerve conduit design: strategies for the delivery of luminal fillers[J]. J Control Release, 2011, 156(1): 2-10.
[7] Takagi T, Kimura Y, Shibata S, et al. Sustained bFGF-release tubes for peripheral nerve regeneration: comparison with autograft[J]. Plast Reconstr Surg, 2012, 130(4): 866-876.
[8] 向杰, 黄继锋, 李德忠, 等. 新型仿生人工神经导管诱导犬周围神经损伤再生过程的组织学观察[J]. 中国组织工程研究, 2012, 16(21): 3801-3805.
[9] Cuevas P, Carceller F, Dujovny M, et al. Peripheral nerve regeneration by bone marrow stromal cells[J]. Neurol Res, 2002, 24(7): 634-638.
[10] Friedenstein A. Precursor cells of mechanocytes[J]. Int Rev Cytol, 1976, 47: 327-359.
[11] Stock UA, Vacanti JP. Tissue engineering: current state and prospects[J]. Annu Rev Med, 2001, 52: 443-451.
[12] Wang Y, Zhao Z, Ren Z, et al. Recellularized nerve allografts with differentiated mesenchymal stem cells promote peripheral nerve regeneration[J]. Neurosci Lett, 2012, 514(1):96-101.
[13] Cuevas P, Carceller F, Garcia-Gomez I, et al. Bone marrow stromal cell implantation for peripheral nerve repair[J]. Neurol Res, 2004, 26(2): 230-232.
[14] Kehoe S, Zhang XF, Boyd D. FDA approved guidance conduits and wraps for peripheral nerve injury: a review of materials and efficacy[J]. Injury, 2012, 43(5): 553-572.
[15] de Ruiter GC, Malessy MJ, Yaszemski MJ, et al. Designing ideal conduits for peripheral nerve repair[J/OL]. Neurosurg Focus, 2009, 26(2): E5. doi: 10.3171/FOC.2009.26.2.E5.
[16] 董紅让, 徐永年, 黄继锋. 聚乳酸/神经生长因子缓释导管修复周围神经缺损实验研究[J]. 中国临床解剖学杂志, 2003, 24(3): 409-414.
[17] 黄继锋, 征华勇, 李世普, 等. RGD多肽接枝聚复合导管桥接神经缺损的实验研究[J]. 中华手外科杂志, 2009, 25(3): 154-157.
[18] Kokai LE, Lin YC, Oyster NM, et al. Diffusion of soluble factors through degradable polymer nerve guides: Controlling manufacturing parameters[J]. Acta Biomater, 2009, 5(7): 2540-2550.
[19] 汤锋, 王伟. 组织工程修复周围神经损伤的研究进展[J/ OL]. 中华损伤与修复杂志(电子版), 2009, 4(1): 97-101.
[20] 张文捷, 李兵仓, 王建民, 等. 组织工程人工神经诱导管的制备及其在体外与大鼠体内降解性能研究[J]. 第三军医大学学报, 2004, 26(13): 1165-1168.
