As 2 O 3+ATRA联合VAD方案治疗首诊急性早幼粒细胞白血病的疗效分析
2018-07-26曾昭宇周箭陈果
曾昭宇,周箭,陈果
成都市第三人民医院血液科,成都610031
急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)是急性髓细胞白血病(acute myelogenous leukemia,AML)中发病率较高的一种亚型。APL最重要的特征是产生早幼粒细胞白血病-维甲酸受体α(promyelocytic leukemia-retinoic acid receptor α,PML-RARα)融合蛋白。细胞分裂时t(15;17)(q22;q21)染色体发生易位,基因突变导致造血系统功能紊乱,异常早幼粒细胞产生过多[1]。APL起病急,病程发展快,早期病死率较高[2]。目前APL治疗主要分为诱导缓解期治疗与缓解后治疗两个阶段。三氧化二砷(arsenic trioxide,As2O3)是砒霜的主要成分,其药理作用是针对PML-RARα融合蛋白的特异靶向活性,进入造血器官后靶向降解PML-RARα融合蛋白,诱导肿瘤细胞发生凋亡或分化,可以明显缓解小细胞肺癌患者的临床症状[3]。全反式维甲酸(all-trans retinoic acid,ATRA)在抗APL中可以直接与异常PML-RARα基因结合,通过抑制PML-RARα基因的转录与表达,使肿瘤细胞正常分化,趋于成熟[4]。ATRA可以诱导、分化APL细胞,完全缓解(complete response,CR)率为90%~94%,As2O3联合ATRA治疗初发APL的患者,效果较好,可以缩短达到CR的时间[5]。长春新碱+多柔比星+地塞米松(vincristime+adriamycin+dexamethasone,VAD)方案是临床上常用的化疗方案,在应用于白血病治疗时,具有缓解率高、起效快等优势[6]。本研究对As2O3+ATRA联合VAD化疗方案与As2O3+ATRA方案的疗效和安全性进行了分析,为其进一步推广应用提供依据,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2014年2—8月于成都市第三人民医院诊治的96例APL患者的临床资料,根据治疗方法不同分为观察组(As2O3+ATRA联合VAD化疗方案)和对照组(As2O3+ATRA方案),每组48例。纳入标准:①首诊病例,符合白血病诊断分型中的AML-M3型[7],临床表现主要包括发热、黏膜苍白、出血、淋巴结肿大及胸骨压痛等;②实验室检查中,血常规检查显示三系(红细胞、白细胞、血小板)减少或者白细胞明显增多,外周血检查显示幼稚细胞增多,骨髓象检查显示早幼粒细胞比例≥20%;③基因检测,PML-RARα融合基因及其变异型阳性。排除标准:①复发病例;②接受治疗后1周内死亡的患者;③合并有严重肝肾功能不全的患者;④未系统治疗的患者。观察组48例患者中,男26例,女22例;年龄为29~44岁,平均为(31.95±9.15)岁。对照组48例患者中,男25例,女23例;年龄为30~46岁,平均为(32.07±12.09)岁。两组患者的性别、年龄、白细胞水平、活化部分凝血酶时间(activated partial thromboplastin time,APTT)及骨髓象早幼粒细胞比例等临床特征比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。
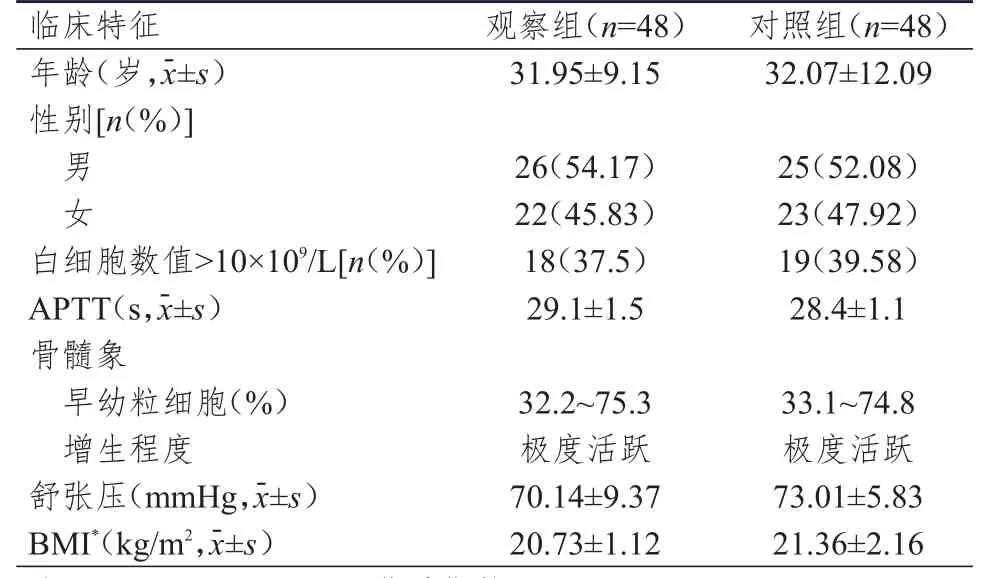
表1 两组患者的临床特征
1.2 治疗方法
1.2.1 诱导缓解治疗初诊确诊后,对照组患者给予As2O30.16 mg(/kg·d)静脉滴注(每天1次,每次4 h)结合ATRA 25 mg(/m2·d)口服(每天3次)。观察组患者在对照组的基础上交替应用VAD方案化疗:第 1~4天,长春新碱(vincristime,VCR)0.5 mg加入250 ml 5%葡萄糖注射液中静脉滴注,每天1次;第1~4天,多柔比星(adriamycin,ADM)10 mg加入250 ml 0.9%氯化钠注射液中静脉滴注,每天1次;第 1~4天、第 9~12天、第 17~20天,地塞米松(dexamethasone,DXM)40 mg口服,28天为1个治疗周期。两组患者的治疗时间为28~35天,直至实验室检查结果达到CR标准。治疗过程中,定期复查血常规和肝功能等;白细胞数值>10×109/L的患者加用羟基脲1~3 g,口服(不适用者换小剂量阿糖胞苷静脉滴注),降低白细胞水平;白细胞水平过高的患者加用糖皮质类激素,防止发生诱导分化综合征。
1.2.2 缓解后巩固治疗两组患者经过诱导缓解达到CR后,对照组患者继续As2O3+ATRA治疗,第1年每月1次,第2年每2个月1次,第3年每3个月1次。观察组患者在对照组的基础上交替应用VAD方案化疗,28 d为1个治疗周期,第1、2、3年的治疗周期需依次间隔1、2、3个月。
1.2.3 支持治疗治疗期间,所有患者根据复查结果给予对症支持治疗。肝功能异常时给予护肝治疗;血红蛋白<60 g/L时输注浓缩红细胞,血小板<20×109/L时输注血小板,凝血功能异常时输注新鲜血浆及小剂量肝素,个别患者视具体情况治疗;发热患者查找病原学依据,选用敏感抗生素进行抗感染治疗;同时治疗期间根据患者情况给予补液、止吐等对症治疗。
1.3 评价指标及标准
比较两组患者的早期病死率、诱导治疗阶段CR率、获得CR的时间、凝血指标恢复正常的时间、不良反应的发生率。采用RT-PCR检测PML-RARα是否转阴并计算转阴率。随访至2017年8月,巩固化疗后随访3年,计算总生存率和复发率。
临床疗效的判定参考张之南和沈悌的第3版《血液病诊断及疗效标准》[8]。CR判断标准:外周血白细胞分类中无白血病细胞,血常规显示血红蛋白、白细胞和血小板均在正常范围内,骨髓象原粒+早幼粒细胞的比例<5%,红细胞系和巨核细胞系正常。早期死亡的诊断标准:患者接受治疗后20天内死亡。白细胞水平升高的诊断标准:在诊疗过程中血常规显示白细胞数值>10×109/L。复发的诊断标准:骨髓象原粒+早幼粒细胞的比例为5%~20%,治疗1个周期后未达到CR标准,骨髓外白血病细胞浸润;不良反应包括消化道反应、感染、肝肾功能不全、头痛、水肿和皮疹等。
1.4 统计学方法
采用SPSS 16.0统计软件分析数据。正态分布的计量资料以均数±标准差(±s)表示,采用t检验;非正态分布的计量资料采用秩和检验。计数资料以率(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 疗效比较
观察组患者早期病死率为6.25%(2例死于弥散性血管内凝血,1例死于颅内出血),与对照组的8.33%(2例死于维甲酸综合征,1例死于弥散性血管内凝血,1例死于颅内出血)比较,差异无统计学意义(t=0.154,P=0.695)。观察组患者的CR率为89.58%(43/48),与对照组的87.50%(42/48)比较,差异无统计学意义(t=0.103,P=0.740);观察组患者达到CR的平均时间为(22.8±5.8)d,明显短于对照组的(32.9±8.4)d,差异有统计学意义(χ2=6.464,P<0.01)。
2.2 实验室指标比较
观察组患者的凝血指标恢复正常的平均时间为(8.1±0.8)d,明显短于对照组的(14.2±1.9)d,差异有统计学意义(t=20.500,P<0.01);观察组患者PML-RARα转阴率为81.25%(39/48),高于对照组的70.83%(34/48),差异有统计学意义(χ2=4.172,P<0.05)。
2.3 不良反应发生率比较
两组患者的消化道反应、感染、肝肾功能不全、头痛、水肿、皮疹的发生率比较,差异均无统计学意义(P>0.05)。(表2)
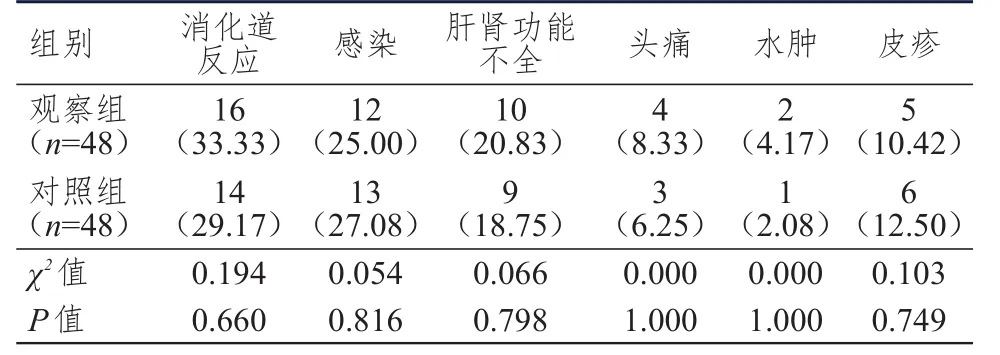
表2 两组患者的不良反应发生率比较[ n(%)]
2.4 预后比较
除去早期死亡病例后,观察组患者45例,对照组患者44例。观察组患者的总生存率为86.67%,高于对照组的68.18%;而复发率为13.33%,低于对照组31.82%,差异均有统计学意义(P<0.05)。(表3)
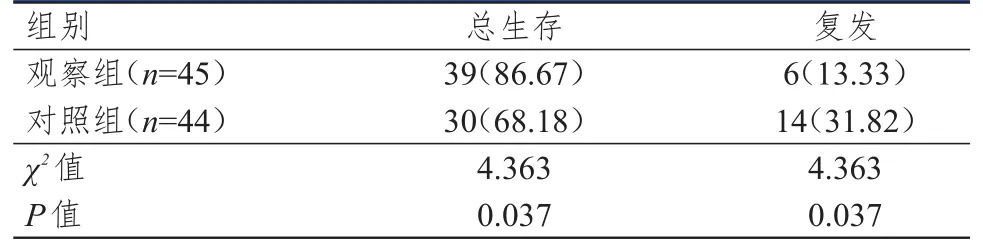
表3 两组患者预后比较[ n(%)]
3 讨论
作为特殊类型的白血病,APL是目前临床上最常见、发病率最高并倾向于年轻化的血液类恶性肿瘤[9]。有研究显示,APL的发病率占急性髓细胞白血病的5%~10%,在APL发病过程中t(15;17)(q22;q21)染色体易位产生的PML-RARα融合蛋白及异常的早幼粒细胞聚集在骨髓和其他造血器官中,其中PML-RARα融合蛋白可以阻止造血祖细胞分化,干扰正常的造血功能,使APL患者出现特有的并发症如弥漫性血管内凝血和诱导分化综合征等,这些并发症发病迅速,致死性强,导致患者早期病死率极高[10]。中国成人APL患者的发病率逐渐增加,疾病本身的急性危害严重威胁患者的健康[11-12],所以对APL患者进行及时、有效的治疗非常重要。随着ATRA和As2O3作为PML-RARα融合蛋白靶向药的应用,APL患者的CR率和治愈率极大地提高,已经成为白血病中疗效最好的亚型,被称为“最可治愈的髓细胞白血病”[4,13]。ATRA是维生素A的代谢中间产物,在脊椎动物等的生长发育过程中可以调节细胞分化及胚胎形态形成。ATRA作用于肿瘤细胞时,表现出双向药理调节作用,一方面可以诱导肿瘤细胞发生分化、凋亡;另一方面,可以促进免疫细胞增殖,增强免疫细胞的抗肿瘤效应[14]。20世纪80年代,中国学者首先提出将ATRA应用于APL的临床治疗,并取得成功[15]。As2O3是砒霜的主要成分,在经历了3次发展高潮后,已被美国食品和药品监督管理局(FDA)批准用于治疗APL[16],其作用主要包括诱导白血病细胞分化、凋亡、自噬及抑制血管新生等[17-18],并且As2O3作用于APL细胞,具有剂量依赖的双重效应,即As2O3高浓度(0.5~2.0 μmol/L)时诱导APL细胞凋亡,而 As2O3低浓度(0.1~0.5 μmol/L)时诱导APL细胞分化[19]。尽管As2O3在适宜的治疗剂量下是相对安全的,但是也存在一定的不良反应(如肝肾功能异常、心脏毒性、骨髓抑制等)以及PML-RARA等基因突变引起的As2O3抵抗[20-21]。虽然单药治疗有一定的效果,但是单用ATRA易发生维A酸综合征、高白细胞血症等不良反应,且短期内容易复发;有研究发现,As2O3与ATRA在抗APL联用时,表现出明显的协同效应,这种联合用药在双诱导治疗APL时可以使患者更快地达到CR[22],这可能与ATRA逆转As2O3耐药性,对白血病细胞进行协同促分化的作用有关[23]。有研究显示,在化疗、ATRA治疗的基础上,联合使用As2O3可以明显增强ATRA对白血病细胞分化的诱导效果[24],联合作用有助于增加患者的疾病缓解率,增加生存率,减少复发率,对成人APL患者的疾病治疗具有重要的价值[25]。
本研究观察组患者在As2O3+ATRA治疗的基础上联合VAD方案化疗,CR率高于对照组,但差异无统计学意义(P>0.05),而观察组达到CR的平均时间为(22.8±5.8)d,短于对照组的(32.9±8.4)d;PML-RARα转阴率为81.25%,高于对照组的70.83%;凝血指标恢复正常的时间为(8.1±0.8)d,短于对照组的(14.2±1.9)d,差异均有统计学意义(P<0.05);并且观察组患者的早期病死率及不良反应发生率与对照组比较,差异均无统计学意义(P>0.05)。此外,观察组患者的总生存率为86.67%,比起对照组的68.18%,提高了1.27倍,而观察组患者的复发率为13.33%,低于对照组的31.82%。这表明,联合方案的主要优势在于可以更加快速地使APL患者达到CR,改善预后。
综上所述,As2O3+ATRA联合VAD化疗方案用于首诊APL患者的疗效较好,安全性高,可以缩短达到CR的时间,改善预后。
