广泛期小细胞肺癌胸部放疗患者循环肿瘤细胞临床价值的探索性研究△
2018-07-26张烨惠周光张文冯林张开泰邓垒王文卿周宗玫王绿化
张烨,惠周光,张文,冯林,张开泰,邓垒,王文卿,周宗玫,王绿化#
国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院1放疗科,2特需医疗部,3免疫学研究室,4分子肿瘤学国家重点实验室,北京100021
肺癌是目前病死率最高的常见恶性肿瘤,其中小细胞肺癌(small cell lung cancer,SCLC)的恶性程度高,占所有肺癌的10%~15%[1]。Govindan等[2]报道,广泛期SCLC占SCLC的60%~70%,患者的中位生存期仅为12个月左右。化疗是广泛期SCLC患者的首选治疗方案,多个研究提示化疗有效后行胸部放疗可以明显改善预后[3-5],但该方案仅对部分患者有效[6]。而传统的影像技术,如计算机断层扫描(CT)、磁共振成像(MRI)难以早期判断放化疗的疗效以及提示预后。因此,发现早期预测放化疗后疗效的分子标志物,指导广泛期SCLC的个体化治疗,是目前临床亟待解决的问题。循环肿瘤细胞(circulating tumor cell,CTC)是指在患者循环系统中存活并且能够被检测到的肿瘤细胞[7]。自1869年CTC在肿瘤患者中被首次发现以来,已有研究显示CTC可以预测肿瘤患者的疗效并提示预后[8]。然而,CTC在SCLC中的研究主要集中在化疗前后的CTC数目与SCLC的疗效及化疗敏感性的关联性上[9-18]。有关CTC在化疗有效患者接受胸部放疗后疗效预测和预后评价中的作用尚未有报道。而且,既往报道中采用检测CTC的CellSearch技术仅能检测上皮样细胞黏附分子(epithelial cell adhesion molecule,EpCAM)阳性的CTC,对于EpCAM阴性的CTC无法检测。本研究组前期采用具有自主知识产权的oHSV1-hTERT-GFP技术检测CTC,该技术具有灵敏度高、操作简单、可分离观察CTC形态等优点。因此,本研究拟采用该技术检测化疗后有效的广泛期SCLC患者接受胸部放疗前后的CTC数目,初步探讨CTC与胸部放疗后患者预后的关系。
1 对象与方法
1.1 研究对象
选取2014年11月至2015年7月在中国医学科学院北京协和医学院肿瘤医院接受胸部放疗的广泛期SCLC患者。纳入标准:①经病理学检查确诊为SCLC;②经颈胸腹CT、脑MRI、骨扫描等全面检查,根据美国退伍军人医院的SCLC分期为广泛期;③KPS评分>70分,年龄>18岁;④初治SCLC患者,行全身化疗方案评价有效;⑤愿意接受胸部放疗;⑥对本研究知情同意并签署知情同意书。排除标准:①继发或转移SCLC患者;②合并第二原发肿瘤者;③胸部放疗未实施或者治疗未完成;④随访资料不完整。
1.2 治疗方案以及疗效评价
所有患者均接受4个周期以上的全身化疗,化疗方案为以顺铂为基础的一线方案,化疗中予以止吐、水化等对症支持处理。每2个周期化疗后,均对患者进行化疗疗效评价,包括颈胸腹CT和脑MRI。根据RECIST 1.1标准进行疗效评价,有效定义为完全缓解(CR)和部分缓解(PR)。疾病进展定义为患者出现局部区域或者远处进展、死亡或者失访。所有治疗有效的患者均接受胸部放疗,放疗靶区大体肿瘤体积包括残留的肺部原发病灶以及残留的纵隔和锁骨上肿大淋巴结。临床肿瘤体积(clinical tumor volume,CTV)为原发病灶外放8 mm,以及化疗前受累的纵隔和锁骨上淋巴引流区,CTV外放5 mm为计划靶区体积(planning target volume,PTV)。处方剂量为95%PTV 60 Gy,每次2 Gy,共30次,或45 Gy,每次3 Gy,共15次。所有放疗计划均采用调强放射治疗技术。胸部放疗后休息1个月评价有效的患者在排除脑转移后予以脑预防照射,照射靶区为全脑,处方剂量为25 Gy,每次2.5 Gy,共10次,照射技术为二维两野对穿照射。所有患者治疗结束后均定期随访,第1~2年每3个月复查1次,第3~5年每6个月复查1次,随访日期截至2018年1月,随访内容包括颈胸腹CT和脑MRI。生化检验结果显示碱性磷酸酶升高,或全身有明显的疼痛、固定压痛点时,行骨扫描检查。总生存时间(overall survival,OS)定义为从病理诊断开始日期到患者死亡、失访日期或者末次随访日期。
1.3 CTC检测
所有入组患者在胸部放疗前、后共2个时间点,分别抽取空腹静脉血4 ml至EDTA抗凝采血管(购自美国BD公司)中,并于标本离体后1 h内转移至实验室用于CTC检测。重要实验步骤如下[19-20]:①抗凝血经红细胞裂解液(购自美国Qiagen公司)裂解红细胞,分离有核细胞;2 ml RPMI 1640培养基(购自美国HyClone公司)重悬有核细胞,移入6孔板并标记,每孔加入1 ml单细胞悬液(4 ml血约含有1×107个有核细胞)。取出oHSV1-hTERT-GFP病毒,将病毒加入上述加有细胞悬液的6孔板中(按照MOI=1比例感染细胞)。将6孔板放入37℃、5%CO2条件下的孵箱内孵育1 h后取出,每孔补加1 ml含有10%胎牛血清的完全培养基,继续放置在原孵箱内进行孵育。转染病毒20~24 h后收集细胞(病毒pfu约为1.3×108,因此每孔加入病毒50 μl)。②收集细胞,并用CD45单克隆抗体(HI30)-PECy5(购自美国BD公司)标记白细胞,阴选血液中的CTC:向上述细胞中加入400 μl磷酸盐缓冲液(phosphate buffer saline,PBS),100 μl CD45抗体(100 μl反应体系中20 μl CD45抗体与 1×106个细胞充分反应,每支离心管中约5×106个细胞),室温下避光孵育30 min。孵育30 min后每支离心管中加入2 ml PBS洗涤,500×g离心5 min后弃掉PBS。③Guava系列流式细胞仪(购自美国Millipore公司)检测CTC:将上述的单细胞悬液加入到96孔板中,每孔200 μl,细胞流式仪检测结束后记录并分析整理数据(CD45-/GFP+的细胞定义为CTC)。
1.4 统计学分析
采用SPSS 21.0统计软件对数据进行分析。计数资料以率(%)表示。采用多因素线性回归分析CTC数目与临床特征的关系。生存曲线采用Kaplan-Meier法绘制,两组生存时间的比较采用Logrank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征及治疗情况
本研究共入组16例一线化疗有效的广泛期SCLC患者,其中1例患者胸部放疗后出院失访,最终15例患者纳入分析。15例广泛期SCLC患者的年龄为42~68岁,中位年龄59岁;吸烟数量0~120包/年,中位吸烟数量30包/年;化疗周期4~8个,中位化疗周期6个;其他临床特征和治疗情况详见表1。
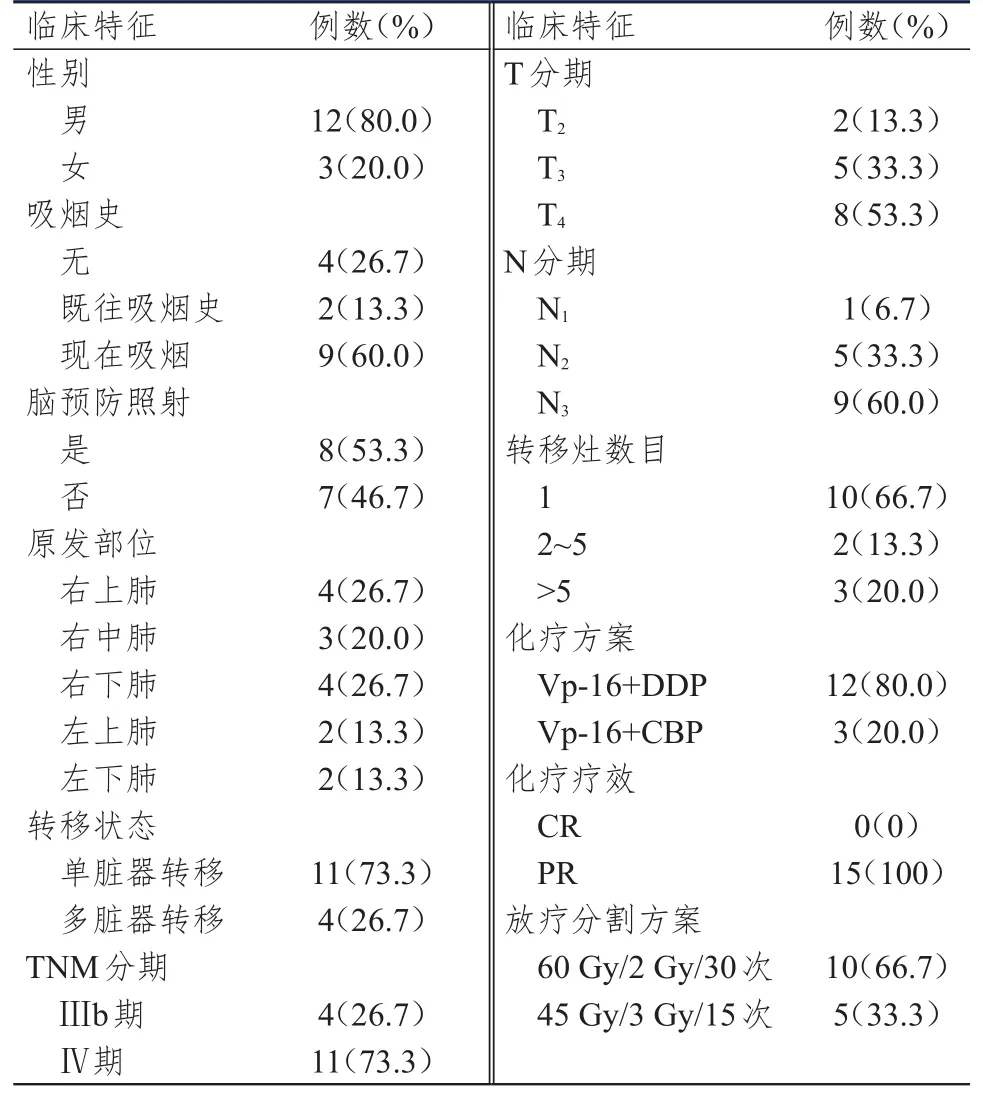
表1 15例广泛期SCLC患者的临床特征和治疗情况
2.2 预后
至随访结束,共对患者进行了6.0~42.2个月的随访,中位随访时间35.5个月,其中生存患者的随访时间为34.5~42.2个月,中位随访时间39.4个月。共9例患者治疗失败,随访过程中出现远处转移。15例SCLC患者的OS为6.0~42.2个月,中位OS为35.5个月;无疾病进展生存时间(progression-free survival,PFS)为4.6~42.2个月,中位PFS为29.8个月。
2.3 胸部放疗前后CTC的数目
15例广泛期SCLC患者均检测到CTC,CTC检出率为100%。胸部放疗前基线水平的CTC中位数目为27/4 ml[(6~50)/4 ml];胸部放疗后的CTC中位数目为11/4 ml[(1~23)/4 ml]。多因素线性回归分析显示:胸部放疗前CTC数目与广泛期SCLC患者的年龄、性别、吸烟、TNM分期、是否单脏器转移及转移病灶数目均无关(P>0.05)。
2.4 胸部放疗前CTC数目与广泛期SCLC患者PFS和OS的关系
以胸部放疗前基线水平的CTC中位数目27/4 ml为界,将全组患者分为CTC≥27/4 ml组(高基线组)和CTC<27/4 ml组(低基线组)。高基线组患者共8例,其中6例患者复发。低基线组患者共7例,其中3例患者复发。高基线组的中位PFS为9.5个月,低基线组的中位PFS时间未达到,但两组患者的中位PFS比较,差异无统计学意义(χ2=1.64,P=0.20)。高基线组4例患者死亡,低基线组2例患者死亡。高基线组的中位OS为14.2个月,低基线组的中位OS未达到,但两组患者的中位OS比较,差异无统计学意义(χ2=1.45,P=0.22)。散点图提示随着胸部放疗前CTC数目的增加,无疾病进展生存及总生存时间逐渐缩短。(图1~图4)
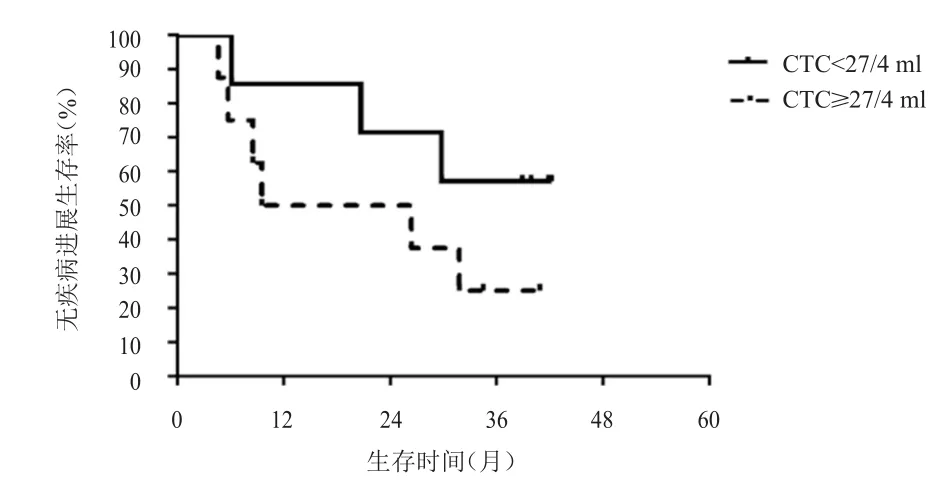
图1 胸部放疗前不同基线CTC数目患者的PFS
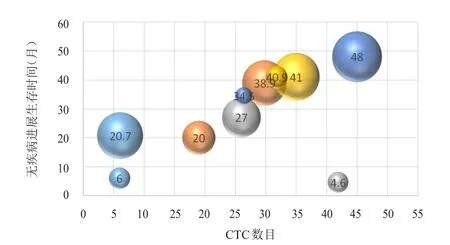
图2 胸部放疗前CTC数目与PFS的散点图
2.5 胸部放疗后CTC数目与广泛期SCLC患者PFS和OS的关系
以胸部放疗后的CTC中位数目11/4 ml为界,将全组患者分为CTC≥11/4 ml组(高疗后组)和CTC<11/4 ml组(低疗后组)。高疗后组患者共6例,全部复发。其中5例患者胸部放疗前CTC数目超过27/4 ml,另1例患者胸部放疗前CTC数目为6/4 ml,胸部放疗后上升至17/4 ml,该患者很快出现复发。低疗后组患者共9例,3例患者复发,6例患者未复发。未复发患者中,2例患者胸部放疗前CTC数目超过27/4 ml,胸部放疗后下降至(2~3)/ml。3例复发患者中,1例患者胸部放疗前CTC数目超过27/4 ml,3例患者的复发时间均较晚。高疗后组的中位PFS为6.1个月,低疗后组的中位PFS未达到,两组患者的中位PFS比较,差异有统计学意义(χ2=11.25,P<0.01)。高疗后组死亡5例,低疗后组死亡1例。高疗后组的中位OS为12.2个月,低疗后组的中位OS未达到,两组患者的中位OS比较,差异有统计学意义(χ2=8.85,P<0.01)。散点图提示随着胸部放疗后CTC数目的增加,无疾病进展生存以及总生存时间逐渐缩短。(图5~图8)
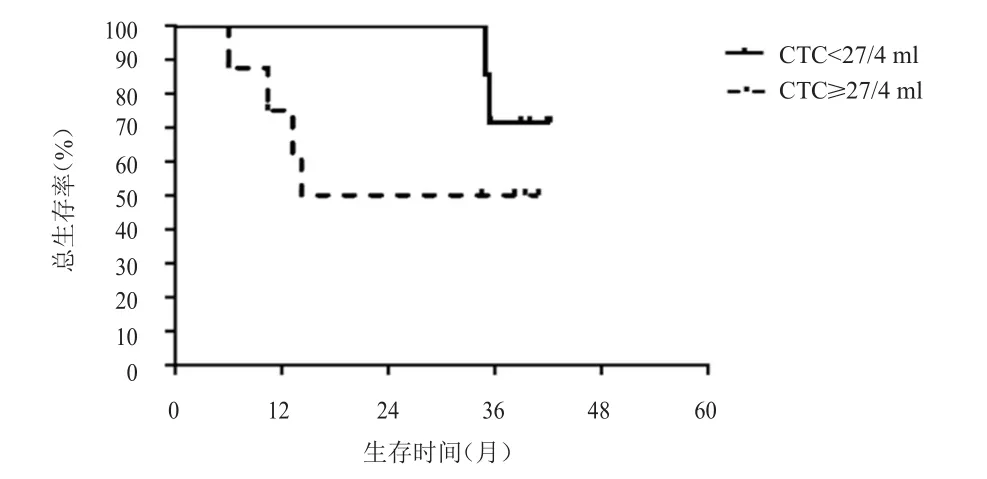
图3 胸部放疗前不同基线CTC数目患者的OS
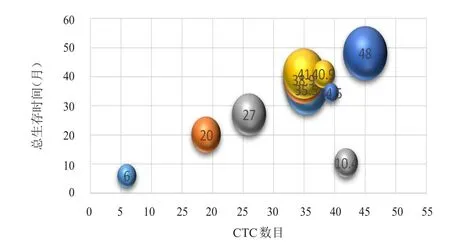
图4 胸部放疗前CTC数目与OS的散点图
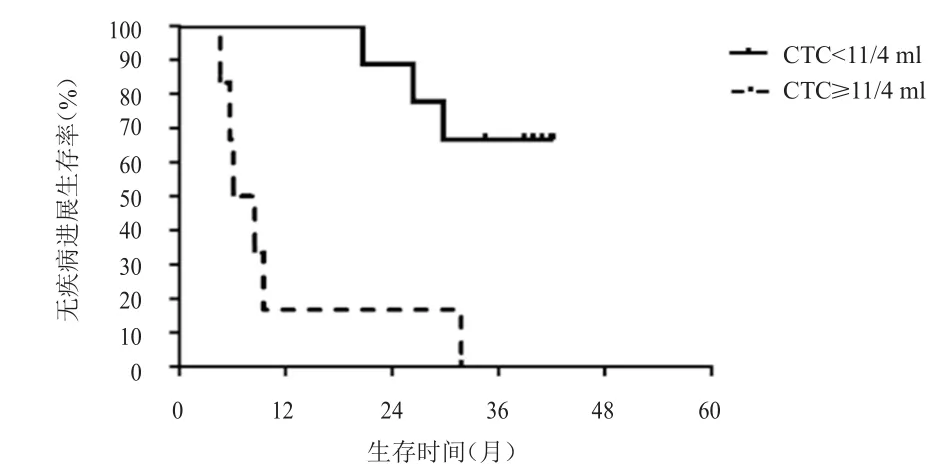
图5 胸部放疗后不同CTC数目患者的PFS
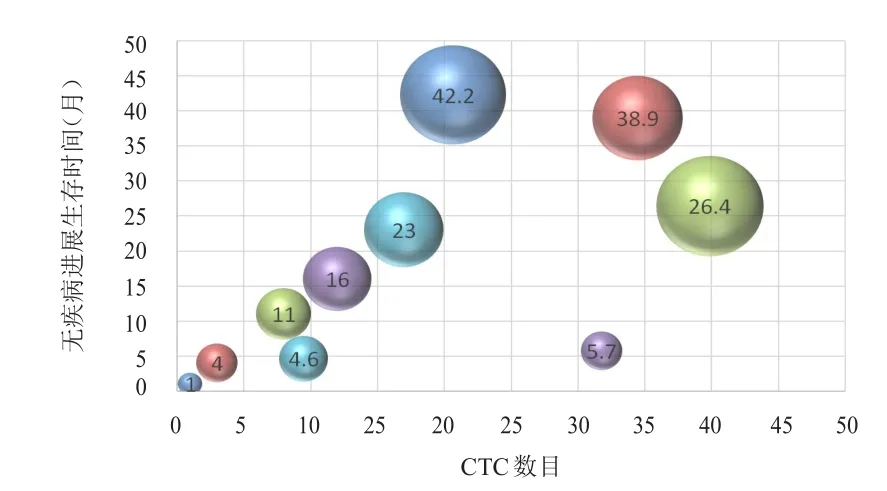
图6 胸部放疗后CTC数目与PFS的散点图
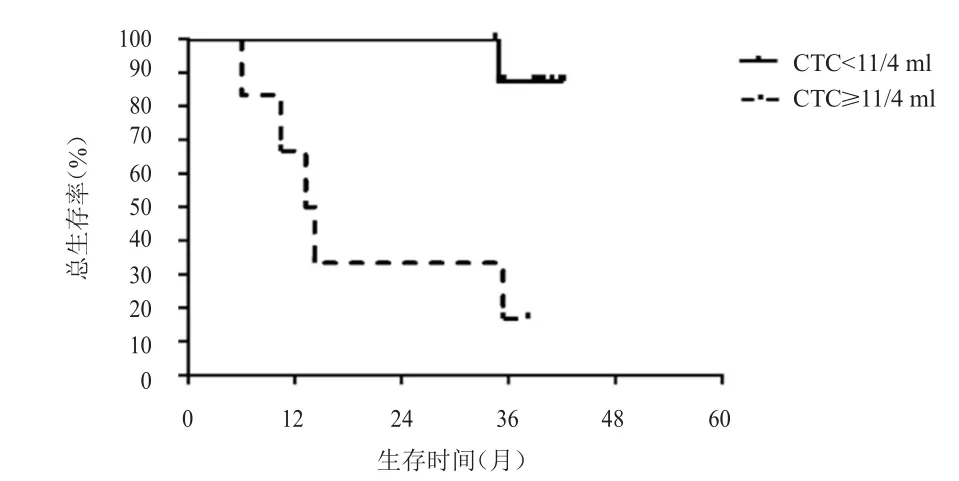
图7 胸部放疗后不同CTC数目患者的OS
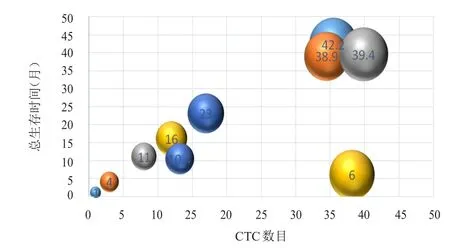
图8 胸部放疗后CTC数目与OS的散点图
3 讨论
本研究首次报道了胸部放疗前后CTC与广泛期SCLC化疗有效患者的疗效预测和预后关系。初步研究结果显示,接受胸部放疗的一线化疗有效的广泛期SCLC患者,放疗后的CTC数目与其胸部放疗的疗效以及预后明显有关。低疗后组患者治疗失败的例数远小于高疗后组,而且低疗后组患者的PFS和OS均明显长于高疗后组(P<0.01)。胸部放疗前低基线组患者复发和死亡的例数也均低于高基线组,但差异均无统计学意义(P>0.05)。
端粒酶在人体正常细胞中的活性往往被抑制,而在90%以上的肿瘤细胞中处于活化状态[21],肿瘤细胞中端粒酶的转录水平较高。本研究检测方法的建立便以此为基础,构建了插入人端粒酶活性催化单位(human telomerase reverse transcriptase,hTERT)启动子和绿色荧光蛋白(green fluorescent protein,GFP)表达的单纯疱疹病毒(herpes simplex virus,HSV),将HSV病毒的复制关键基因ICP4的启动子替换为hTERT启动子,并在下游连接GFP表达盒。HSV病毒在感染肿瘤细胞后,在hTERT高表达的细胞内环境中激活hTERT启动子下游的GFP表达,从而使肿瘤细胞能够自发绿色荧光,随后即可通过流式细胞仪直接对CTC进行计数。该技术已用于多种恶性肿瘤的CTC检测[19]。与Cell-Search技术相比,该技术对肺癌CTC的检出率较高(33.3%vs 71.2%,P<0.01),而且检出率不受肺癌病理类型和分期的影响[22]。本研究利用该技术对广泛期SCLC患者CTC的检出率为100%,高于Cell-Search技术的89.5%~100%[9,11-12,14,16-18],以及RT-PCR技术的84.4%~96.4%[10,15],也再次证实本技术的高敏感度。近期,有研究报道采用类似的腺病毒技术(OBP-401)用于检测CTC,检出率为96%,然而该技术有明显的缺陷,仅能检测具有一定大小的GFP阳性表达的CTC[13]。
本研究发现,胸部放疗前基线水平CTC数目≥27/4 ml组的患者中位PFS为9.5个月,中位OS为14.2个月,而且随着CTC数目增加,疾病控制越差,同时患者的生存情况也越差。既往多个研究均提示,对于SCLC患者,一线化疗前的基线CTC数目与肿瘤的复发和生存相关[9-11,13,15-18]。Aggarwal等[9]采用CellSearch技术检测50例SCLC患者的CTC数目,其中广泛期SCLC患者30例,研究发现基线CTC数目<50个患者的中位PFS明显长于CTC≥50个患者(10个月 vs 4.8个月,P<0.01),而且两组患者的OS比较,差异也有统计学意义(20.2个月 vs 11.8个月,P<0.05)。同样的,Cheng等[11]报道了89例广泛期SCLC患者,治疗前CTC数目<10个患者与CTC数目≥10个患者的OS比较,差异有统计学意义(16.6个月 vs 8.2个月,P<0.01),但两组患者的PFS比较,差异无统计学意义(P>0.05)。另外,有2个研究报道采用RT-PCR技术分别检测叶酸受体阳性和CK-19 mRNA阳性CTC也得到类似的结果[10,15]。其中Shen等[10]利用RT-PCR检测叶酸受体阳性CTC技术检测80例SCLC患者,其中广泛期SCLC患者77例,结果发现一线化疗前基线低水平CTC患者的中位PFS长于基线高水平CTC患者(9.1个月vs 6.9个月,P<0.05)。与本研究采用类似病毒技术的Huang等[12]对25例广泛期SCLC患者进行研究,发现基线CTC数目≥5个患者的OS短于CTC数目<5个的患者(358 d vs 223 d),但受样本量的限制,两组患者的OS比较,差异无统计学意义(P>0.05)。本研究也得到同样的结果,基线水平的CTC可能提示广泛期SCLC患者的复发和生存。对于大部分基线水平CTC数目较高的患者,行胸部放疗后很快出现全身进展,这些患者是否需要加强全身治疗而非行胸部放疗,值得进一步的研究。
本研究中胸部放疗后CTC数目≥11/4 ml的患者PFS和OS均明显短于CTC数目<11/4 ml的患者(P<0.01),而且CTC数目越多,复发的风险越大,出现复发的时间越短。既往也有多个研究证实,对于SCLC患者,采用CellSearch和RT-PCR技术检测一线化疗后的CTC数目与肿瘤的复发和生存有关[9,11,15,17-18]。Aggarwal等[9]利用 CellSearch 检测技术对CTC进行检测,结果发现第2个周期化疗第1天CTC数目<5个患者的中位PFS远高于CTC数目≥5个的患者(10个月 vs 3.17个月,P<0.01),两组患者的OS比较,差异有统计学意义(18个月vs 9个月,P<0.01)。同样的,Cheng等[11]报道中,第2个周期化疗后的CTC数目<10个提示预后良好,CTC数目≥10个和<10个两组患者的中位PFS和中位OS比较,差异均有统计学意义(5.6个月 vs 3.1个月,P<0.01;12.7个月vs 6.9个月,P<0.01)。Shi等[15]采用RT-PCR技术检测CK-19 mRNA阳性CTC时也发现,1个周期化疗后和3个周期化疗后能检测到CTC的患者,其PFS和OS均短于无法检测到CTC的患者(P=0.008和P=0.002;P=0.003和P=0.001)。与本研究采用类似病毒技术的研究也发现,2个周期化疗后PR的患者,CTC数目<2个提示良好的PFS(8.3个月 vs 3.8个月,P=0.07),受病例数限制,两组患者的PFS比较,差异无统计学意义[12]。以上研究均进一步证实胸部放疗后CTC数目可提示广泛期SCLC的复发和生存。胸部放疗后CTC数目高的患者,包括胸部放疗前CTC数目低但胸部放疗后CTC数目升高的患者,均很快出现远处转移,对于该类患者,需要加强全身治疗才可能改善疗效。但也需要注意胸部放疗前CTC数目高,而经胸部放疗后迅速下降的患者,预后和疾病控制好,值得进一步验证。
本研究还存在一定的不足:①全组研究病例数少,尽管广泛期SCLC一线化疗后有效率高,但化疗后接受胸部放疗的患者相对少,入组偏慢。②本研究中纳入的广泛期SCLC患者的中位PFS和中位OS要明显长于既往的研究报道,可能与本研究中纳入的患者高选择性有关,如胸部放疗前的肿瘤负荷小,单脏器转移多以及转移数目相对较少,而且均是化疗后转移病灶消失、胸部病灶明显缩小的患者。③本研究未在患者随访阶段监测CTC数目,无法详细反映肿瘤的负荷动态变化与CTC数目的关系。
综上所述,本研究初步结果发现,对于一线化疗有效的广泛期SCLC患者,胸部放疗后的CTC数目可以预测患者的复发以及生存,但需要进一步扩大样本量进行验证。
利益冲突和作者贡献声明
本研究所有作者均无潜在利益冲突。张烨负责研究设计、病例收集、数据分析和论文写作;惠周光负责数据分析和论文写作;张文、冯林、张开泰负责循环肿瘤细胞的检测;邓垒、王文卿、周宗玫负责病例收集、标本质控和数据分析;王绿化负责研究设计、数据分析和论文写作。
