外源水杨酸对盐胁迫下小桐子幼苗脯氨酸代谢的影响
2018-07-19孔春燕杨利云杨双龙
杨 婷,孔春燕,杨利云,龚 明,杨双龙
(云南师范大学 生命科学学院,生物能源持续开发利用教育部工程研究中心,云南省生物质能与环境生物技术重点实验室,昆明 650500)
小桐子(JatrophacurcasL.),又名麻疯树、桐油树、假花生树等, 为大戟科麻风树属植物,广泛分布于世界热带和亚热带地区,在中国主要分布在云南、四川、贵州等地[1-2]。小桐子种仁的含油量可达40%~60%,是一种生产生物柴油的理想绿色能源植物,并且小桐子具有很高的经济价值,它的种子、树皮、叶片、根可入药; 小桐子也是绿化荒山、保持水土的良好树种[3]。
一般认为小桐子具有较强的抗旱性和抗盐性[4-5],但实际调查表明,干旱、半干旱和盐碱地区并不适宜小桐子的生产,在这类地区种植小桐子即使能存活和生长,其产量也较低[6]。Silva等[7]研究表明,高于100 mmol·L-1的NaCl将显著影响小桐子幼苗的生长;盐胁迫会降低小桐子的种子产量,以及幼苗叶面积、相对生长速率、光合效率、叶片水势、相对含水量和叶绿素含量,提高其甜菜碱、脯氨酸、丙二醛、可溶性糖的含量及改变抗氧化酶的活性[6-8]。因此,盐胁迫是影响小桐子分布和产量的主要因素之一。
大量研究表明,盐胁迫会打破植物体内的渗透调节,抑制水分的吸收,造成生理干旱,并且降低其生物量[9]。为了适应盐胁迫诱发的脱水伤害,植物会产生相应的渗透调节物质(如脯氨酸、甜菜碱和可溶性糖等)以适应逆境胁迫[10]。在众多渗透调节物质中,脯氨酸被认为是分布最广泛的渗透保护物质。干旱、高温和低温等胁迫下大量积累的脯氨酸可有效提高植物对逆境胁迫的耐受性[10-11]。目前, 植物体内脯氨酸的代谢途径已基本清楚, 对影响植物体脯氨酸含量的因素也有了较清晰的认识。一般认为, 脯氨酸有两条合成途径——谷氨酸 (glutanate, Glu) 途径和鸟氨酸(ornithine, Orn)途径, Δ1-吡咯琳-5-羧酸合成酶 (Δ1-pyrroline-5-carboxylate synthetase, P5CS) 是谷氨酸合成途径的关键酶, 而调节鸟氨酸途径的核心关键酶是鸟氨酸转氨酶 (ornithine-δ-aminotransferase, OAT)[11-12]。脯氨酸的降解则由脯氨酸脱氢酶(proline dehydrogenase, ProDH)控制, 它将脯氨酸降解为P5C[11]。已有研究表明, 盐胁迫可诱发植物体内脯氨酸的大量积累, 且脯氨酸的积累与植物的耐盐性相关[10-13]。虽然脯氨酸积累在植物适应盐胁迫中的作用已得到证实,但是盐胁迫诱发脯氨酸积累的机制尚不完全清楚。
盐胁迫诱发植物脯氨酸积累的过程涉及复杂的信号转导事件,已有证据表明Ca2+、NO、脱落酸 (abscisic acid, ABA)、水杨酸 (salicylic acid,SA) 等信号分子参与了该过程的调控[11,13-15]。SA是植物体内产生的小分子酚类化合物,是重要的内源信号分子,在低温、干旱、盐胁迫过程中对提高植物的抗逆性起着重要作用[16-18]。已有研究表明:SA能促进低温胁迫下苹果树中脯氨酸的积累,从而提高了其抗冷性[19];Nazar 等[20]报道,SA提高了芥菜中脯氨酸的含量,显著缓解了干旱引发的氧化胁迫;Misra等[14]的研究表明,外源SA处理增强了盐胁迫下扁豆植株中脯氨酸的积累,降低了盐胁迫造成的蛋白质损伤。
然而,SA调控盐胁迫下植物脯氨酸积累的机制还不清楚。因此,本试验采用外源SA处理盐胁迫下的小桐子幼苗, 研究了SA对盐胁迫下小桐子幼苗脯氨酸含量以及脯氨酸代谢关键酶活性和相关基因表达的影响, 拟初步阐明盐胁迫下SA调控小桐子脯氨酸积累的机理。此外,我们在试验中也研究了SA对盐胁迫下小桐子幼苗叶片组织活力、电解质渗漏率和MDA含量的影响,希望这些工作能为下一步阐明小桐子的耐盐性机理提供借鉴。
1 材料和方法
1.1 试验材料及培养
供试小桐子种子采购于云南省元谋县。首先用1.5%的硫酸铜溶液对小桐子种子进行消毒,消毒30 min后用蒸馏水反复洗净,再于25 ℃下浸种24 h,然后播种在铺有6层湿润滤纸的白瓷盘中,在培养箱中暗培养7 d(温度 25 ℃,湿度75%)。将萌发一致的种子转栽在铺有石英砂的白瓷盘中生长,此时用1/2 Hogland营养液浇灌,人工气候箱的培养条件为25 ℃/20 ℃ (昼/夜)、16 h (光照强度300 μmol·m-2·s-1)、相对湿度75%。砂培生长14 d后开始试验处理。
1.2 处理及取样
首先,取上述培养的长势一致的小桐子幼苗,置于分别添加不同浓度(0、0.3、0.6、0.9、1.2、1.5、2.0 mmol·L-1)SA和200 mmol·L-1NaCl(中度盐胁迫)的1/2 Hogland营养液中,在25 ℃/20 ℃ (昼/夜)、16 h光照 (光照强度300 μmol·m-2·s-1)、相对湿度75%的人工气候箱中培养,对照于1/2 Hogland营养液中于相同环境下同期培养,每个处理270株。材料处理4 d后,取长势一致的小桐子幼苗叶片为材料测定相关指标。此外,SA和NaCl处理浓度的选择主要是基于我们前期的研究结果,以及国外相关文献的报道[13-14, 17, 21-23]。
其次,在以上试验的基础上,取上述培养的长势一致的小桐子幼苗,分别置于含适宜浓度SA(0.9 mmol·L-1)+ 200 mmol·L-1NaCl的1/2 Hogland营养液及200 mmol·L-1NaCl的1/2 Hogland营养液中,在25 ℃/20 ℃ (昼/夜)、16 h光照 (光照强度300 μmol·m-2·s-1)、相对湿度75%的人工气候箱中培养,对照于1/2 Hogland营养液中相应环境下同期培养,每个处理270株。材料共处理4 d,期间在处理的0、1、2、3、4 d分别取长势一致的小桐子幼苗叶片为材料测定相关指标。
1.3 测定指标及方法
1.3.1叶片组织活力、电解质渗漏率和丙二醛(MDA)含量叶片组织活力的测定参照Yang等[24]的TTC 法进行。准确称取0.2 g 小桐子幼苗真叶叶片,在黑暗、30 ℃条件下,将其充分浸泡于0.6%(W/V)TTC 溶液(TTC 溶液用pH 7.0 的磷酸缓冲液配制)中染色24 h。用去离子水将染色后的叶片冲洗干净并用滤纸吸干,直接将叶片浸泡在5 mL 95%乙醇中,并于85 ℃水浴条件下放置20 min,待提取液冷却后于485 nm 下测定吸光度值。叶片电解质渗漏率检测参照Yang等[24]的相对电导率法;膜脂过氧化产物MDA 含量的测定按照Li等[25]的硫代巴比妥酸法进行,单位表示为μg/g。
1.3.2脯氨酸含量及其代谢关键酶活性取长势一致的小桐子幼苗叶片为材料,脯氨酸含量的测定参照Bates等[26]的酸性茚三酮法;OAT和ProDH活性的测定参照Sanchez等[27]的方法,以单位时间内NADPH氧化量来表示OAT的活性,以单位时间内NADP+消耗量来表示ProDH的活性;P5CS活性的测定参照我们实验室Yang等[28]的方法进行,以单位时间内每mg酶蛋白氧化NADPH的量表示P5CS的活性;参照Bradford[29]的方法来测定蛋白质的含量, 标准样品选用牛血清蛋白。
1.3.3RNA提取和RT-qPCR用RNAiso for Polysaccharide-rich Plant Tissue试剂盒(TaKaRa公司)提取小桐子叶片总RNA。采用ABI 7500 Fast Real-Time PCR实时荧光定量PCR仪对小桐子脯氨酸代谢关键酶基因JcP5CS、JcProDH、JcOAT进行表达检测,以小桐子Actin基因为内参(引物序列见表1)。RT-qPCR的操作按照One StepSYBR®PrimeScriptTMRT-PCR Kit Ⅱ试剂盒(TaKaRa公司)说明书进行。采用2-ΔΔCT法对目标基因进行相对定量的差异表达分析[30]。
1.4 数据处理
用SPSS 22.0对实验数据进行统计及显著性分析,用Sigmaplot 10.0对统计结果作图, 图中的数据均为平均值±标准误。
2 结果与分析
2.1 外源SA对盐胁迫下小桐子幼苗脯氨酸含量的影响
图1,A显示,在200 mmol·L-1NaCl胁迫处理4 d时,随着SA浓度的升高,小桐子幼苗脯氨酸含量呈现出先升高后降低的变化趋势,并在SA浓度为0.9 mmol·L-1时达到最大值,此时比未经过SA处理(0 mmol·L-1)的幼苗极显著上升了22.3% (P<0.01);当SA浓度超过0.9 mmol·L-1时,小桐子幼苗叶片脯氨酸含量呈缓慢下降的趋势,但各浓度处理仍显著高于未经过SA处理组(P<0.05)。因此,在后续的实验中选择0.9 mmol·L-1SA处理小桐子幼苗,研究外源SA对盐胁迫下小桐子幼苗脯氨酸积累和相关指标的影响 。

表1 实验中用到的引物
进一步从图1,B可知,随着处理时间的延长,小桐子幼苗脯氨酸含量在对照中保持稳定,在NaCl和NaCl+SA处理中均表现出逐渐增加的趋势;期间,NaCl和NaCl+SA处理脯氨酸含量始终极显著高于对照,NaCl+SA处理又始终高于NaCl处理,且差异大多达到显著或者极显著水平。其中, 200 mmol·L-1NaCl胁迫4 d时,NaCl和NaCl+SA处理小桐子幼苗脯氨酸含量分别比对照极显著上升了274.9%和355.0% (P<0.01)。以上结果说明盐胁迫诱发了小桐子幼苗脯氨酸的大量积累,适宜浓度的外源SA能进一步显著提高盐胁迫下小桐子幼苗的脯氨酸含量。
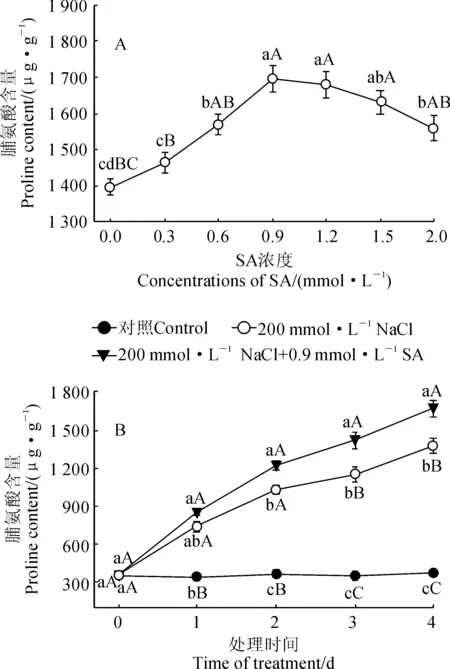
A.200 mmol·L-1NaCl胁迫下不同浓度SA处理4 d;B.200 mmol·L-1NaCl+0.9 mmol·L-1 SA处理;不同小写和大写字母分别表示同期处理间在0.05和0.01水平存在显著性差异;下同图1 外源SA对盐胁迫下小桐子幼苗脯氨酸含量的影响A. The treatments with different concentrations of SA and 200 mmol·L-1NaCl for 4 d;B.200 mmol·L-1NaCl+0.9 mmol·L-1 SA;Different normal and capital letters indicate significant difference among treatments at 0.05 and 0.01 levels, respectively; The same as belowFig.1 Effect of exogenous SA on proline content of J. curcas seedlings under salt stress
2.2 外源SA对盐胁迫下小桐子幼苗脯氨酸代谢关键酶活性的影响
P5CS和OAT分别是脯氨酸合成的谷氨酸途径和鸟氨酸途径的关键酶[10,12]。图2,A、B结果显示,随着处理时间的延长,小桐子幼苗叶片P5CS和OAT活性在NaCl和NaCl+SA处理中均呈现逐渐增加的趋势,而在对照中基本保持稳定,这与其脯氨酸含量的变化趋势完全一致;在整个处理过程中,NaCl和NaCl+SA处理叶片P5CS和OAT活性始终显著或者极显著高于对照组,NaCl+SA处理又始终显著高于NaCl处理。其中,与正常培养的对照幼苗相比,在处理4 d后,NaCl和NaCl+SA处理小桐子幼苗P5CS的活性分别极显著提高了93.8%和114.9%,它们的OAT活性则分别极显著提高了332.4%和404.3% (P<0.01)。可见,200 mmol·L-1NaCl处理能提高小桐子幼苗的P5CS和OAT活性,外源0.9 mmol·L-1SA则能进一步显著上调盐胁迫下小桐子幼苗P5CS和OAT的活性。
同时,脯氨酸的积累主要是通过加强合成和减弱降解来实现,所以脯氨酸含量不仅与两条主要合成途径的关键酶活性相关,也与控制降解的酶ProDH有很重要的关系[10-11]。由图2,C可知,小桐子幼苗ProDH活性在NaCl和NaCl+SA处理下均呈现不断快速下降的趋势,而在对照中基本保持稳定;与对照幼苗相比, NaCl和NaCl+SA处理小桐子幼苗ProDH活性在处理期间均显著降低,两者在处理4 d时降幅分别为32.1%和44.2%(P<0.01)。以上结果说明200 mmol·L-1NaCl胁迫能显著抑制小桐子幼苗的ProDH活性,而外源0.9 mmol·L-1SA处理可进一步显著下调盐胁迫下小桐子幼苗的ProDH活性,阻止脯氨酸的降解。
2.3 外源SA对盐胁迫下小桐子幼苗脯氨酸代谢关键酶基因表达的影响
由图3,A、B可知,200 mmol·L-1NaCl胁迫可大幅度上调小桐子幼苗脯氨酸代谢关键酶基因JcP5CS和JcOAT的表达水平,外源0.9 mmol·L-1SA处理可进一步上调盐胁迫下JcP5CS和JcOAT的表达水平。其中,在处理4 d时,小桐子幼苗JcP5CS和JcOAT的表达水平在NaCl处理下分别比正常培养对照上调了18.1和36.5倍 (P<0.01),在NaCl+SA处理下比NaCl处理分别上调了29.1%和37.2% (P<0.01)。表明盐胁迫下小桐子幼苗的JcP5CS和JcOAT基因表达明显受到外源SA调控。

图2 外源SA对盐胁迫下小桐子幼苗脯氨酸代谢关键酶活性的影响Fig.2 Effect of exogenous SA on activities of the key enzymes of proline metabolism in J. curcas seedlings under salt stress
同时,图3,C显示,在单独200 mmol·L-1NaCl胁迫下,小桐子幼苗JcProDH基因表达水平随着处理时间呈逐渐下调的趋势,且与同期对照比差异均达到极显著水平,其表达水平在盐胁迫处理4 d时比对照幼苗极显著下调了80.3% (P<0.01);同时,外源0.9 mmol·L-1SA处理的盐胁迫小桐子幼苗JcProDH基因表达水平随着处理时间也呈逐渐下调的趋势(P<0.01),且比单独盐胁迫处理进一步显著下调,其在处理4 d时比同期单独盐胁迫处理下降了34.9%。这表明盐胁迫下小桐子JcProDH基因表达同样受到外源SA的抑制。

图3 外源SA对盐胁迫下小桐子幼苗脯氨酸代谢关键酶基因表达的影响Fig.3 Effect of exogenous SA on the expression of the key genes of proline metabolism in J. curcas seedlings under salt stress
2.4 外源SA对盐胁迫下小桐子幼苗叶片组织活力、电解质渗漏率和MDA含量的影响
由图4,A可知,随着处理时间的延长,小桐子幼苗叶片的组织活力在NaCl和NaCl+SA处理下均呈逐渐下降的趋势,并均始终极显著低于同期对照,但NaCl+SA处理却始终显著高于同期NaCl处理;与对照相比,小桐子幼苗的组织活力在NaCl和NaCl+SA处理4 d时分别极显著下降43.2%和35.9%(P<0.01)。

图4 外源SA对盐胁迫下小桐子幼苗叶片组织活力、电解质渗漏率和MDA含量的影响Fig.4 Effect of exogenous SA on tissue vitality, electrolyte leakage and MDA content in leaves of J. curcas seedlings under salt stress
与此同时,NaCl和NaCl+SA处理小桐子幼苗叶片的电解质渗漏率 (图4,B)和MDA含量(图4,C)均随着处理时间的延长呈现逐渐上升的趋势,且均始终极显著高于同期对照,但NaCl+SA处理却始终显著低于同期NaCl处理;处理4 d时,NaCl和NaCl+SA处理叶片的电解质渗漏率分别比对照极显著提高314.4%和259.5% ,它们的MDA含量分别极显著提高254.0%和214.6%。可见,200 mmol·L-1NaCl胁迫极大降低了小桐子幼苗叶片组织活力,极显著地提高了幼苗叶片的电解质渗漏率和MDA含量,而外源 0.9 mmol·L-1SA处理则可显著缓解盐胁迫下小桐子幼苗叶片组织活力的降低和电解质渗漏率、MDA含量升高的趋势,说明SA可显著提高小桐子幼苗的耐盐性。
3 讨 论
植物在遭受盐胁迫时,由于外界渗透势较低,植物细胞会发生失水,从而造成生理性缺水,这时植物的渗透调节就发挥着重要的作用[7, 9]。脯氨酸作为一种重要的渗透调节物质,在植物遭受盐胁迫时会大量积累,高浓度的脯氨酸可有效防止水分散失[9-11]。此外,脯氨酸还有清除盐胁迫产生的活性氧、提高抗氧化酶活性、保护生物膜和亚细胞结构等功能[10-11, 31]。虽然,许多研究证实盐胁迫可诱发植物脯氨酸的大量积累[7, 9, 14, 17],然而盐胁迫诱发脯氨积累的机制还不完全清楚。本研究结果表明,200 mmol·L-1NaCl胁迫可诱发小桐子幼苗脯氨酸的大量积累,提高脯氨酸关键合成酶P5CS和OAT的活性,以及上调JcP5CS和JcOAT基因的表达水平,同时盐胁迫也抑制了脯氨酸降解酶ProDH的活性及JcProDH基因的表达水平。
越来越多的证据表明,盐胁迫诱发植物脯氨酸积累的过程涉及复杂的信号转导事件,而Ca2+、H2O2、NO、ABA和SA等信号分子可能参与了该调控过程[11-15, 24]。SA是重要的植物生长调节物质,在植物应对生物和非生物胁迫中发挥着非常重要的作用[16]。近年来已有研究显示,SA可提高盐胁迫下植物体内脯氨酸的含量[14, 19-20], 但不清楚其具体机理。本研究结果表明,外源0.9 mmol·L-1SA显著提高了200 mmol·L-1NaCl胁迫下小桐子幼苗脯氨酸的积累水平,上调了谷氨酸合成途径关键酶P5CS和鸟氨酸途径关键酶OAT的活性,活化了JcP5CS和JcOAT基因的表达水平,以及下调了ProDH活性和JcProDH基因的表达水平。大量研究显示,盐胁迫下脯氨酸的积累主要通过3种不同的途径来实现,即效应细胞的从头合成途径,脯氨酸降解水平的降低,以及脯氨酸特异性转移体系的再分配[10-11, 13]。本研究结果表明,盐胁迫下SA处理活化了小桐子幼苗脯氨酸的从头合成途径,脯氨酸合成的两条途径,即谷氨酸途径和鸟氨酸途径都被SA加强,同时,SA处理还降低了脯氨酸的降解水平。至于SA对盐胁迫下小桐子幼苗脯氨酸转运体系的影响尚待进一步研究。
已有不少研究证实SA可提高植物的耐盐性,Arfan等[21]报道,0.75 mmol·L-1SA可显著提高盐胁迫下小麦的光合效率,增强其耐盐性;Kim等[22]指出,外源SA处理可有效缓解盐胁迫对黄瓜造成的伤害;Farhangi-Abriz等[23]的研究显示,SA通过增强盐胁迫下大豆的抗氧化能力和渗透调节能力改善了其生长状况。本实验结果也显示,0.9 mmol·L-1SA处理可显著提高盐胁迫下小桐子幼苗叶片的组织活力,降低其电解质渗漏率及膜脂过氧化产物MDA的含量,表明SA可有效提高小桐子幼苗的耐盐性。虽然目前SA诱发植物耐盐性提高的机制尚不完全清楚,但基于脯氨酸在植物抗逆性形成中的重要作用,可以推测SA对植物耐盐性的提高过程与其盐胁迫下可诱发脯氨酸的大量积累密切相关。
综上所述,SA涉及盐胁迫诱发小桐子脯氨酸积累的调控过程,且SA诱发的脯氨酸积累是其活化脯氨酸合成的谷氨酸途径和鸟氨酸途径,以及抑制脯氨酸降解途径的综合结果。此外,外源SA处理也提高了小桐子幼苗的耐盐性,且脯氨酸很可能在这种耐盐性提高中发挥着重要作用。
