蝴蝶兰花瓣瞬时转化体系建立
2018-07-19刘雅莉窦雪溪刘红利李方殷
孟 妮,刘雅莉,窦雪溪,刘红利,李方殷
(西北农林科技大学 旱区作物逆境生物学国家重点实验室,农业部西北地区园艺作物生物学与种质创制重点实验室,陕西杨陵712100)
蝴蝶兰(Phalaenopsisaphrodite)是兰科蝴蝶兰属的花卉,因其花色艳丽,形似蝴蝶,花期持久,深受人们喜爱,被誉为“兰花皇后”,具有极高的科研、观赏、生态和经济价值[1]。花器官性状(花色、花香、花型等)改良是蝴蝶兰遗传育种的重要目标,但漫长的生命周期严重限制了蝴蝶兰基因功能研究和分子育种的进展。特别是植物转基因工程中,兰花从体外原球茎再生到成花,检验外源基因对转基因兰花表型、生理等方面的影响至少需要3~4年[2]。即使成功转化,外源基因在受体植株中的不确定性和不稳定性也很难克服。这些都意味着漫长的时间和庞大的人力资源。这就迫切需要建立一套可以快速在蝴蝶兰花器官中进行性状检测和基因功能分析的早期验证系统。
花瓣瞬时转化方法可以代替稳定转化体系,对外源基因的功能和转基因花瓣的预期表型进行早期评估。瞬时表达分析是一种快速研究基因-蛋白质功能的方法。传统的转基因方法中,农杆菌介导的稳定转化必须将T-DNA整合到宿主基因组中。而瞬时表达不需要将外源基因整合到染色体上,宿主细胞核中存在的T-DNA的非整合拷贝也能表达[3],外源基因表达效率高,有时甚至是稳定转化体的1 000倍[4]。因此,针对植物的目标性状,瞬时测定法具有简单、快速、周期短、准确等优点[5]。
本研究选用蝴蝶兰品种‘大辣椒’的花瓣和萼片为试材,采用农杆菌介导的瞬时转化方法,将报告基因β-葡糖醛酸酶基因(GUS)导入蝴蝶兰花瓣,通过组织化学染色法研究适宜蝴蝶兰高效瞬时表达的最佳条件。并进一步在蝴蝶兰花瓣中分析花色基因CHS的功能,验证该体系的可行性。
1 材料和方法
1.1 材 料
蝴蝶兰供试样品为紫红色‘大辣椒’(P.‘Big chili’),所有材料于2017年4月购于陕西省咸阳市杨陵区蝴蝶兰基地。
根癌农杆菌(Agrobacteriumtumefaciens)GV3101菌株、植物表达载体pCAMBIA 0380-35S::GUS以及pKANNIBAL-phCHS干扰载体均为西北农林科技大学旱区作物逆境生物学国家重点实验室保存。
缓冲重悬液,取MS粉4.43 g加入到1 L ddH2O中,121 ℃灭菌25 min备用,使用前加入200 mmol/L的乙酰丁香酮(AS)500 μL,pH 7.0。
花青苷提取液为甲醇∶水∶甲酸∶三氟乙酸按比例70∶27∶2∶1混合而成。
1.2 方 法
1.2.1根癌农杆菌菌液制备将携带35S::GUS的植物表达载体通过液氮冻融法转入根癌农杆菌,挑取根癌农杆菌转化子单菌落,在含50 mg/L卡那霉素、60 mg/L庆大霉素和25 mg/L利福平的液体LB培养基中28 ℃振荡培养过夜。取过夜菌液100 μL,接种于50 mL含对应抗性筛选的LB液体培养基中,28 ℃、180 r/min过夜扩大培养。4 ℃、5 000 r/min离心10 min收集菌体。根癌农杆菌菌液浓度用其菌液在600 nm时的吸光光度值(OD600)表示。用缓冲重悬液将OD600调至0.2、0.6、1.0、2.0备用。
1.2.2花瓣注射和侵染方法取完全开放的花瓣和萼片,用无菌注射器针刺中心部位后使用1 mL无针头的注射器于破口处缓慢注入菌液,而后将造成机械损伤的组织整体置入悬浮液中侵染[6]。将制备的不同浓度农杆菌菌液振荡侵染蝴蝶兰花瓣,侵染时间分别为0、60和180 s,在(25±2)℃黑暗恒温培养箱中共培养3 d后进行染色并统计GUS瞬时表达率。
根据以上研究获得瞬时表达最佳菌液浓度和侵染时间的组合,即菌液浓度OD600为0.6,侵染时间为60 s,在缓冲重悬液中加入乙酰丁香酮(AS)浓度分别为0、50、100、150、200、350 μmol/L, 共培养3 d后检测GUS瞬时表达率。
用OD600为 0.6的根癌农杆菌菌液侵染蝴蝶兰花瓣和萼片60 s后,在共培养过程中添加150 μmol/L AS,黑暗恒温条件下分别共培养0、1、2、3、4、5、6和7 d,对共培养结束的蝴蝶兰花瓣进行染色并统计GUS瞬时表达率。
1.2.3瞬时转化材料的鉴定(1) GUS组织化学染色分析。GUS组织化学染色依据 Jefferson 等[7]的方法进行了改良。将花瓣浸入X-gulc染色液后,1.2 kPa真空抽滤10 min,37 ℃温育过夜,第2天除去染色液,用95%乙醇使植物组织脱色,观测染色结果并统计GUS瞬时表达率,以无菌水处理的花瓣和萼片作为阴性对照。GUS瞬时表达率(%)=(显色花瓣数/检测总花瓣数)×100% 。
(2) 瞬时表达材料的反转录PCR鉴定。设计蝴蝶兰CHS基因检测引物,上游序列为 5′-ATCGGACTCACCTTCCAC-3′,下游序列为 5′-AGCACATTTCTACTCGCG-3′,内参Actin基因上游序列为 5′-GTTCTTTCCCTATATGCTAGTGGC-3′,下游序列为 5′-GAAGGATGGCATGAGGAAG-TG-3′,分别以未转化和转化的蝴蝶兰花瓣为材料提取总RNA[8],逆转录为 cDNA 后以此为模板进行 PCR 扩增,以质粒DNA 为阳性对照、用无菌水侵染的植株花瓣为阴性对照。RT-PCR 扩增采用 20 μL 反应体系:上下游引物各 0. 8 μL,5 U TaqMix 酶 10 μL,模板 DNA 1 μL,超纯水补齐。反应程序为:94 ℃预变性 3 min;94 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸15 s,25 个循环;最后 72 ℃延伸 2 mins,4 ℃保存。PCR 扩增结束后,吸取10 μL PCR 反应产物于 1.5%琼脂糖凝胶中进行电泳,电泳结束后在紫外凝胶成像仪上成像并拍照。
1.2.4花青素苷总量测定取实验后的新鲜花器官,称量,用液氮研磨后加入提取液,根据王琳等[9]的方法制备萃取液。测定花器官中总花青苷含量参考Huang等[10]的方法,分别在 530 和 657 nm 处进行吸收值测定,然后根据公式A530-0.25×A657计算,总花青苷用底物吸收值与鲜重的比值表示。
1.2.5数据处理与分析每个试验重复3次,平均每个处理20个花瓣。共培养结束后取出各组花瓣采用组织化学染色法对其染色,检测GUS瞬时表达情况。采用Excel软件计算平均值和标准差;采用SPSS 17.0软件进行方差分析;利用HemI (Heatmap Illustrator,version 1.0)绘制热图。
2 结果与分析
2.1 蝴蝶兰花瓣中组织化学GUS测定的评分模式
本研究为了更好地评估GUS瞬时转化效率,将携带植物表达载体35S::GUS的农杆菌菌株侵染蝴蝶兰‘大辣椒’的花瓣,农杆菌菌液OD600为0.6、侵染时间60 s,在重悬液中添加200 μmol/L乙酰丁香酮,共培养2 d后,检测GUS基因表达水平 (图1) 。根据组织化学染色结果将其分为4个等级:未染色(-),染色程度浅(+),染色程度中等(++),染色程度强(+++)。
2.2 菌液浓度和侵染时间对GUS瞬时表达的影响
农杆菌菌液浓度在OD600为0.2~2.0的宽泛范围内,侵染时间在0~180 s时,GUS均能表达,但表达量差别明显(图2)。GUS活性随着菌液浓度的提高逐渐增加,在OD600为 0.6时达到峰值,当OD600为2.0时显著降低。当OD600为 0.6,侵染60 s时,GUS表达率最高为57%,而OD600为 0.6,侵染时间为180 s时,GUS表达率为53%,方差检验分析这二者之间差异显著。综合考虑,最佳的组合是侵染液浓度OD600为 0.6,侵染时间为60 s。
2.3 乙酰丁香酮对GUS瞬间表达的影响
根据以上研究获得瞬时表达最佳菌液浓度和侵染时间的组合,即菌液浓度OD600为0.6,侵染时间为60 s,在缓冲重悬液中加入乙酰丁香酮(AS)浓度分别为0、50、100、150、200、350 μmol/L, 共培养3 d后检测GUS瞬时表达率。
结果显示AS的浓度对蝴蝶兰花瓣的GUS 瞬时表达率有显著影响(表1)。在重悬液中不添加AS时,GUS瞬时表达率为0;随着AS浓度不断增加,GUS瞬时表达率呈现先升后降的趋势。当AS浓度为150 μmol/L时,GUS瞬时表达率达到最高,为86.67%。之后GUS瞬时表达率逐渐下降。
对GUS染色的花瓣进行染色程度的统计分析,重悬液中添加的AS浓度不断增高,染色程度中等和染色程度强的花瓣GUS染色率也呈现先升后降的趋势,在AS浓度为150 μmol/L,染色程度中等和染色程度强的花瓣GUS总染色率为55%,而AS浓度为200 μmol/L的染色率仅为48.33%。因此,在蝴蝶兰花瓣瞬时转化中,最适宜的AS浓度为150 μmol/L。
2.4 共培养时间对GUS瞬间表达的影响
用OD600为 0. 6的根癌农杆菌菌液侵染蝴蝶兰花瓣和萼片60 s后,在共培养过程中添加150 μmol/LAS,黑暗恒温条件下分别共培养0、1、2、3、4、5、6和7 d。从表2可以看出共培养时间从0~7 d不断延长时,GUS瞬时表达率呈现出先升高后降低的趋势。共培养时间为3 d时达到最高值,为85.01%。之后GUS瞬时表达率不断下降,当共培养时间为6 d时,GUS瞬时表达率仅为8.33%。说明共培养时间对GUS瞬时表达率有较大的影响。
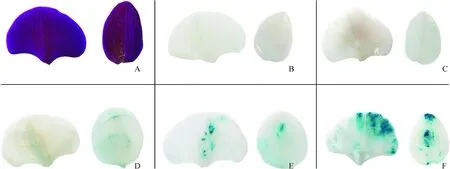
A.新鲜花瓣;B.空白对照;C.-(未染色);D.+(染色程度浅);E.++(染色程度中等);F.+++(染色程度强)图1 蝴蝶兰花瓣中组织化学GUS测定的评分模式A.Fresh petals;B. Blank control;C. -(unstained); D.+ (staining is shallow); E. ++(staining moderate); F.+++(staining the strongest)Fig.1 Pattern of scoring for the histochemical GUS assay in Phalaenopsis aphrodite petals
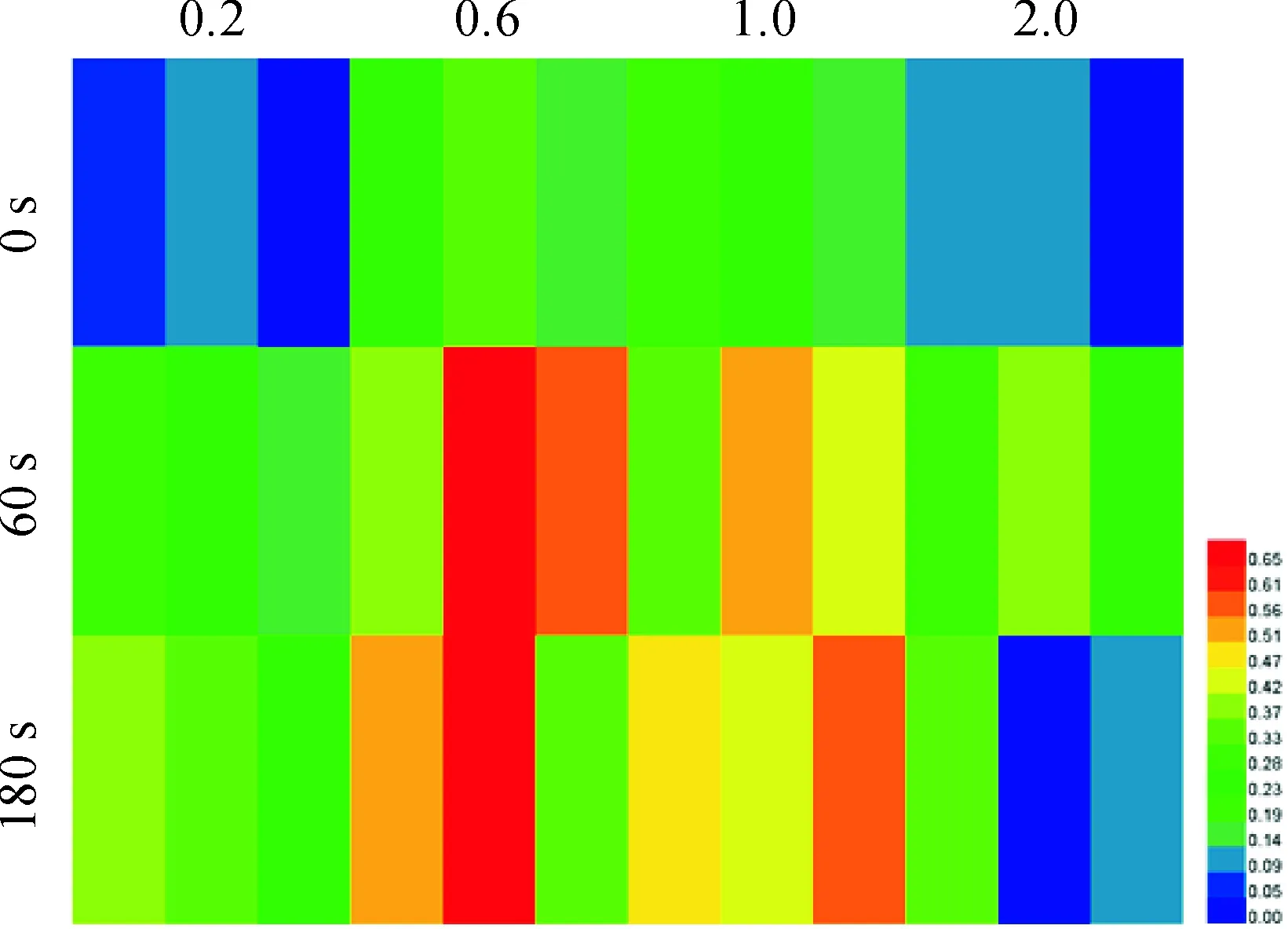
Y轴代表不同的侵染时间0、60、180 s;X轴代表菌液在600 nm时的吸光度值(OD),分别为0.2、0.6、1.0、2.0图2 菌液浓度和侵染时间对GUS瞬时表达的影响The Y-axis represents the infection time, which were 0,60 and 180 seconds;The X-axis represents the absorbance value of the broth at 600 nm, which were 0.2,0.6,1.0 and 2.0Fig.2 Effect of bacterial concentration and infection time on the expression of GUS in the sepals and petals
观察共培养时间为2和3 d之间的GUS染色程度率,得知共培养3 d时,染色程度中等和染色程度强的百分率均高于共培养2 d时的百分率。因此,在蝴蝶兰花瓣瞬时转化中,共培养时间以3 d为宜。
2.5 花色基因在蝴蝶兰瞬时表达体系中的功能验证
为了验证蝴蝶兰花瓣瞬时表达体系,将CHS基因干扰载体转化蝴蝶兰花瓣。与对照组相比,转基因蝴蝶兰花色明显变淡(图3,A~D)。总花青苷含量测定显示对照组花瓣中总花青苷的含量约为转基因植物的2. 5倍(图3,C)。RT-PCR检测显示,与预期结果一致,携带CHSRNAi的转基因花瓣扩增的目的条带亮度低于对照组(图3,E),说明目的基因CHS在该蝴蝶兰花瓣中的表达被抑制,证明了CHS在蝴蝶兰花青素合成过程中发挥重要作用。该结果进一步证实了该体系可以用于基因功能在蝴蝶兰花器官中的早期验证。
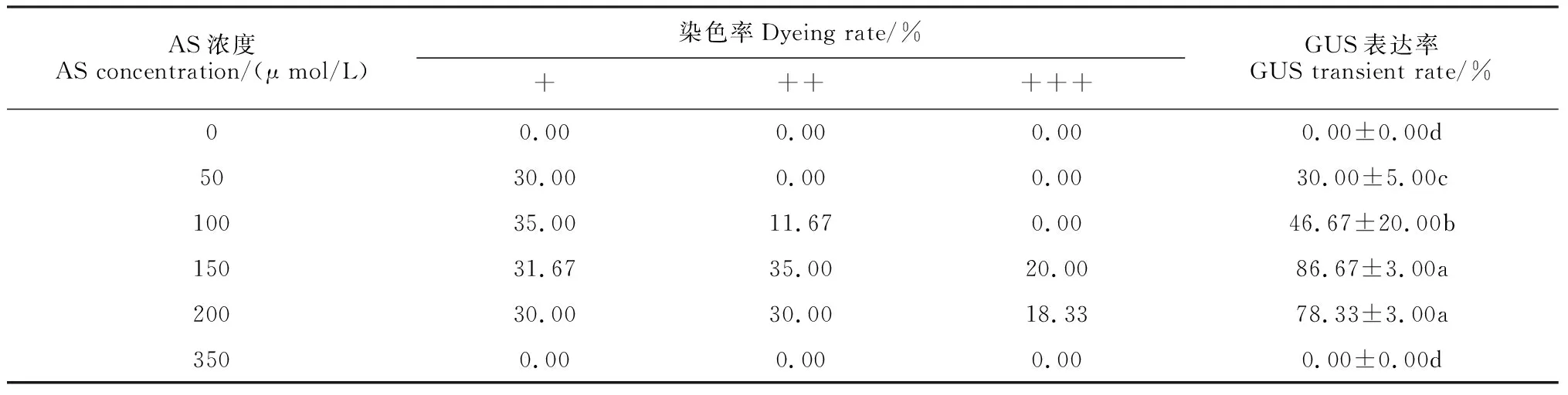
表1 AS对蝴蝶兰花瓣GUS瞬时表达率的影响
注:同列数据后不同小写字母表示在0.05水平上差异显著; +、++和+++分别表示染色程度轻、中等和强的花瓣GUS染色率。下同Note: After each column of data, different normal letters indicate significant difference at 0.05 level. The staining rate +, ++, +++ indicate the staining rate of the petals with a light, medium and strong level of staining, respectively. The same as below
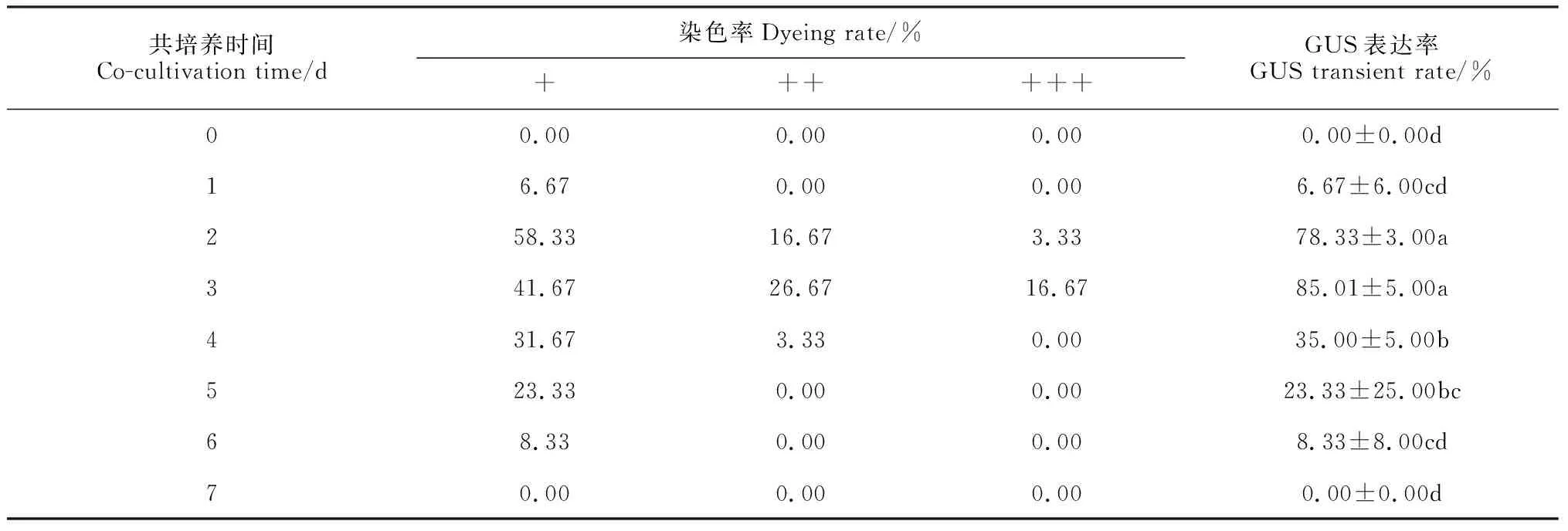
表2 共培养时间对蝴蝶兰花瓣GUS瞬时表达率的影响
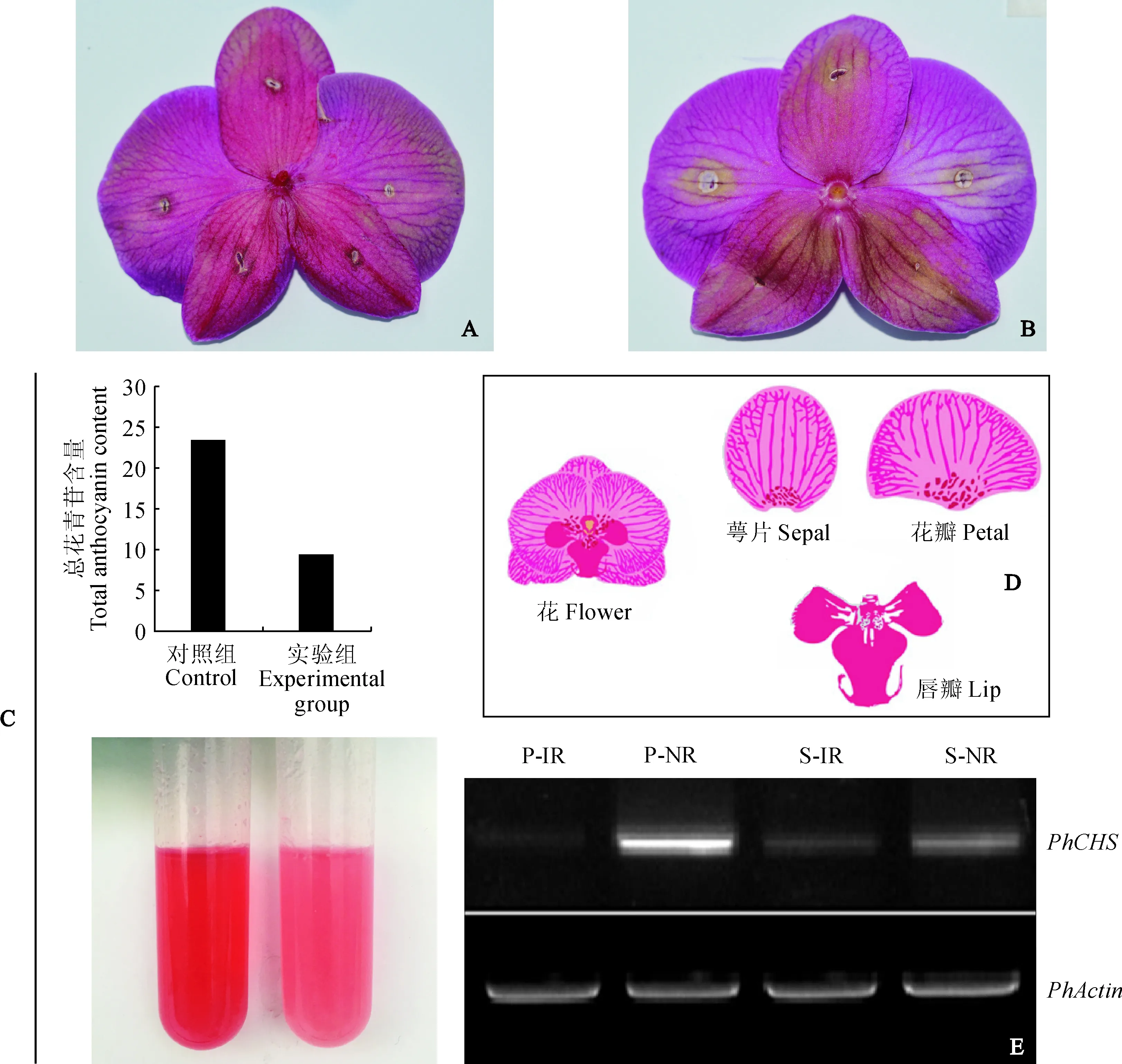
A.无菌水处理的花瓣;B.转化CHS RNAi基因的花瓣;C.总花青苷含量的测定和对应的提取液;D.蝴蝶兰花器官解剖图;E.RT-PCR检测,IR表示侵染区域,NR表示没有侵染的区域,P和S分别代表花瓣和萼片图3 CHS基因在蝴蝶兰瞬时表达体系中的功能验证A. Petal of sterile water treatment;B. Flower petals transforming the CHS RNAi gene;C. Determination of total anthocyanin content and corresponding extract;D. Phalaenopsis aphrodite orchid organ dismantling;E. RT-PCR detection, IR indicate infected area, NR indicate no infected area, P and S represent petal and sepal respectivelyFig.3 Functional verification of the CHS gene in the transient expression system of Phalaenopsis aphrodite
3 讨 论
瞬时表达系统是植物基因功能研究不可或缺的分析工具。农杆菌介导的瞬时转化方法快速、高效,不需要昂贵的设备。迄今为止确定的影响瞬时转化最重要的因素是宿主植物的基因型,农杆菌菌株类型,农杆菌菌液的浓度、侵染时间以及乙酰丁香酮的浓度和共培养天数[11]。
本研究通过对农杆菌菌液浓度和侵染时间进行组合,获得蝴蝶兰花瓣瞬时转化最适宜的侵染液浓度OD600为0. 6,侵染时间为60 s。大量研究表明,农杆菌悬浮液OD600为0. 6~1. 0之间已经普遍用于农杆菌介导的兰花遗传转化中,例如石斛兰(Dendrobiumnobile)[12]、文心兰(Oncidiumhybridum)[13]和蝴蝶兰(Phalaenopsisaphrodite)[14]。Yasmin等[15]报道宽范围OD6000. 5 ~ 4. 0的菌液浓度对月季花瓣的瞬时转化GUS活性没有显著影响,菌液浓度小于0. 5时没有GUS活性。这是由于植物敏感性不同还是宿主植物基因型不同,或是其他方面的原因有待进一步研究。
使用不同的渗透介质[16]、添加乙酰丁香酮[17]和表面活性剂[11]能显著提高外源基因的表达。乙酰丁香酮提高外植体转化效率的原因,是因为Vir区的活动产物能将 T-DNA区从T两侧 25 bp边缘的序列中切割下来,从而促进外源基因的融合。因此,Vir区的活化是农杆菌向植物基因组转移的一个关键步骤,但是不同植物适宜乙酰丁香酮的浓度不同[18]。在文心兰[13]、石斛兰[19]、月季花瓣[15]、烟草叶片[11]遗传转化中使用的AS浓度各不同。本研究结果表明,在重悬液中添加150 μmol/L AS时,最适宜蝴蝶兰的遗传转化。
该实验获得蝴蝶兰花瓣瞬时转化最适宜共培养天数为3 d。将蝴蝶兰遗传转化的共培养时间延长到5~7 d不会增加GUS瞬时活性,但会引起细胞坏死,这与Belarmino等[20]的研究是一致的。
蝴蝶兰花色基因功能验证的研究较少,主要受遗传转化效率低和遗传转化周期长的限制。韩颖颖[21]克隆到3个新的蝴蝶兰CHS基因,初步验证PhCHS5特异地在花瓣和唇瓣中表达,在模式植物烟草中转化PhCHS3的外显子2序列,获得花瓣颜色加深的转基因植株。而未在蝴蝶兰中进一步验证基因的功能。根据前人研究推测,CHS基因位于类黄酮生物合成途径的起始位置,是决定类黄酮合成的分子开关[22]。使用反义抑制、共抑制、RNAi等分子生物学技术手段来下调基因的表达,从而改变花色素代谢途径的方式已广泛应用。在野生型烟草中稳定转化拟南芥CHSRNAi干扰载体后,得到花色变浅的转基因烟草[23]。Aida等将CHS反义基因转化夏堇,获得花色变淡的新品种[24]。Courtney-Gutterson等[25]将菊花CHS基因与CaMV35S启动子正向或反向连接,转化菊花产生白花植株。以上研究从不同的侧面证明,当CHS活性被强烈抑制时,花青素的合成被阻断,花色变浅甚至完全变为白色[26]。本研究利用该体系证实了推测,在花瓣中快速检测了CHS基因功能,和Liu等[27]研究结果相似,失活文心兰的CHS导致花器官不能积累花色素苷。该体系可快速在蝴蝶兰花器官中检测基因功能,为后期定向改良花色提供技术支持。
