动态增强MRI鉴别诊断前列腺中央腺体T2WI低信号病变
2018-07-19熊青青牛翔科高月琴张仕慧成都大学附属医院放射科四川成都610081
熊青青,牛翔科,高月琴,张仕慧,彭 涛(成都大学附属医院放射科,四川 成都 610081)
前列腺癌在老年男性中发病率及死亡率均较高,多发生于前列腺外周带,但亦可发生于前列腺中央腺体[1-2]。发生于中央腺体的前列腺癌需与前列腺良性病变,如前列腺增生结节、慢性炎症、上皮内瘤变及纤维化等相鉴别,上述良性病变在T2WI上同样表现为等或低信号,且可引起扩散受限[2],常规MRI常难以区分。动态增强MRI(dynamic contrast enhanced-MRI, DCE-MRI)可通过定量及半定量指标评价病灶的血流动力学特征,有助于鉴别诊断[3-5]。本研究探讨DCE-MRI定量及半定量参数对前列腺中央腺体内T2WI低信号病灶的鉴别诊断价值。
1 资料与方法
1.1 一般资料 回顾性分析2014年1月—2016年12月在我院接受前列腺常规MRI和DCE-MRI的123例患者资料。入组标准:①临床资料完整;②接受前列腺MR检查前无内分泌、放疗等非手术治疗史及前列腺活检史;③MR检查后接受经直肠超声引导下标本盒标记法穿刺活检术或前列腺根治术,并获得病理结果;④中央腺体存在T2WI低信号结节。排除标准:①图像伪影严重,影响观察;②前列腺中央腺体内无结节病灶,或结节病灶T2WI表现为高信号。最终纳入59例患者,年龄54~89岁,平均(73.2±5.4)岁;其中前列腺癌患者32例(前列腺癌组),前列腺增生伴慢性炎症患者15例(增生伴慢性炎症组),高级别上皮内瘤变(high grade intraepithelial neoplasia, HGPIN)患者12例(HGPIN组);血清前列腺特异性抗原(prostate specific antigen, PSA)水平5.25~2 200.00 μg/L。
1.2 仪器与方法 采用Siemens Avanto 1.5T MR扫描仪,8通道体部相控阵线圈,以耻骨联合上方约2 cm处为中心进行扫描。常规扫描序列包括轴位、冠状位及矢状位TSE T2W,轴位T1W及DWI。DCE-MRI采用梯度回波容积内插体部检查(volume interpolated body examination, Vibe)序列,TR 4.2 ms,TE 1.7 ms,矩阵153×192,FOV 180 mm×180 mm,ETL 18,层厚3 mm,共扫描21层。对比剂采用钆喷酸葡胺注射液(Gd-DTPA),以高压注射器经肘前静脉注入,流率2 ml/s,剂量0.2 mmol/kg体质量,随后以相同流率注射20 ml生理盐水。注射对比剂前先扫1期作为蒙片,注射对比剂同时开始扫描,共扫描35个周期,采集时间共2 min 39 s。
1.3 图像分析 将DCE-MRI图像导入Omni Kinetics血流动力学定量软件,选择髂外动脉层面勾画圆形ROI,获得时间-浓度曲线作为动脉输入函数。结合前列腺根治术后大体标本或穿刺活检结果及T2WI,在动态增强序列图像中定位对应病灶,观察病灶位置、形态及边界,选择强化明显区域作为病灶ROI,面积约为40 mm2,尽量避开外周带与中央腺体交界处、尿道、精囊根部、血管、出血或钙化灶等。应用Extended Tofts Linear双室模型对病灶ROI层面进行血管渗透性定量及半定量分析,生成各参数伪彩图,并获得定量参数容积转运常数(Ktrans)、速率常数(Kep)、血管外细胞外容积分数(Ve)、对比剂血浆容积(Vp)及半定量参数达峰时间(time to peak, TTP)、最大浓度(maximum concentration, Concmax)、最大斜率(Slopemax)及时间-浓度曲线下面积(area under the time-concentration curve, AUTC),每个ROI测量3次,取平均值。
1.4 统计学分析 采用SPSS 17.0统计分析软件。计量资料以±s表示。先行Levene方差齐性检验,如方差齐则以单因素方差分析前列腺癌、增生伴慢性炎症与HGPIN组间DCE-MRI各参数的差异,如方差不齐,则采用近似F检验Welch法,两两比较采用LSD或DunettT3法。采用MedCalc软件绘制ROC曲线,以评价各参数对前列腺癌的诊断效能,以Z检验比较曲线下面积(area under the curve, AUC)的差异。P<0.05为差异有统计学意义。
2 结果
根据手术或穿刺病理结果,共检出55个前列腺癌病灶、54个前列腺增生伴慢性炎症病灶和55个HGPIN病灶。
2.1 MRI表现 中央腺体的前列腺癌病灶T2WI表现为结节状或不规则低信号,边界欠清;DCE-MRI为快进快出,呈高灌注表现(图1);前列腺增生伴慢性炎症病灶T2WI多表现为高低不等的混杂信号,34个结节周围可见低信号假包膜,DCE-MRI多表现为渐进性强化,后期强化程度无明显下降(图2);HGPIN病灶T2WI以低信号为主,DCE-MRI多呈渐进或平台型强化(图3)。
2.2 DCE-MRI参数 前列腺癌组、前列腺增生伴慢性炎症组与HGPIN组间Ktrans、Kep、Ve、Vp、TTP及Slopemax差异均有统计学意义(P均<0.05),两两比较,前列腺癌组与HGPIN组间Ktrans、Kep、Ve、Slopemax及TTP差异有统计学意义(P均<0.05),前列腺癌组与前列腺增生伴慢性炎症组间Vp及TTP差异有统计学意义(P均<0.05),HGPIN组与前列腺增生伴慢性炎症组间Ktrans、Kep、Vp及TTP差异有统计学意义(P均<0.05);3组间Concmax和AUTC总体差异均无统计学意义(P均>0.05),见表1。
2.3 诊断效能 ROC曲线分析显示,以TTP、Ktrans及Kep诊断前列腺癌的AUC较大,分别为0.743、0.735及0.721(P均<0.001);以3.05 min、1.43 ml/min和1.46 ml/min为诊断界值,TTP、Ktrans及Kep诊断前列腺癌的敏感度和特异度分别为72.73%和74.31%、100%和53.21%、61.82%和79.82%。TTP、Ktrans与Kep诊断前列腺癌的ROC曲线AUC两两比较差异均无统计学意义(P均>0.05),但均大于Ve值诊断前列腺癌的AUC(Z=2.414,P=0.016;Z=4.122,P<0.001;Z=2.046,P=0.041),且TTP诊断前列腺癌的AUC大于Vp值的AUC(Z=2.054,P=0.040)。见表2、图4。
表1 前列腺癌组、前列腺增生伴慢性炎症组与HGPIN组DCE-MRI参数比较(±s)
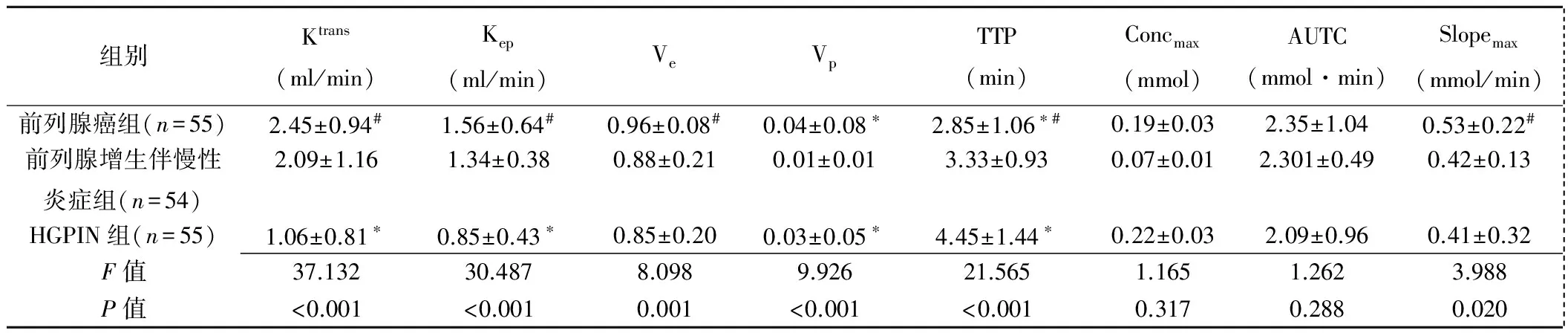
表1 前列腺癌组、前列腺增生伴慢性炎症组与HGPIN组DCE-MRI参数比较(±s)
组别Ktrans(ml/min)Kep(ml/min)VeVpTTP(min)Concmax(mmol)AUTC(mmol·min)Slopemax(mmol/min) 前列腺癌组(n=55)2.45±0.94#1.56±0.64#0.96±0.08#0.04±0.08∗2.85±1.06∗#0.19±0.032.35±1.040.53±0.22# 前列腺增生伴慢性炎症组(n=54)2.09±1.161.34±0.380.88±0.210.01±0.013.33±0.930.07±0.012.301±0.490.42±0.13 HGPIN组(n=55)1.06±0.81∗0.85±0.43∗0.85±0.200.03±0.05∗4.45±1.44∗0.22±0.032.09±0.960.41±0.32 F值37.13230.4878.0989.92621.5651.1651.2623.988 P值<0.001<0.0010.001<0.001<0.0010.3170.2880.020
注:*:与前列腺增生伴慢性炎症组比较P<0.05;#:与HGPIN组比较P<0.05
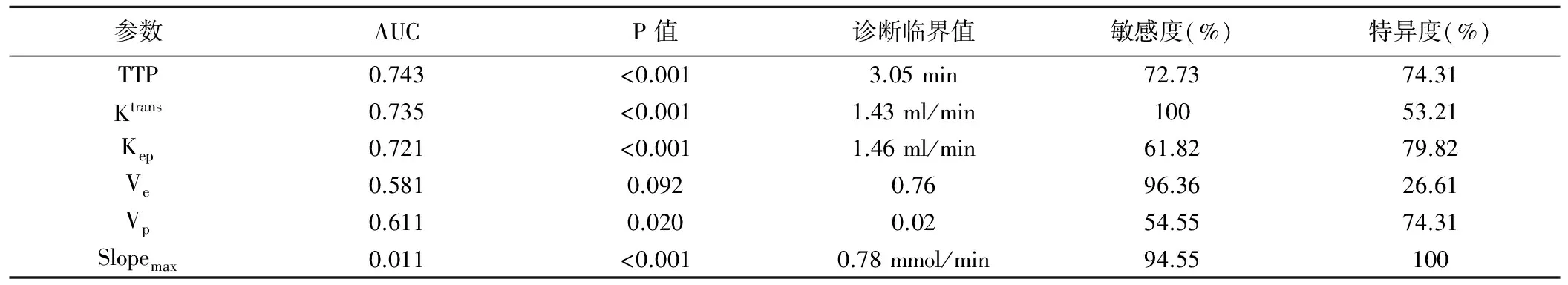
表2 DCE-MRI各参数对前列腺癌的诊断效能

图1 前列腺癌患者,65岁 A.T2WI; B. DCE-MRI(第6期图像); C.Ktrans伪彩图; D.Kep伪彩图
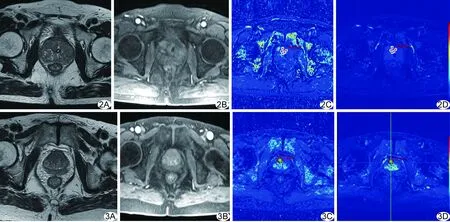
图2 前列腺增生伴慢性炎症患者,70岁 A.T2WI; B.DCE-MRI(第6期图像); C.Ktrans伪彩图; D.Kep伪彩图 图3 HGPIN患者,81岁 A.T2WI; B.DCE-MRI(第6期图像); C.Ktrans伪彩图; D.Kep伪彩图
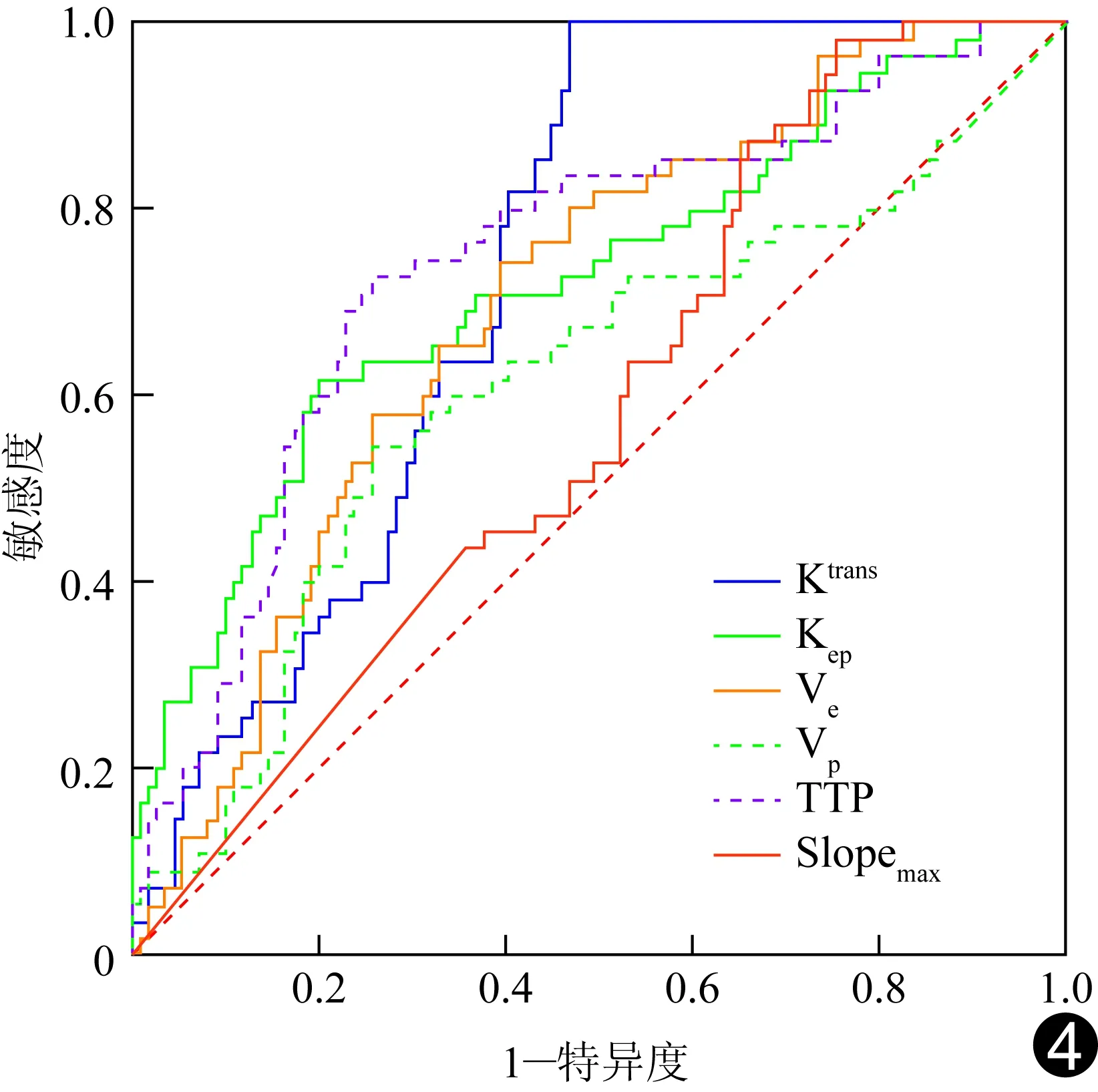
图4 DCE-MRI各参数诊断前列腺癌的ROC曲线
3 讨论
前列腺疾病是老年男性的高发病,检查重点在于筛查前列腺癌。常规MR T2WI诊断前列腺癌的敏感度较高,但特异度较低。基质型前列腺增生、炎症、萎缩纤维化及上皮内瘤变等良性疾病T2WI亦可表现为低信号[2-3],同时大多DWI呈高信号,难以与前列腺癌区别。Boneckamp等[6]指出,前列腺癌的ADC值与部分非癌病变重叠。HGPIN是一种癌前病变,与前列腺癌的分子生物学行为有一定相似之处[7],早期鉴别诊断有助于减少不必要的穿刺,避免不良反应。通过分析对比剂渗漏、回流及在血管内外所占比例,DCE-MRI可精确、重复测量肿瘤微血管生理解剖及功能[8-9]。
以往对前列腺的动态增强的研究[3,10]常采用定性分析,即观察增强曲线的类型,而曲线类型在部分良恶性病变中存在重叠;对影像学资料进行量化分析,更有利于直观、准确地检出恶性病变。本研究结果显示,前列腺癌的TTP明显小于增生伴慢性炎症和HGPIN。TTP主要反映对比剂流入组织的速度,前列腺癌血管密度增加,且新生毛细血管基底膜不连续、管径粗细不均、管壁缺乏肌层和基底膜,导致血管通透性增加,对比剂廓清较快,因此早期强化迅速,TTP缩短;炎性组织血管数目亦可增加,但其血管生成相对成熟,形态及功能无明显变化,对血管壁的通透性及血流阻力影响较小,故早期强化滞后于恶性病变[11]。
Ktrans为单位时间内对比剂从血液进入到组织间隙的容积,其大小取决于血流量、毛细血管渗透性和表面积,Kep为单位时间内对比剂从组织间隙进入血管的容积,二者是反映组织微血管密度和渗漏性的主要指标[2]。前列腺癌组织内含有大量分化不成熟的肿瘤新生血管,管壁通透性较高,因此Ktrans及Kep值较高。本研究中前列腺癌与增生伴慢性炎症患者间Ktrans和Kep值差异无统计学意义(P均>0.05),可能是由于基质型增生结节血供丰富,加之慢性炎症刺激使血管通透性增高,故与前列腺癌组DCE-MRI结果相似。Ve是血管外细胞外容积分数,以往关于Ve值的研究结果分歧较大。景国东等[12]认为前列腺癌与增生的Ve值差异无统计学意义,而本研究结果表明前列腺癌与癌前病变HGPIN间Ve差异有统计学意义(P<0.05),但其对前列腺癌的诊断效能较低,ROC曲线AUC仅为0.581,均低于Ktrans、Kep及TTP值的AUC。Vp为对比剂血浆容积分数,本研究发现增生伴慢性炎症组Vp低于其他2组,推测其原因,可能在于大量增生的间质组织阻止对比剂进入血管内,但有关具体机制还有需大样本、多中心研究进一步分析。
本研究结果表明,当Ktrans>1.43 ml/min、Kep>1.46 ml/min或TTP≤3.05 min时,诊断位于中央腺体且T2WI为低信号的前列腺癌的敏感度和特异度均较高,且三者间ROC曲线AUC两两比较差异均无统计学意义。
本研究的局限性:①病理样本多经直肠穿刺活检获得,存在一定的假阴性;②总体样本量相对较少,可能存在一定偏倚;③不同的药物动力学模型及主观因素等均可能影响DCE-MRI的定量分析结果,有待于进一步探讨。后续研究可采用多参数MRI进行综合分析,寻求最佳诊断方法,为计算机辅助诊断(computer aided diagnosis, CAD)技术[13-15]的发展提供数据支持。
