棉花色素腺体的研究进展
2017-06-01
(河北省农林科学院棉花研究所/农业部黄淮海半干旱区棉花生物学与遗传育种重点实验室,石家庄050051)
棉花色素腺体的研究进展
钱玉源,张海娜,崔淑芳,刘祎,王广恩,金卫平,韩轩,李俊兰
(河北省农林科学院棉花研究所/农业部黄淮海半干旱区棉花生物学与遗传育种重点实验室,石家庄050051)
解除棉酚对于棉花综合利用的限制,将会大大提高植棉收益,有助于促进棉花产业升级,而培育低酚棉是解决这一问题的关键。从棉花色素腺体的形态建成、色素腺体与棉酚的关系和色素腺体的遗传三个方面对棉花色素腺体的研究进展进行了综述,并阐述了已有研究成果对于今后色素腺体形成机理研究及棉花新品种培育的作用。
棉花;色素腺体;棉酚;形态建成
劳动力成本的不断增加,严重影响了棉花的种植效益,加之粮棉比效益下降,从而影响了棉农的植棉积极性,致使棉花的种植面积大幅下降。提高棉花的综合利用价值,特别是棉籽的开发利用,将会大大提高植棉收益,有助于促进棉花的产业升级。棉花色素腺体中储存的大量棉酚及棉酚类似物,是棉株抵御病虫危害的重要植保素。但棉酚的存在也严重影响了棉花的开发利用。因为棉花不仅是重要的纤维原料,同样也是世界上第三大植物蛋白资源,每年生产的棉籽蛋白总量可以满足5亿人口的蛋白需求,但棉酚对于人和单胃动物具有毒性,过多摄入会引起消化功能紊乱,损害胃粘膜,从而严重限制了棉籽蛋白的开发利用[1,2]。为解决这一矛盾,科学家们对棉花的色素腺体及其内含物进行了很多的研究,以期能够为棉花综合开发利用提供理论基础。
1 棉花色素腺体的形态建成
根据色素腺体的形态和棉酚含量,棉花可以分成4种色素腺体类型:有色素腺体型、无色素腺体型、子叶色素腺体延缓形成型和种仁有腺体无酚型。其中有色素腺体棉花中存在着不同的腺体形态建成方式。
1.1 有色素腺体型
棉花色素腺体是锦葵科棉属及近缘植物特有的一种分泌结构,由1~3层分泌细胞包围而成,为腔体结构。色素腺体腔的形成方式曾长期存在争议。一种认为腔体是通过裂生的方式产生的,因为分泌物首先出现于分泌细胞的间隙,而间隙是由于分泌细胞的分离产生的;另一种认为腔体是由于分泌细胞的溶解产生的,因为初始形成的腔体中有类似细胞壁残余结构[3]。

图1 陆地棉叶片色素腺体的形态建成[4]
西北大学刘文哲团队,通过实验最终证实棉花色素腺体腔的形成是典型的溶生发育方式,并且证实棉花色素腺体的发育是一种植物程序性死亡的过程(Programmed cell death,PCD)。棉花色素腺体的形态建成可以划分为4个阶段:(1)原始细胞,一团细胞质浓厚的基本分生组织细胞;(2)色素腺体细胞团分化,分化为中央细胞和鞘细胞两个区域,随之中央细胞的细胞壁逐渐溶解,形成一个小的腔隙;(3)色素腺体腔形成,随着色素腺体的发育,中央腔隙随着上皮细胞的切向延展而增大,并伴随着上皮细胞的降解;(4)成熟的色素腺体,由一层扁平的上皮细胞和层鞘细胞组成,中央围绕大的分泌腔(图1)[4]。
1.2 子叶色素腺体延缓形成型
有色素腺体的棉花种子中存在着肉眼可见的色素腺体,而澳洲的二倍体野生棉中存在着一类棉花,种子中没有肉眼可见的色素腺体结构,但种子萌发以后,子叶和下胚轴中可形成含有内含物的色素腺体,成株后茎、叶、铃等均有色素腺体,这种表型被称之为子叶色素腺体延缓形成性状[5]。
澳洲野生棉种色素腺体的形态建成可以分为两个阶段:(1)色素腺体原形成期。利用石蜡切片技术,连续观察澳洲棉种子发育过程中的结构变化,发现当幼胚形态基本建成时,幼胚中会出现一些特异的细胞,与周围细胞相比体积偏大,细胞质致密,后经连续多次分裂,形成一些稠密的细胞团,外围环绕有2~5层花环状排列的扁平细胞,形成的这一特殊结构称之为色素腺体原。色素腺体原在种子发育过程中不会发生溶解产生色素腺体腔,并保持到种子成熟。(2)色素腺体腔形成期。澳洲棉种子萌发后,子叶中色素腺体原的中间细胞开始解体,形成裂隙,待细胞完全解体后就形成了正常的带腔体的色素腺体结构。色素腺体腔形成初期,由于腔内没有棉酚等内溶物,所以肉眼仍然看不到色素腺体结构。待棉酚等有色物质进入腔体后,肉眼即可观察到色素腺体[6~9](图2)。
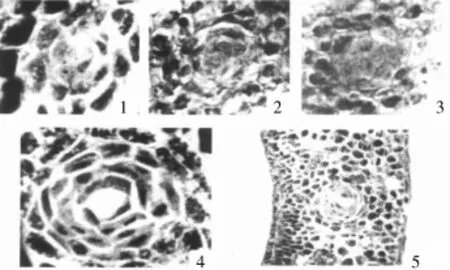
图2 比克氏棉的色素腺体原和色素腺体形态结构[9]
1.3 种仁有腺体无酚型
司笃克氏棉和索马里棉这类棉花,成熟种子中存在肉眼可见的色素腺体结构,但棉酚含量却极低(低于0.02%),其色素腺体的形态建成处于有色素腺体棉种与具有色素腺体延缓棉种之间的过渡形态。形态建成早期形成色素腺体原,但不保持到种子成熟,就解体形成带有腔体的色素腺体结构。这类棉花形成的色素腺体,色素腺体腔大小介于有色素腺体型和子叶色素腺体形成延缓型之间,腔壁也明显不同其他两种类型,不具有类似子叶色素腺体形成延缓型的厚壁也不具有类似有色素腺体型色素腺体壁的形态,而且腔体内含有一些大块物质[9~11](图3)。

图3 司笃克氏棉幼胚与成熟种子萌发过程中的色素腺体[10]
2 色素腺体与棉酚的关系
棉酚是棉属特有的一种黄色的二聚倍半萜烯化合物,主要在根部形成,然后转运储存于棉花的根、茎、叶和种子等表皮组织的色素腺体中,以游离态和结合态两种类型存在[12~15]。大量研究表明,棉花的色素腺体不仅是棉酚的贮藏场所而且与棉酚的合成有着密切关系。但不同类型的棉花之间,色素腺体和棉酚存在着不同相关性。
2.1 陆地棉(有色素腺体型)
周亚福在研究棉花色素腺体发育过程中,利用醋酸铅沉淀法沉淀陆地棉叶色素腺体中酚类物质,发现棉花色素腺体是棉酚合成和积累的重要位点。并且发现在色素腺体发育的过程中,细胞质和自溶体中酚类物质逐渐增多,但质体或内质网等细胞器中始终无酚类物质积累,从而推测棉酚最初可能在细胞质中自由生成[16]。
项时康等对陆地棉幼苗棉酚动态分析发现,有腺体和无腺体棉花的胚根中均有棉酚的存在,而且无腺体棉花胚根中棉酚含量高于有腺体棉花。但子叶还未展开之前无腺体棉花的下胚轴和子叶中无棉酚的存在,而有腺体棉花中存在肉眼可见的腺体,并且存在棉酚[17]。
2.2 司笃克氏棉(种仁有腺体无酚型)
丁亮等对司笃克氏棉(G.stockii)色素腺体的形态建成与棉酚动态进行研究,发现棉酚含量随种胚的生长发育而呈升高的趋势,推测种胚棉酚含量变化可能与其色素腺体的形态建成有一定的关系。但从色素腺体密度与棉酚含量的相关性来看,司笃克氏棉种子萌发过程中的色素腺体密度与棉酚含量存在显著的负相关[10]。
2.3 澳洲野生棉(子叶色素腺体延缓形成型)
祝水金等通过对5个澳洲野生棉种色素腺体和棉酚性状研究后发现,澳洲野生棉种除下胚轴和花瓣的棉酚含量与色素腺体的密度和大小存在着显著的正相关外(r=0.9016),其余器官的棉酚含量与色素腺体的密度和大小的相关性不明显[8]。
3 色素腺体的遗传研究
3.1 隐性无腺体型
目前,发现控制棉花无腺体性状的基因位点有6个,分别为gl1、gl2、gl3、gl4、gl5和gl6,而且每个基因位点存在多个复等位基因,例如gl2位点就存在Gl2/Gle2/gls2/gl2等4个复等位基因[18~23]。研究发现,这6个位点控制植株不同部位的腺体形成,且作用效果不同。其中gl2和gl3起主要作用,控制子叶、叶片、茎、叶柄、心皮壁腺体的形成。gl1相比gl2和gl3作用效果相对较弱,控制棉花的铃壳、茎秆、下胚轴和叶柄中腺体的形成。gl4和gl5只能起到修饰作用,可以减少色素腺体的密度,但不会对腺体的密度产生实质性的影响。gl6虽然有着相似的功能,但作用效果相较gl1更弱。在这6对基因位点中,只有当gl2和gl3两个位点隐性纯合时,才表现出全株无腺体表型[24~26]。
3.2 植株有腺体、种子无腺体型
湖南省棉花研究所筛选获得的一陆地棉突变体,性状表现为植株有腺体而种子无腺体[27],并命名为‘湘X9628(湘棉18)’。对‘湘X9628’进行遗传分析后发现,这一性状是由2对重叠的隐性基因控制,其中一对基因是gl2的等位基因,另一对基因定名为gln3,是gl3基因位点的复等位基因[28]。
为了鉴定控制腺体形成的相关基因,以‘湘棉18’为材料,通过构建腺体发育期cDNA文库和借助基因芯片技术,发现了303个相关基因,分别参与逆境胁迫响应、活性氧响应、棉酚合成和过氧化物酶活性等代谢过程[29,30]。另有研究证实,H2O2(活性氧的一种)细胞程序性死亡(PCD)过程的重要信号分子,可能对棉花色素腺体细胞的PCD过程起重要的调节作用。采用高通量测序技术及生物信息技术,对澳洲野生棉和海岛棉种子萌发后5、15和30 h的转录信息进行分析,发现可能有27种转录因子参与了色素腺体的形成,例如ERF,MYB,GRF,NAC,Trihelix,zf-HD,bHLH,co-like,WRKY,ARR-b等[31]。
3.3 显性无腺体型
“Bahtim 110”是1个无腺体突变体,遗传分析后发现,无腺体性状是由1个部分显性基因控制的,该基因是Gl2的复等位基因,并命名为Gle2[32]。
显性无腺体棉花,与隐性无腺体棉花相比,不易受天然杂交的影响,在转育利用过程中易去杂、易纯合,可以有效缩短育种进程[33]。鉴于显性无腺体的这些特点,科学家更侧重于显性无腺体基因Gle2的发掘研究。
为了获得控制显性无腺体形成的基因Gle2,科学家们利用分子标记的方法对其进行了定位,试图通过图位克隆的方法获得该基因[34~39]。其中,程海亮等用‘中棉所12’和其近等基因系‘显性无腺体中棉所12’为亲本,Ma等用‘海1’和‘TM-1’为杂交亲本分别构建F2群体,应用分子标记方法对Gle2基因进行了精细定位。程海亮等最终将Gle2定位在了物理距离约15 kb的2个InDel标记之间,并在该区域发现了1个不含内含子的未知基因,属于bHLHMYC转录因子家族成员。该未知基因包含2个结构域:bHLH-MYC_N区和bHLH区,尤其是对MYC进行表达分析后发现,其在有腺体的棉花中表达而在无腺体的棉花中不表达,表明该基因可能是棉花腺体形成中的1个关键的正调控因子[40,41]。Ma等最终将该基因锚定在标记w7954和w5383之间的43 kb的区域内,并从该区域内克隆获得了包含1个HLH区的转录因子GoPGF。该转录因子可正向调控棉花腺体形成,将其沉默可以获得完全无腺体表型。GoPGF是首个被克隆获得的控制植物腺体形成的基因[42]。
4 研究评述与展望
4.1 腺体形态建成的机理
陆地棉色素腺体(有色素腺体型)的形态建成研究中,证实色素腺体腔是以溶生的方式产生的,并且色素腺体腔的形成是一个细胞程序性死亡的过程。这为研究色素腺体形态建成的调控机理奠定了基础。
相比有色素腺体型的色素腺体形成的一气呵成,子叶色素腺体延缓形成型的色素腺体形成需要经过色素腺体原这一中间结构,待种子萌发后才解体形成有腔的色素腺体。色素腺体原的存在,分解了色素腺体的形成过程,这为研究色素腺体原到色素腺体转变的调控机理提供了理想的材料。
4.2 色素腺体与棉酚的关系
虽然现有的研究表明腺体的形成或密度与棉酚的形成或积累有着密切的联系,但两者之间是一方促进另一方的关系还是相互促进的关系还有待进一步研究。
种仁有腺体无酚型,虽然其种仁中有腺体存在,但是没有棉酚的贮存,而其叶片棉酚含量明显高于一般含酚的陆地棉。植株能够产生棉酚,但不储存于种仁的色素腺体中,其中的原因有待深究。
4.3 色素腺体的遗传研究
利用传统的遗传学研究方法和分子生物学技术,对色素腺体的遗传特性进行大量的分析研究,发现了许多控制色素腺体形成的基因位点,并从显性无腺体棉花中成功克隆获得了1个控制腺体形成的基因GoPGF。但控制隐性无腺体类型、子叶色素腺体延缓形成型及种仁有腺体无酚型的基因仍未被克隆,控制不同腺体类型的基因是否相同、是否存在关联还有待考证。
随着研究技术的进步,尤其是高通量测序技术和基因编辑技术的发展,越来越多的腺体形成相关基因会被发掘鉴定出来,这将有助于阐明色素腺体的遗传规律及腺体形成的分子机理。色素腺体遗传规律和腺体形成机理的阐明,有利于发掘参与棉花色素腺体形成的基因,有助于通过基因工程解决传统育种周期长、难以打破不利连锁等不足,创制生产上所需的不同腺体类型的棉花品种。例如:利用种子特异启动子,创制综合性状优良的种子无腺体植株有腺体新种质。种子特异启动子,可以特异沉默种子发育过程中的腺体基因,而不影响其他部位腺体基因的表达,从而创制出种子无腺体,而植株体有腺体的棉花新种质。这一过程,可以在任何棉花品种中实现,可以通过转化综合性状优良的主推品种,创制出综合性状优良的棉花新品种,并且可以避免常规杂交转育创制无腺体种质时,因为基因连锁的存在,而引入不利性状基因。
基因工程技术势必会推进低酚棉产业的发展,促进棉花产业与畜牧业、食品加工业的结合,从而提高植棉收益,带动植棉的积极性,有利于我国棉花产业的可持续发展。
[1] Sunilkumar G,Campbell LAM,Puckhaber L,et al.Engineering cottonseed for use in human nutrition by tissuespecific reduction of toxic gossypol[J].Proceedings of the National Academy of Sciences,2006,103(48):18054-18059.
[2] 朱四元,陈金湘.棉酚腺体的遗传分析及低酚棉分子育种研究进展[J].中国农学通报,2005,21(9):57-60.
[3] 邱志坚,刘文哲.棉花色素腺体研究进展[J].鲁东大学学报(自然科学版),2008,24(2):162-167.
[4] Liu WZ,Zhou YF,Wang X,et al.Programmed cell death during pigment gland formation in Gossypium hirsutum leaves[J].Plant Biology,2010,12(6):895-902.
[5] 祝水金,蒋玉蓉,Reddy N,等.陆地棉子叶色素腺体延缓形成种质系的育成及其遗传研究[J].科学通报,2004,49(19):1987-1992.
[6] 童旭宏,祝水金,季道藩.陆地棉子叶色素腺体延缓形成性状的表现与组织结构观察[J].棉花学报,2005,17(3):137-140.
[7] 祝水金,季道藩.澳洲野生棉种子叶色素腺体延缓形成性状的遗传研究[J].科学通报,2001,46(2):132-137.
[8] 祝水金,季道藩,汪若海,等.澳洲野生棉种的子叶棉酚动态及与色素腺体形态的关系[J].棉花学报,1999,11(4):169-173.
[9] 丁 亮,祝水金,胡丹艳,等.比克氏棉和司笃克氏棉色素腺体形态建成的组织结构观察[J].棉花学报,2003,15(1):17-21.
[10]丁 亮,祝水金,胡丹艳,等.司笃克氏棉(G.stockii)色素腺体的形态建成与棉酚动态研究[J].作物学报,2004,30(2):100-103.
[11]胡丹艳.棉花色素腺体的形态结构与转育利用研究[D].杭州:浙江大学硕士学位论文,2002.
[12]张大煜.棉酚的性质及其用途[J].食品与生物技术学报,1989(1):64-67.
[13]冯立田,邓振旭.棉酚及其应用研究的概况和某些进展[J].山东师范大学学报(自然科学版),1999(1):64-66.
[14]朱美霞,李永起,戴小枫.棉酚腺体与棉酚生物合成及低酚棉分子育种[J].分子植物育种,2004,2(3):307-312.
[15]Smith FH.Determination of gossypol in leaves and flower buds of Gossypium[J].Journal of the American Oil Chemists'Society,1967,44(4):267-269.
[16]周亚福.几类植物分泌结构发育过程中的细胞程序性死亡研究[D].西安:西北大学博士学位论文,2011.
[17]项时康,吴也文,褚志亮,等.陆地棉幼苗棉酚动态分析[J].中国棉花,1988(3):20-22.
[18]邓德旺,曲健木.陆地棉色素腺体基因的表达[J].棉花学报,1991(2):1-8.
[19]邓德旺.棉花色素腺体的研究进展[J].河北农业大学学报,1988(4):125-131.
[20]曲健木.陆地棉色素腺体的表达及其遗传的特殊性[J].河北农业大学学报,1990(1):1-6.
[21]Miravalle RJ,Hyer AH.Identification of the Gl2gl2Gl3gl3genotype in breeding for glandless cottonseed[J]. Crop Science,1962,2(5):395-397.
[22]李炳林,黄晋玲,董俊梅,等.比克氏棉子叶色素腺体延缓形成性状转育研究进展[A].中国作物学会.作物科学研究理论与实践——'2000作物科学学术研讨会文集[C].中国作物学会,2001.
[23]Lee JA.Genetical studies concerning the distribution ofpigment gland in the cotyledons and leaves of upland cotton[J].Genetics,1962,47(1):131-42.
[24]李祥凤,徐自平.低酚棉与有腺体棉杂交后代的性状表现及保纯技术[J].山东农业科学,1993(2):24-26.
[25]McCarty JC,Hedin PA,Stipanovic RD.Cotton Gossypium spp.plantgossypol contents of selected GL2 and GL3 alleles[J].Journal of Agricultural&Food Chemistry,1996,44(2):613-616.
[26]Soomor AR,Kalhoro AD.Exploitation of trispecific hybrids to introgress the glandless seed and glanded plant trait of Gossypium sturtianum Willis into G.hirsutum L.[J].Pakistan Journal of Biological Sciences,1997,3(12):2013-2015.
[27]郭玉芳,张天真.陆地棉突变体材料湘X9628利用价值探讨[J].植物遗传资源学报,2001,2(4):26-28.
[28]张天真,张雪林,金 林,等.一个新的棉花腺体形成基因的遗传鉴定[J].作物学报,2001,27(1):75-79.
[29]Xie YF,Wang BC,Li B,et al.Construction of cDNA library of cotton mutant(Xiangmian-18)library during gland forming stage[J].Colloids&Surfaces Biointerfaces,2007,60(2):258-263.
[30]Quan S,Cai YF,Xie YF,et al.Gene expression profiling during gland morphogenesis of a mutant and a glandless upland cotton[J].Molecular Biology Reports,2010,37(7):3319-3325.
[31]Tao T,Zhao L,Lv Y,et al.Transcriptome sequencing and differential gene expression analysis of delayed gland morphogenesis in Gossypium australe during seed germination[J].Plos One,2013,8(9):63-63.
[32]Kohel RJ,Lee JA.Genetic analysis of Egyptian glandless cotton[J].Crop Science,1984,24(6):1119-1121.
[33]朱四元,陈金湘.低酚棉育种研究进展[J].江西农业学报,2006,18(4):18-23.
[34]Yuan YL,Chen YH,Tang CM,et al.Effects of the dominant glandless gene Gl2eon agronomic and fibre characters of upland cotton[J].Plant Breeding,2000,119(1):59-64.
[35]蒋小燕.陆地棉显性无腺体基因的RAPD和SCAR标记[J].棉花学报,2002,14(Z1):30.
[36]董承光,丁业掌,郭旺珍,等.海岛棉Gl2e显性无腺体基因的精细定位[J].科学通报,2007,52(20):2374-2378.
[37]董承光.海岛棉显性无腺体基因Gl2e的精细定位[D].南京:南京农业大学硕士学位论文,2007.
[38]黄 娟.棉花显性无腺体基因Gl2e的精细定位[D].南京:河南大学硕士学位论文,2012.
[39]席 骁.棉花腺体形成的表达谱分析及显性无腺体基因Gl2e的精细定位[D].武汉:华中农业大学硕士学位论文,2015.
[40]Cheng H,Lu C,John ZY,et al.Finemapping and candidate gene analysis of the dominant glandless gene Gl2ein cotton(Gossypium spp.)[J].Theoretical and Applied Genetics,2016,129(7):1345-1355.
[41]Jiang PF,Lu CR,Zou CS,et al.Analysis of differentially expressed genes from glandless near-isogenic lines of cotton[J].Cotton Science,2015,27(6):506-514.
[42]Ma D,Hu Y,Yang C,et al.Genetic basis for glandular trichome formation in cotton[J].Nature Communications,2016,DOI:10.1038/ncomms10456.
Research Progress of Cotton Pigment G land
QIAN Yuyuan,ZHANG Haina,CUIShufang,LIU Yi,WANG Guangen,JINWeiping,HAN Xuan,LIJunlan
(Institute of Cotton,Hebei Academy of Agriculture and Forestry Sciences/Key Laboratory of Cotton Biology and Genetic Breeding in Huanghuaihai Semiarid Area,Ministry of Agriculture,Shijiazhuang,Hebei050051,China)
If the gossypol restriction is removed for comprehensive utilization of cotton,the economic benefitof cotton farmerswill be greatly increased and the cotton industry upgrading will be promoted.Cultivating of glandless cotton varieties is a key to solve this problem.The research progress of cotton pigmentgland was summarized from three aspects,including the pigment gland morphogenesis,the relationship between pigment gland and gossypol,and the inheritance of pigment gland.The role of previous study results about the mechanism of gland formation and new cotton variety breeding were briefly described.
cotton;pigment gland;gossypol;gland morphogenesis
S562.01
A
1001-5280(2017)02-0205-06
10.16848/j.cnki.issn.1001-5280.2017.02.24
2016 12 13
钱玉源(1987-),男,助理研究员,硕士,研究方向为棉花遗传育种,Email:qyyuan8@163.com。*通信作者:李俊兰,研究员,硕士,主要从事棉花遗传育种研究,Email:li-junlan@sohu.com。
棉花生物学国家重点实验室开放课题(CB2015A13)。
