少孢节丛孢菌胞外几丁质酶AO—379基因克隆及其表达分析
2018-05-30钟文强孟庆玲乔军陈英贡莎莎王熙凤黄运福才学鹏
钟文强 孟庆玲 乔军 陈英 贡莎莎 王熙凤 黄运福 才学鹏

摘要:【目的】深入了解捕食线虫性真菌几丁质酶的生物学功能,为今后以少孢节丛孢菌重组几丁质酶AO-379研发线虫病生物防控制剂打下基础。【方法】克隆少孢节丛孢菌XJ-A1几丁质酶AO-379基因的全长序列,利用signalP4.1 server、InterPro、ExPASy等在线分析软件对其进行生物信息学分析;构建重组表达载体pET32a-AO-379,转化大肠杆菌BL21(DE3)感受态细胞后用IPTG进行诱导表达,并以SDS-PAGE和Western blotting检测分析表达获得的融合蛋白。【结果】少孢节丛孢菌几丁质酶AO-379基因全长1475 bp,含有1个1203 bp的开放阅读框(ORF),编码400个氨基酸。几丁质酶AO-379基因序列与少孢节丛孢菌标准株(ATCC 24927)几丁质酶基因序列的同源性为97.08%,其推导氨基酸的同源性为98.75%。几丁质酶AO-379属于糖苷水解酶18家族,具有SXGG和VDGFDLDFE两个催化区保守序列。其中,SLGGS位于第127~131位,为底物结合位点;VDGFDLDFE位于第173~181位,为水解酶催化活性位点。经大肠杆菌诱导表达获得的融合蛋白AO-379相对分子质量为60.0kD,且能与抗少孢节丛孢菌多克隆抗体发生反应。【结论】少孢节丛孢菌几丁质酶AO-379可在大肠杆菌中成功诱导表达,且获得的融合蛋白AO-379能与抗少孢节丛孢菌多克隆抗体发生反应,可用于研发线虫病生物防控制剂。
关键词:少孢节丛孢菌;几丁质酶AO-379;克隆;分子特征;原核表达
0引言
【研究意义】线虫病对畜牧业的危害日益凸显,家畜感染后可引起病畜消瘦、生产性能下降、机能代谢紊乱,甚至死亡,给畜牧业的生产和管理帶来诸多困扰,全球每年因线虫病造成的经济损失超过1570亿美元(Abad et al,2008)。虽然化学驱虫药物的应用使得家畜线虫病得到短暂而有效的控制,但长期使用极易带来耐药性、药物残留及环境污染等弊端。因此,亟需寻找一种新型药物以解决家畜线虫病对畜牧业带来的危害及化学药物对环境造成的污染等问题。【前人研究进展】捕食线虫性真菌是家畜寄生线虫的自然天敌,在渗透、固定和降解线虫的过程中发挥着重要作用,理论上可用这类真菌为原料研发防治线虫病的生物制剂(Paraud and Chartier,2003;Terrill et al,2004)。在线虫的诱导下,捕食线虫性真菌会产生复杂的菌丝体,如黏性网、黏性球和收缩环,同时分泌一些水解酶。在菌丝机械力和水解酶(几丁质酶、丝氨酸蛋白酶和胶原蛋白酶等)的协同作用下,真菌菌丝侵入线虫体内而发挥杀灭线虫的作用(Yang et al,2011;Andersson et al,2013;Lianget al,2013;Zhao et al,2015;赵海龙等,2017)。少孢节丛孢菌(Arthrobotrys oligospora)是捕食线虫性真菌的代表菌,其与宿主线虫间的相互作用已得到广泛应用(Nordbring-Hertz,2004)。几丁质(Chitin)是线虫体壁和虫卵外壳的主要成分(Tikhonov etal,2002),是由N-乙酰-β-D-氨基葡萄糖以β-1,4糖苷键连接而成的高分子生物多聚体,但来源于致病性真菌的几丁质酶能催化几丁质β-1,4糖苷键水解(赵海龙等,2017)。现已有研究发现,捕食线虫性真菌几丁质酶可参与线虫表皮侵入和宿主细胞壁的降解(Tikhonov et al,2002;Nordbring-Hertz,2004;Tiffin,2004),是捕食线虫性真菌发挥捕食线虫功能的一种重要功能蛋白。张成敏等(2009)研究表明,厚垣普奇尼亚菌系产生的几丁质酶能消解南方根结线虫卵壳,特别是胚前发育期的未成熟卵,起到抑制虫卵孵化或杀死虫卵的作用。赵海龙等(2015)研究证实,少孢节丛孢菌XJ-A1几丁质酶AO-801和AO-483均具有典型的几丁质酶催化区保守序列SXGGW和DGXDXDWE,属于糖苷水解酶18家族几丁质酶,与昆虫病原真菌几丁质酶的亲缘关系最近,推测其在侵入宿主的过程中发挥着相似功能。【本研究切入点】目前,针对少孢节丛孢菌几丁质酶编码蛋白分子特征及表达分析的研究鲜见报道。【拟解决的关键问题】对少孢节丛孢菌XJ-A1几丁质酶AO-379基因进行克隆测序及原核表达分析,旨在深入了解捕食线虫性真菌几丁质酶的生物学功能,为下一步以少孢节丛孢菌重组几丁质酶AO-379研发线虫病生物防控制剂打下基础。
1材料与方法
1.1试验材料
少孢节丛孢菌XJ-A1分离株和大肠杆菌DH5a菌株由石河子大学寄生虫实验室保存提供;2xTaqPCR反应试剂和DNA Marker购自北京索莱宝科技有限公司;质粒小提试剂盒、琼脂糖凝胶回收试剂盒、pMD 19-T载体和Biospin真菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司。YPSSA培养基(0.8g酵母提取物、可溶性淀粉、4.0g琼脂,加蒸馏水至200 mL)经高压灭菌后倾注于灭菌玻璃培养皿,4℃保存备用。
1.2引物设计与合成
根据GenBank已发表的少孢节丛孢菌标准株(ATCC 2492)AO-379(AOL_s00004g379)mRNA序列,利用Primer 5.0设计几丁质酶AO-379基因的特异性引物,上、下游引物分别引入EcoR I和Xho I限制性内切酶位点。AO-379-F:5'-GGAATTCATGTT-GTTCAAATATAT-3'(下划线部分为EcoR I酶切位点);AO-379-R:5'-CCCTCGAGGCTTAGTTGGACAAGAAGCCC-3'(下划线部分为xho I酶切位点),引物由北京六合华大基因科技股份有限公司合成。
1.3几丁质酶AO-3795因克隆
将少孢节丛孢菌XJ-A1分离株接种于YPSSA培养基上,在20℃霉菌培养箱培养1周后取适量菌丝,按照真菌DNA提取试剂盒说明提取XJ-A1分离株基因组DNA,用特异性引物(AO-379-F/AO-379-R)进行PCR扩增。在此基础上,提取XJ-A1分离株总RNA,用反转录试剂盒反转录成cDNA,再进行PCR扩增。PCR反应体系20.0μL:PCR Mixtiure 8.0μL,上、下游引物各0.5μL,cDNA模板2.0μL,ddH20 9.0μL。扩增程序:95℃预变性5 min;94℃50 s,63℃40 s,72℃100 s,进行35个循环;72℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳分离后切胶回收。
1.4序列测定及结构域分析
分别回收PCR和RT-PCR基因片段,与pMD19-T载体4℃连接过夜,然后转化DH5a感受态细胞,经氨苄抗性培养基筛选后挑取单一菌落进行扩增培养,提取质粒,经PCR和EcoR I、Xho I双酶切鉴定。将阳性质粒送至北京六合华大基因科技股份有限公司测序,然后利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)、InterPro(http://www.ebi.ac.uk/interpro/)、ExPASy(http://www.expasy.org/tools/)等在线分析软件对几丁质酶AO-379基因全长和cDNA进行生物信息学分析。
1.5原核表达载体构建
用EcoR I和Xho I对重组质粒pMDT-AO-379和pET32a载体分别进行双酶切,回收pET32a和A0-379双酶切片段,在T4 DNA连接酶作用下4℃连接过夜,然后转化DH5a感受态细胞,在氨苄抗性培养基上3 7℃过夜培养,挑取单一菌落,经PCR和双酶切鉴定筛选出阳性重组表达载体(pET32a-AO-379)。
1.6目的蛋白诱导表达
以重组表达载体pET32a-AO-379转化BL21(DE3)感受态细胞,经氨苄抗性筛选,挑取阳性克隆接种于含氨苄抗性的LB液体培养基中,37℃培养至OD为0.6~0.8,加入IPTG(终浓度1 mmol/L)进行诱导表达。
1.7重组蛋白SDS-PAGE分析及Western blotting鉴定
分别诱导表达4、6和8 h后收集菌体,对重组菌的表达产物进行SDS-PAGE分析,并于表达量最高时收集菌体进行Westem blotting鉴定,其中,一抗为小鼠抗少孢节丛孢菌多克隆抗体(自备),二抗为HRP标记的兔抗小鼠IgG。
2结果与分析
2.1 RT-PCR和PCR扩增结果
以少孢节丛孢菌提取的总RNA为模板,分别经RT-PCR和PCR扩增后,采用1.0%琼脂糖凝胶电泳进行检测分析,结果表明,RT-PCR扩增产物大小约1200 bp(图1-A),PCR扩增产物大小约1500 bp(图1-B),均与预期结果相符。
2.2 AO-379基因测序结果及分子特征分析结果
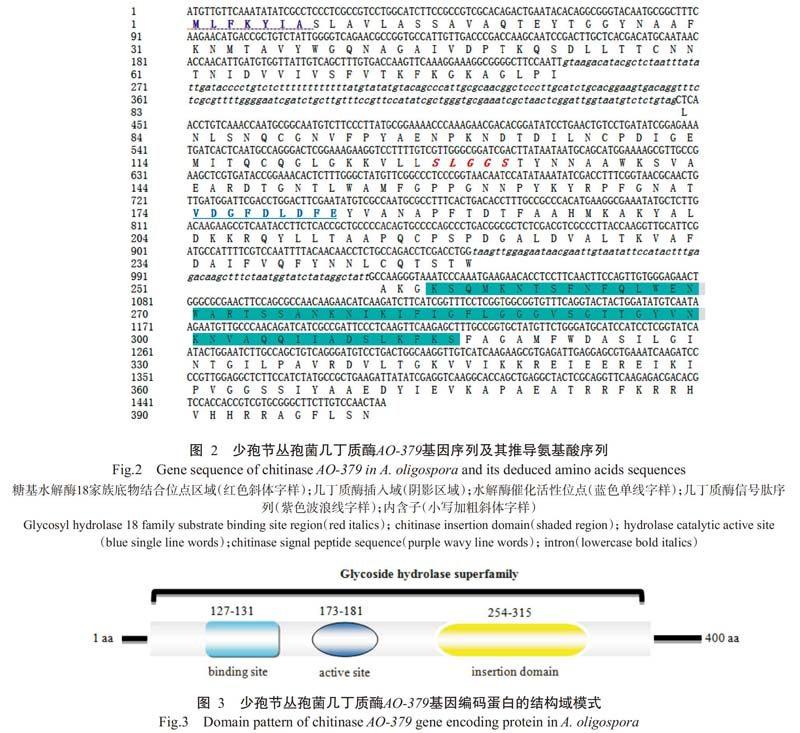
少孢节丛孢菌AO-379基因扩增产物测序结果(图2)表明,AO-379基因全长1475 bp,含有2个内含子序列,分别位于第247~446和739~810位核苷酸,内含子具有保守的5'-GT和3'-AG端,符合真菌内含子的特征;含有1个1203 bp的开放阅读框(ORF),编码由400个氨基酸组成的多肽。几丁质酶AO-379的二级结构以无规则卷曲(coil)、a-螺旋(alpha-helix)和β-折叠(beta-sheet)为主要结构元件,分别占61.9%、26.6%和11.5%。几丁质酶AO-379基因序列与少孢节丛孢菌标准株(ATCC 24927)序列的同源性为97.08%,其推导氨基酸的同源性为98.75%。ExPASy分析发现,几丁质酶AO-379含有多个保守结构域,属于糖苷水解酶18家族,具有SLGGS和VDGFDLDFE两个高度保守的区域,其中VDGFDLDFE区域还是几丁质酶的特征序列。SLGGS位于第127~131位,为底物结合位点;VDGFDLDFE位于第173~181位,为水解酶催化活性位点。几丁质酶AO-379氨基酸序列信号肽位于第1~21位,且存在一个几丁质酶插入区域,位于第254~315位(图3)。
2.3几丁质酶遗传进化分析结果
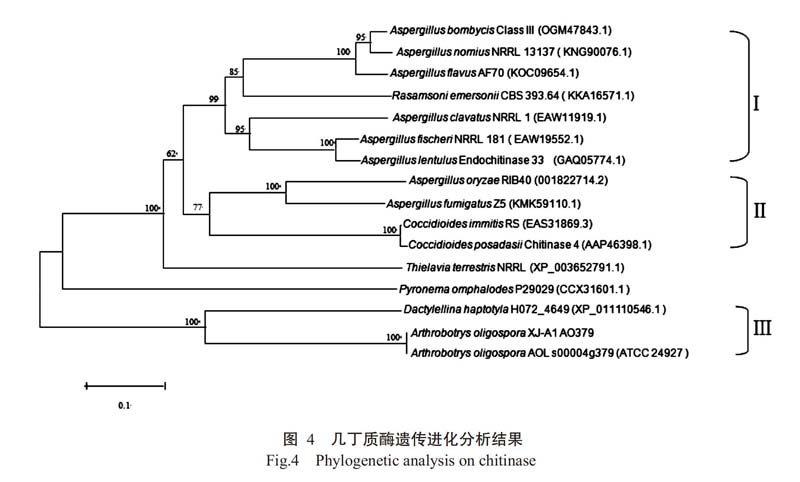
由基于几丁质酶AO-379氨基酸序列构建的系统发育进化树(图4)可看出,真菌几丁质酶可分成三大类。来自曲霉真菌的7个几丁质酶聚为一个分支(第1类),是由分子量约50.0 kD的几丁质酶组成;来自内寄生真菌和昆虫病原真菌的几丁质酶形成另一分支(第Ⅱ类),由分子量约38.0 kD的几丁质酶组成;少孢节丛孢菌几丁质酶AO-379与Dactylellina haptotyla几丁质酶亲缘关系最近,属于第Ⅲ类;而真菌Thielavia terrestris NRRL和Pyronema omphalodes P29029分别形成一个独立的分支,预测其分子量为43.0和38.7 kD(http://us.ex-pasy.org/tools/protparam.html)。
2.4重组表达载体pET32a-A0-3 79的鉴定结果
重组表达载体pET32a-AO-379经PCR扩增可获得与预期结果一致的目的基因条带;经双酶切鉴定也得到大小约1200 bp的插入片段条带(图5),与预期结果一致,表明重组表达载体pET32a-AO-379构建成功。测序结果证实,插入片段为少孢节丛孢菌几丁质酶AO-379基因。
2.5融合蛋白AO-379的诱导表达情况
SDS-PAGE分析结果表明,在60.0 kD附近出现目的蛋白条带(图6),其分子量与预期结果相符,说明重组菌经IPTG诱导4~8h,均能表达获得融合蛋白AO-379。Western blotting鉴定结果显示,在相对分子质量60.0kD处可见特异性反应条带(图6),即表达获得的融合蛋白AO-379能与抗少孢节丛孢菌多克隆抗体发生反应,进一步证实少孢节丛孢菌几丁质酶AO-379可在大肠杆菌中成功诱导表达。
3讨论
几丁质是一种氨基多糖(Kumar,2000;Tharana-than and Farooqahmed,2003),其结构成分坚硬且具有极强的抗性,对甲壳类生物体抵抗外界不良环境起关键性作用(Su et al,2017)。几丁质广泛分布于线虫虫卵及其表皮上,因此寻找一种能降解几丁质的生物防控制剂代替化学药物,对解决家畜线虫病害及减少化学药物对环境造成的污染等问题具有重要意义(Khan et al,2004)。捕食线虫性真菌可通过机械力和水解酶(几丁质酶、蛋白酶和胶原酶等)的协同作用进入线虫体内,从而降解线虫和虫卵体壁几丁质酶能破坏几丁质中的β(1-4)键,并将其完全水解成N-乙酰基-β-D-葡萄糖,因此推测几丁质酶是真菌穿透、附植和消化线虫过程中的关键毒性因子(Yang et al,2007;Huang et al,2012)。1994年,Tunlid等从少孢节丛孢菌中分离纯化获得丝氨酸蛋白酶PII,并证实其对线虫角质层具有降解作用。之后,几丁质酶的研究得到深入开展,目前已从Magnaporthe oryzae,Trichoderma reesei,Mythica ac-ridus和Metarhizium anisopliae等几种致病真菌中鉴定出15、18、21和30等几丁质酶(De031 et al,2005;Seidl et al,2005;Gao et al,2011),从非致病真菌构巢曲霉和N.crassa的基因组中也分别鉴定出10种几丁质酶(Pusztahelyi et al,2006;Tzelepis et al,2012)。此外,Yang等(2013)从少孢节丛孢菌的基因组中鉴定出编码几丁质酶的16个ORF,且发现在缺乏碳和氮的条件下,几丁质酶AO-190和AO-379分别上调2.33和1.64倍,说明几丁质酶在少孢节丛孢菌侵染线虫的过程中发挥重要作用。
目前,有关真菌几丁质酶的研究已有较多报道,并证明其具有重要的生物学功能(冯俊丽和朱旭芬,2004;Khan et al,2004;Tiffin,2004;赵海龙等,2015),但构建其原核表达载体的研究鲜有报道。本研究对少孢节丛孢菌几丁质酶AO-379基因进行克隆和原核表达分析,结果表明,几丁质酶AO-379基因序列与少孢节丛孢菌标准株(ATCC 24927)几丁质酶基因序列的同源性为97.08%,其推导氨基酸的同源性为98.75%,说明捕食线虫性真菌少孢节丛孢菌不同分离株间存在一定差异。几丁质酶AO-379结构域预测分析结果表明,不同来源的真菌几丁质酶具有相似结构域,从N端到C端含有几丁质酶催化域、几丁质结合域及C端区域等结构域,且N端催化区的天冬氨酸(Asp)和谷氨酸(Glu)残基高度保守,与冯俊丽和朱旭芬(2004)、赵海龙等(2015)的研究结论一致。本研究的少孢节丛孢菌几丁質酶AO一379属于糖苷水解酶18家族,含有1个高度保守的SLGGS底物结合位点和1个高度保守的VDGFDLD-FE水解酶催化活性位点;遗传进化分析结果显示,少孢节丛孢菌几丁质酶AO-379与Dactylelina hap-totyla几丁质酶亲缘关系最近;SDS-PAGE分析及Western blotting鉴定结果表明,少孢节丛孢菌几丁质酶AO-379可在大肠杆菌中成功诱导表达,且获得的融合蛋白AO-379能与抗少孢节丛孢菌多克隆抗体发生反应,可用于研发线虫病生物防控制剂。
4结论
少孢节丛孢菌几丁质酶AO-379可在大肠杆菌中成功诱导表达,且获得的融合蛋白AO-379能与抗少孢节丛孢菌多克隆抗体发生反应,可用于研发线虫病生物防控制剂。
