秀珍菇退化菌株生物学特征比较及dsRNA病毒检测
2018-05-30柯斌榕卢政辉吴小平陈发川兰清秀
柯斌榕 卢政辉 吴小平 陈发川 兰清秀
摘要:【目的】比较秀珍菇退化菌株与正常菌株的生物学特征并进行双链RNA(dsRNA)病毒检测,为秀珍菇栽培过程中选择优质菌种提供参考依据。【方法】开展秀珍菇退化菌株菌丝拮抗、菌丝生长速度及出菇试验,与正常菌株进行生物学特征比较,通过ITS扩增,利用RAPD、ISSR和SRAP分子标记分别进行差异性比较,并开展dsRNA病毒检测,分析秀珍菇菌株的退化原因。【结果】秀珍菇退化菌株X9和X13与正常菌株X5、X6及对照菌株X15间存在拮抗反应,当培养基的pH低于5.0时,退化菌株的菌丝生长速度显著降低(P<0.05,下同)。退化菌株X13菌丝的生长速度(4.95mm/d)、常温出菇单袋产量(73.34 g/袋)及低温刺激出菇单袋产量(107.69g/袋)均显著低于正常菌株和对照菌株。分子标记分析未发现供试菌株间存在遗传差异,dsRNA病毒检测发现供试菌株均存在dsRNA片段,其中退化菌株x13存在特异的dsRNA片段。【结论】秀珍菇退化菌株可能受dsRNA病毒感染,适应环境能力变弱,产量降低,生产上应注意菌株来源,避免使用退化菌株。
关键词:秀珍菇;栽培;退化菌株;dsRNA病毒检测
0引言
【研究意义】秀珍菇学名肺形侧耳(Pleurotuspulmonarius),隶属于真菌门担子菌纲伞菌目侧耳菌科侧耳属,最早由我国台湾地区引进,目前已在福建、浙江及上海等地广泛栽培(林原等,2015),其子实体形态纤小优美,质地细腻,鲜美可口,且出菇期在夏季,有利于缓解市场鲜菇紧缺状况。我国主栽的秀珍菇品种亲缘关系十分接近,经多年组织扩繁后易出现菌种退化和老化现象,制约其产业的健康发展(卢政辉,2008)。双链RNA(dsRNA)病毒在食用菌中广泛存在,有研究表明双孢蘑菇法国病与9个dsRNA片段有关(Morten and Hicks,1992)。本课题组前期研究发现退化的秀珍菇菌株中存在与正常菌株不同的dsRNA片段,但目前有关dsRNA病毒致使秀珍菇菌株退化的具體机理尚不清楚。因此,开展秀珍菇退化菌株生物学特征研究及dsRNA病毒检测,对选择秀珍菇生产用种具有重要指导意义。【前人研究进展】菌种退化现象在食用菌栽培中普遍存在,如蛹虫草栽培中菌种退化问题是困扰其产业发展的关键(林清泉等,2010),双孢蘑菇菌种退化导致基质降解能力下降,影响其栽培质量(陈美元等2011)。引起菌种退化的原因较多,如病毒感染(Magae and Hayashi,1999)、长期转管传代引起碱基错配及交配型因子变异或保藏环境不适宜导致突变等(丁湖广,2006;李丹青和王杰,2015)。Krzysz-tof(2010)研究表明,双孢蘑菇褐色病变及减产与蘑菇病毒x等有关。此外,Qiu等(2010)报道从退化的平菇天达300中提取到4个dsRNA片段。【本研究切入点】目前,针对秀珍菇菌种退化现象及原因的研究鲜见报道。【拟解决的关键问题】分离、观察秀珍菇生产中易感染木霉和黄菇病的退化菌株,通过与正常生产用种进行生物学特征比较,并进行dsRNA病毒检测,以期从中找出性状差异,为选择优质秀珍菇菌种用于生产提供参考依据。
1材料与方法
1.1试验材料
供试菌株来源:X9和X13退化菌株为本课题组从秀珍菇感病、低产菌包中分离获得,X5和X6菌株为本课题组从正常出菇秀珍菇菌包中分离获得,对照菌株X15由福建农林大学菌物研究中心保藏提供,平菇47菌株为平菇天达300退化菌株引至河南农业大学生命科学学院微生物实验室,作为dsRNA检测对照菌株。感染木霉和黄菇病的秀珍菇见图1。
供试培养基为马铃薯琼脂培养基(PDA):马铃薯200.0g,葡萄糖20.0g,琼脂20.0g,水1.0L,pH自然。栽培料配方:木屑75%,棉籽壳12%,麸皮12%,石灰1%,水含量65%。
1.2试验方法
1.2.1菌落形态比较及拮抗试验将秀珍菇菌株活化后,接种于含PDA培养基的90 mm平皿中,倒扣置于25℃培养箱中培养,待菌丝接近长满时,观察菌落形态。同时将X5、X6、X9、X13和X15菌株进行活化,接种于同一个含PDA培养基的培养皿中,菌种间相距约3 cm,呈三角形排列,并对所有菌株进行两两拮抗处理,每处理3次重复。置于25℃恒温箱中培养,观察拮抗现象。
1.2.2温度及pH对菌丝生长速度影响观测
接种于PDA培养基后,分别置于15、20、25、30和35℃培养箱中培养(每个温度梯度设5个重复),观察菌丝生长情况。采用PDA培养基,分别调整pH为4、5、6、7和8,每个pH梯度设5个重复,接种活化秀珍菇菌株后25℃恒温培养。当生长速度最快的菌丝长满培养基时,在菌落边缘划终止线。用直尺测量起始线与终止线的距离,计算各菌株在各温度及pH下菌丝生长速度的平均值。
1.2.3出菇试验按栽培料配方配置、搅拌、装袋后,将菌包高压灭菌2 h,冷却接种活化秀珍菇菌株后置于菇房中室温培养,每处理30个菌包,并记录菌丝在栽培料中的生长速度,菌丝满袋后再后熟培养15 d。从各处理中随机挑出一半菌包置于8℃菇房,低温刺激10 h后进行室温出菇管理(低温刺激出菇),另一半菌包不进行低温刺激直接进行室温出菇管理(常温出菇)。出菇管理按常规方式进行,统计菌包的污染率及产量。
1.2.4ITS扩增及遗传差异性分析取1.0 g菌丝放入研钵,加入液氮迅速研磨成粉末,转入7 mL离心管中,采用CTAB法提取DNA,-20℃保存备用,具体操作及ITS-PCR参考郑秋霞等(201 5)的方法。采用RPAD、SRAP和ISSR进行遗传差异性分析,经初步筛选选用如下引物:RAPD引物(S26、S29、S30、S32、S36、S38、S40、S47、S48和S78);ISSR引物(1、2、3、7、10、13、15、18、19和20);SRAP引物(em5-me9、em9-me5、em9-me7、em4-me5、em4-me7、em4-me9、em5-me5、em5-me7和em9-me9),上述引物均购自生工生物工程(上海)股份有限公司,具体操作参考江玉姬等(2013)的方法。
1.2.5 dsRNA病毒感染检测利用dsRNA在15%无水乙醇条件下能吸附于纤维素粉的特性,通过特异地吸附、洗脱去除杂质,进行纯化,后续操作则参考王丽等(2009)的方法。
1.3统计分析
采用DPS v7.05对不同菌株间菌丝生长速度及出菇产量等试验数据进行方差分析。
2结果与分析
2.1秀珍菇的菌落形态观察及拮抗反应
从图2可看出,不同秀珍菇菌株菌落形态差异不明显,但X13菌株的菌丝密度较其他菌株稀疏。由表1可知,对照菌株X15与正常秀珍菇菌株间无拮抗反应发生,而退化菌株X9和X13与正常菌株在拮抗试验中表现出拮抗反应。虽然退化秀珍菇菌株与正常菌株均源于同一种菌株,但经生产过程中的重复转代扩接及组织分离,菌株间可能已出现变异,从而产生拮抗反应。
2.2温度及oH对秀珍菇菌丝生长的影响
从图3和图4可看出,各菌株的菌丝均在25~30℃及oH 7-8时生长最快,但X9和X13菌株的菌丝生长速度显著低于其他菌株(P<0.05,下同),其中又以X13菌株的菌丝生长最慢;当培养基的oH低于5或高于9时,X9和X13菌株的菌丝生长速度与正常菌株及对照菌株X15差异显著。说明退化菌株X9和X13对环境的适应能力较其他菌株弱。
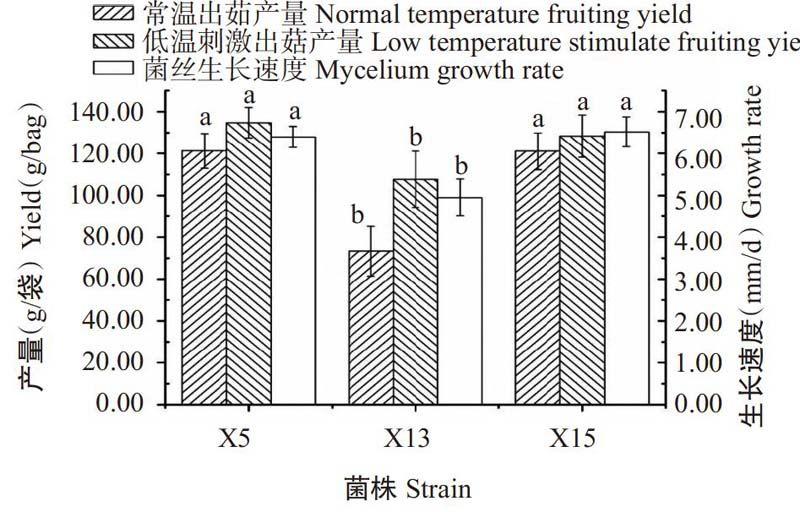
2.3秀珍菇出菇试验结果
选取PDA培养基上菌丝生长缓慢的X13菌株与对照菌株X15及正常菌株X5进行出菇试验,从图5可看出,X5、X13和X15菌株经过低温刺激后出菇产量均有一定程度提高,与实际生产情况相符,其中,生长速度最快的为X15菌株(6.52 mm/d),单袋产量最高的为经低温刺激的X15菌株(134.78 g/袋)。方差分析结果表明,X13菌株的生长速度(4.95 mm/d)、常温出菇单袋产量(73.34 g/袋)及低溫刺激出菇单袋产量(107.69 g/袋)均显著低于X5和X15菌株,X5与X15菌株的菌丝生长速度、常温出菇单袋产量及低温刺激出菇单袋产量间差异不显著(P>0.05)。同时,试验过程中未出现低温刺激处理后霉菌污染及黄菇病现象。
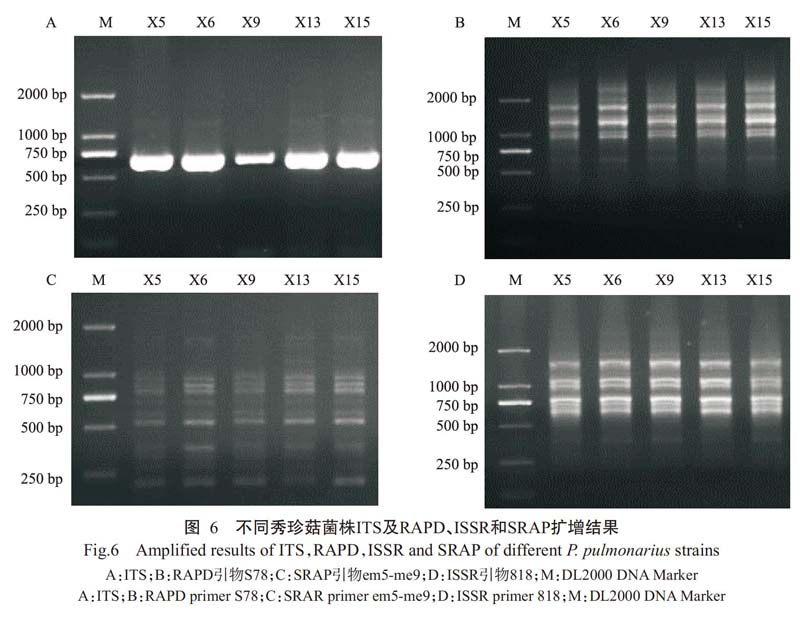
2.4 ITS鉴定及遗传差异性分析结果
从图6可看出,不同退化菌株、正常菌株与对照菌株X1 5的ITS片段大小一致,采用10个RAPD引物、10个ISSR引物和9对SRAP引物进行PCR扩增均可获得清晰的目的条带,且不同菌株间未出现差异条带。说明RAPD、ISSR和SRAP 3种分子标记无法将X5、X6、X9、X13菌株及对照X15菌株区分开来,表明其亲缘关系十分接近,也与实际生产情况相符。
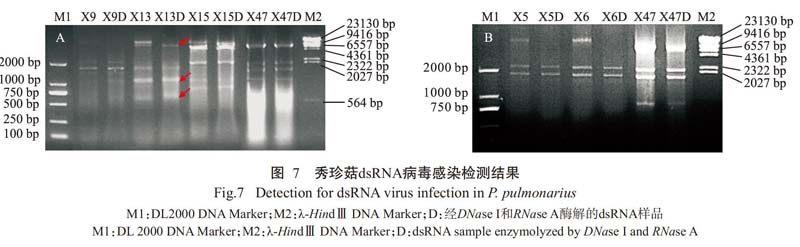
2.5 dsRNA病毒感染检测结果
以平菇47为对照进行dsRNA病毒检测,其中X5、X6、X9、X13、X15和X47菌株的dsRNA样品经DNase I与RNase A酶解后仍有条带,说明该条带为dsRNA条带。从图7可看出.平菇47具有较明显的4个dsRNA片段,同时在所有秀珍菇菌株中均检测到dsRNA片段。正常菌株X5和X6具有两个与退化菌株X9相同的dsRNA片段,大小约2300和1900 bp,退化菌株X13不仅具有上述两个片段,还有3个大小分别约8200、1000和600 bp的dsRNA片段。
3讨论
食用菌的菌种性状与活力关系到后期出菇的产量、质量及抗病能力。当前我国食用菌生产对菌种的使用尚不够规范,同种异名、同名异种的问题十分普遍,生产用种存在自行扩繁保藏现象,忽视菌种老化、退化等问题,进而影响食用菌的商品生产质量。本研究通过比较秀珍菇退化菌株与正常生产用菌株的生物学特征,发现退化菌株受温度及pH影响明显,进一步采用分子标记进行区分,未发现退化菌株在遗传上存在明显差异,与李丹青和王杰(2015)对退化草菇的研究结果存在差异,可能与选用的食用菌品种不同有关。在秀珍菇生产过程中为保证每批次菌包的出菇质量,常采取低温刺激菌包方式促进原基形成,易引起杂菌污染,尤其当菌丝活力不足,加之环境中杂菌基数过高,极易引起霉菌污染和黄菇病发生(郭倩等,2004)。
食用菌病毒主要由担孢子传播,且具有潜隐性,在受感染后并未立即表现出明显的危害症状(郭杰和吴小平,2013)。但许多研究表明,dsRNA病毒感染会造成菌株退化进而导致严重损失,如蘑菇病毒病导致大面积减产、子实体畸形或出现颜色变异等(Morten and Hicks,1992;Krzysztof,2010)。潘迎捷等(1992)研究发现,香菇感染病毒后菌丝生长退化,畸形菇比例增加。Yu等(2004)的研究也证实,感染病毒的平菇出现菌种退化、子实体畸形及菌丝生长缓慢等现象。本研究中,不同秀珍菇菌株中均检测到dsRNA片段,但有些菌株如X9和X13表现出退化现象,而有些菌株如X15表现正常。菌株退化与dsRNA病毒问是否存在相关性,还需通过脱毒试验和侵染性研究进一步验证。
快速进行退化菌株甄别及有效消除退化菌株给食用菌生产带来的隐患,防止因退化菌株流人生产环节造成的损失,一直是食用菌生产需面对和解决的问题。结合本研究中退化菌株表现的一些特征和生产实践经验,可考虑从以下几方面对生产用种进行管控。一是从有正规资质的菌种厂家引进菌种;二是对生产用种进行生物学特性及出菇试验,淘汰长势不良、抗性较差的菌株;三是谨慎使用试管或培养皿中出现角变等异常现象的菌株;四是采用尖端复壮(陈发川等,2011)、组织分离、原生质体再生(关圆圆等,2011)等方法适当进行菌种复壮。
4结论
退化秀珍菇菌株菌丝的生长速度变慢,出菇产量降低,且在退化菌株中检测出不同大小的dsRNA片段,因此,dsRNA病毒感染可能是引起秀珍菇菌种退化的重要因素,生产上应避免使用退化菌株。
