外泌体分离方法研究进展
2018-05-24张玉星陈文杰张丽果
张玉星,张 响,2,陈文杰,张丽果
(郑州大学:1力学与工程科学学院,2国家级微纳成型技术国际联合研究中心,河南 郑州450001;3郑州大学医药科学研究院,河南 郑州 450052)
0 引言
作为一种纳米级的膜性囊泡,外泌体(exosomes)在1983年首次被Johnstone等[1]在羊的网织红细胞培养液上清中发现并于1989年正式命名[2]。在这之后三十年间,外泌体研究进展较为缓慢。一直到2013年,诺贝尔生理学或医学奖授予美国科学家James E.Rothman、Randy W.Schekman和德国科学家Thomas C.Südhof,以表彰他们发现细胞内部囊泡运输调控机制。从此,外泌体研究领域进入全新的、高速的发展阶段,相关论文发表量相较于2013年以前有了大幅度提升(图1)。
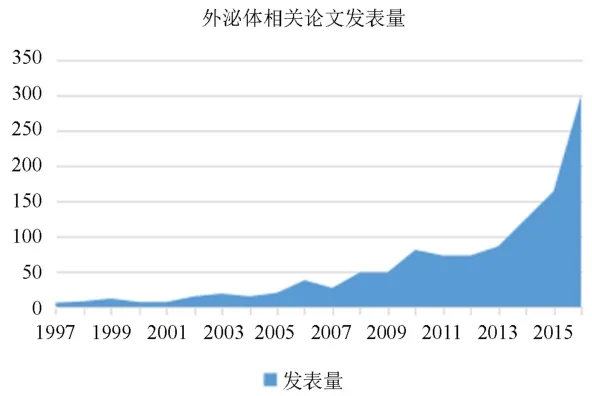
图1 近20年外泌体相关领域论文发表增长曲线
外泌体是细胞外囊泡大家庭中的一员。细胞外囊泡一般包括外泌体(30~150 nm)、微泡(100~350 nm)及凋亡小体(500 ~ 1000 nm)[3-5]。 外泌体来源于晚期胞内体(又称多泡体,multivesicular bodys,MVBs),电镜下观察形状呈杯状结构,直径为30~150 nm[5]。外泌体可以由体内或体外培养的细胞分泌,如小胶质细胞、淋巴细胞等,同时也存在于精液、尿液、腹水、乳汁、血清[6-9]等人体体液中。作为一个纳米级的膜性小囊泡,外泌体具有独立且完整的磷脂双分子层结构,并借此封装了母细胞的一部分,包括蛋白质、microRNA等。研究发现,部分外泌体甚至含有来源细胞的绝大多数蛋白质种类,更有学者报道当疾病发生时外泌体的组成会发生变化,例如卵巢癌患者分泌的外泌体中,Claudin4等肿瘤标志物含量上升,并且随着肿瘤的发展而逐渐增加[10]。因此通过分析患者体液中的外泌体成分与变化可以进行有效的医疗诊断、预测。近年来,外泌体被认为是潜在的新兴的临床诊疗的生物标志物,可以揭示来源细胞的生理信息,为临床诊断提供新方法。基于此,研究开发一种能够获得高浓度、高纯度的外泌体分离方法显得尤为重要。
2 外泌体的临床应用
早期人们认为外泌体是细胞内的“清道夫”,负责搬运细胞产生的废物[6]。后来,人们逐渐了解到外泌体还具有其他的生物学功能,如细胞通讯、运输载体等。反映到不同的细胞上,外泌体具有相应的特异性功能,如抗原呈递,抑制肿瘤细胞增殖,促进免疫反应等。
外泌体是生命科学的一个前沿领域,已有越来越多的学者关注外泌体的临床研究。例如,外泌体可以促进血管生成,抗凋亡,增进有丝分裂,促进生长因子释放,能够诱导修复心肌,减少心脏损伤范围[11]。并且外泌体被认为是肿瘤临床诊疗的生物标志物,比如食管癌[12]、结肠癌[13]、胶质母细胞瘤[14]的潜在标志物均来自从血液中分离的外泌体。研究[15]证实,外泌体在胰腺癌诊断中也具有非常重要的标志性价值。Taylor等[16]首先提出可以通过检测血液外泌体miR⁃NA来诊断卵巢癌,并且该研究团队表示:从血清中分离出的肿瘤来源外泌体中的miRNA与卵巢癌组织中提取出的miRNA具有很好的相关性。外泌体不仅可以改善肿瘤细胞生存环境[17],并且外泌体中的RNA进入靶细胞后还可以调控肿瘤的发展[18]。可以说,外泌体与肿瘤诊疗有着极其密切的关系,早期发现对提高癌症患者的存活率至关重要。外泌体不仅在肿瘤医疗领域具有广阔的前景,在新型药物投递策略领域中被认为是一种天然的药物运输载体[19]。此外,间充质干细胞外泌体(MSC⁃Exosomes)被一部分学者认为是未来生物疗法的理想载体[19-20]。
3 外泌体的分离方法
外泌体分离方法一般基于外泌体的物理化学特性,如尺寸、密度、质量、表面蛋白等。本研究认为高效的外泌体分离方法是利用外泌体在医疗诊断、预测及制药领域能否有实质性突破的前提。下面,本文将综述几种常见的外泌体分离方法,并重点讨论基于微流控技术的外泌体分离方法。
3.1 超速离心法 超速离心法分离外泌体是目前最普遍的一种方法。据估计,采用超速离心法的研究者占所有外泌体分离方法的56%[21]。超速离心法的步骤[22]如图2所示。最后用PBS洗涤,获得外泌体。
该法不需要对外泌体进行标记或者使用其他分离试剂,不易被污染,适用于大剂量样品分离。但是在分离过程中,由于超高速离心,外泌体的结构、功能很容易遭到破坏,并且易聚集成块,下游分析不利。此外,
该法较为耗时且需要专门的技术人员。
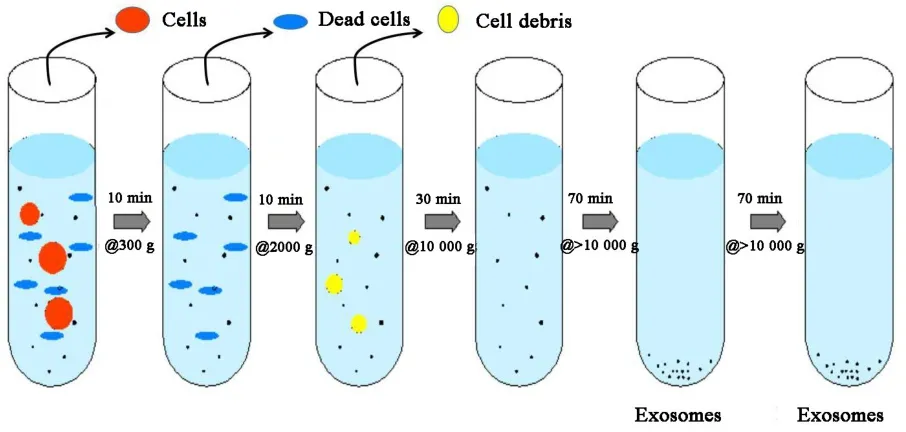
图2 超速离心法分离外泌体步骤示意图
3.2 蔗糖密度梯度离心法 蔗糖密度梯度离心法是基于超速离心法的一种外泌体分离方法,是对超速离心法的改进与优化。这种方法是在超速离心力的作用下,使蔗糖溶液从低到高形成连续分布的密度梯度层,通过形成的不同区域的条带对外泌体进行分离,外泌体将在 1.13~1.19 g/mL 的密度区域富集[23]。
3.3 商品化试剂盒沉淀法 商品化试剂盒沉淀法具有操作简便、不需要特殊设备等优点。然而,市面上的商品化试剂盒,往往价格较为昂贵,不利于大批量地提取外泌体。黄依瑶等[24]对超速离心法、EXO⁃Quick试剂盒、TEI试剂盒三种方法针对分离获得的外泌体标志物特异性表达情况进行比较。实验结果发现,差速离心法所获得的外泌体对 CD9、CD63、TSG101均表达,而试剂盒法提取到的外泌体仅表达TSG101。目前,用于外泌体分离的比较常用的商品化试剂盒有 EXOQuick(美国 System Biosciences公司)、TEI(美国 Invitrogen 公司)。
3.4 聚合物沉淀法 聚合物沉淀法是一种利用外泌体膜(磷脂双分子层膜)疏水的特性对外泌体进行沉淀富集的方法。渠香云等[25]建立了一种采用PEG8000对血清中的外泌体进行富集、分离的方法,并与超速离心法、商品化EXOQuick试剂盒进行比较。实验结果显示PEG8000沉淀法相较于前两种方法,所获得的外泌体粒径较小,粒径在30~150 nm的比例更高。这一结果证明PEG8000沉淀法所获得的外泌体纯度较高,夹杂的大囊泡结构较少。聚合物沉淀法具有不需要大型昂贵仪器设备,可大剂量样品处理的优点。但是,会受到共沉淀的其他物质的污染,影响下游分析。
3.5 超滤法 超滤法是一种依靠超滤膜两侧的压力差作为动力来分离外泌体的方法。由于超滤过程是在常温下进行的且不需添加化学试剂,所以对外泌体基本无成分破坏,也不会造成化学污染,因此分离出的外泌体纯度较高。林韩翡等[26]利用液压透析滤过法首次对健康成人24 h尿液中所有外泌体进行分离、富集并分析。该研究团队表示此方法对分离健康成人24 h尿液(1~3 L)具有高效(需 20 h)、简单等特点。胡国文等[27]研发出的旋转超滤法为以后的外泌体基础实验研究和临床实验提供了一种新型的外泌体获取方法。据报道,该方法可以快速、大量地从骨髓间充质干细胞中获取外泌体。
3.6 免疫磁珠法 免疫磁珠法分选具有特异性强、纯度较高、不影响外泌体结构形态的特点,但是效率低,且磁珠较为昂贵,难以普及。免疫磁珠分选步骤如图3所示。董宁[28]利用修饰了Glypican⁃1抗体的免疫磁珠来分离胰腺癌细胞培养上清液中的外泌体。据该报道,这种免疫磁珠分选法能够特异性的识别胰腺癌外泌体,且操作简便,样品消耗较少。虽然免疫磁珠法具有、特异性强、纯度高的优势,但Batrakova等[29]指出肿瘤的异质性可能对特异性识别造成不利影响,并且抗原表位可以被阻断或掩蔽,同样不利于特异性识别。
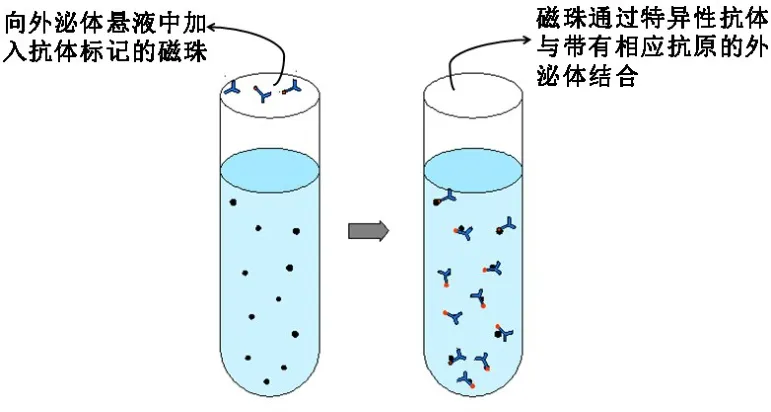
图3 免疫磁珠法步骤
3.7 微流控芯片法 传统的外泌体分离方法消耗的样品量较大,不利于稀缺样品量的分离,且样品的分离与检测是分开进行的。从外泌体的分离纯化到最后经过形态学和分子生物学鉴定,要经过多道程序。一种快速简便集成分离和检测的方法是必不可少的,因此,近年来利用微流控芯片来分离外泌体得到众多学者的关注[30-31]。 近日,美国杜克大学 Wu 等[32]研发了一种声波⁃微流控技术,该技术利用声压节点使不同大小的颗粒或细胞偏离中心,从而使在通道末端不同大小的颗粒或细胞被分开。这种技术可在不到25 min的时间里处理100 μL未稀释的血液样本,且样本回收率及纯度分别可达到82.4%和98.4%。此外,该研究团队利用纳米粒子追踪分析技术(NTA),得出分离前后直径小于140 nm的颗粒分别占总颗粒数目的23.6%和23.3%的结论,证明了该技术在分离过程中外泌体损失极少。美国斯坦福大学的Liu等[33]研发出了一种外泌体全分离芯片(以下简称EXOTic)。为研究细胞外囊泡(以下简称EVs)尺寸对蛋白质表达谱的影响,研究人员采用两种不同孔径滤膜的芯片分离前列腺癌细胞系的EVs,并与超速离心法对比。研究结果表明,EXOTic相较于超速离心法分离出的EVs含有更多种类的蛋白质。与此同时,韩国一研究团队在ACS Nano公布了一种基于尺寸的台式离心微流体系统(以下简称Exodisc)[34],该技术通过两个集成的纳米级滤膜,可在30 min内全自动富集20~600 nm的EVs。该研究团队将Exodisc富集细胞外囊泡的效率同超速离心法对比(表1)。显然,相较于超速离心法,Exodisc分离、富集EVs的效率更高。

表1 Exodisc与超速离心法富集效率对比
最近,中科院Liu等[35]研发了一种基于微流体粘弹性流动的无外场外泌体分离技术,该技术可以获得高纯度(>90%)、高回收率(>80%)的外泌体。该技术的特点是仅需极少量的(0.1%)PEO(聚环氧乙烷)就可在无外场的情况下实现外泌体分离。PEO的加入使得流体产生了较高的粘弹性,因此,在泊肃叶流中悬浮的纳米颗粒上产生了可控制粒子横向位置的弹性升力。此外,外泌体通过微流道的时间小于0.1 s,大大地减少了分离过程中对外泌体造成的物理破坏。
与传统方法相比,微流控技术具有显著的潜力与广阔的前景。一方面,微流控技术能够分离小体积样品中的外泌体,有助于临床前肿瘤小动物模型试验的研究。Kong等[36]建立了一种研究肿瘤转移的仿生微流控模型,相较于传统的小动物肿瘤转移模型,该模型为动物模型试验提供了一种低成本、省时、快速的替代方法。另一方面,就临床潜力来讲,微流体技术自动化程度高,所需样品量小,相较于超速离心法更适合临床应用。

表2 各类外泌体分离方法优缺点比较
4 外泌体的鉴定及定量方法
4.1 外泌体表面蛋白鉴定
4.1.1 Western blotting 法 Western blotting 法又称蛋白质印迹法,是一种非常有用的鉴定蛋白质的方法。由于外泌体膜表面存在特异蛋白“四跨膜家族”,因此利用WB法可以很好地鉴定外泌体。
4.1.2 BCA 蛋白检测法 Bicinchoninic acid (BCA)法是近来广泛应用的蛋白定量方法之一。与外泌体分离方法一样,蛋白质定量方法至今还没有出现一种广泛适用于任何需求的方法,现在的各种蛋白质定量法都各有各的长处与不足。因此,在定量蛋白质时往往采取不只一种方法来排除不相干因素的影响。本文介绍的BCA法灵敏度高,操作简易,受干扰物质的影响小。BCA法的显著优点是不受去垢剂的影响。
4.2 外泌体尺寸特征鉴定
4.2.1 透射电子显微镜 1933年,德国科学家Ruska和Knoll研制出了世界上第一台透射电镜(transmis⁃sion electron microscope,TEM),其分辨能力是光学显微镜的20倍。到现在,透射电子显微镜已经诞生了80多年,其分辨能力也比1933年时提高了超过100倍,目前TEM的分辨力可达0.2 nm。研究者可以利用TEM观测纳米颗粒的直径、形状、结构等,如外泌体、病毒、抗体疫苗等颗粒。但是,由于透射电镜视野的局限性,TEM无法为研究者提供可靠、相对准确的外泌体浓度。
4.2.2 纳米粒子追踪分析法 纳米粒子追踪分析技术(nanoparticle tracking analysis,NTA)是近年来纳米级别测量领域的一颗冉冉升起的新星,它是一种能够表征纳米颗粒分布的动态光散射技术。纳米粒子追踪分析法独特的测量技术可以为研究者提供可靠的外泌体实时浓度信息,可以对外泌体进行定量检测。电子显微镜的样本在使用前通常需要经过干燥、固定等有可能损坏外泌体的结构与功能。与此不同,纳米颗粒追踪分析仪具备的溶液状态可以使外泌体在被测量时更接近其原始状态,不仅能够保证其结构与功能的完好性,而且使研究结果更加真实有效。
4.2.3 原子力显微镜 原子力显微镜(automic force microscopy,AFM)具有非常广泛的适用性,并且具有诸多优点。与电子显微镜不同,AFM能够提供真正的三维表面图。其次,AFM不需要对样品进行预处理。此外,AFM对工作环境、样品制备的要求比电镜低得多,因此得到了广泛的应用[37]。
5 结论与展望
越来越多的研究已经证实外泌体对疾病体外诊断具有重要的标志性价值,因此外泌体的分离和富集技术的可靠性尤为重要。外泌体分离技术种类较多,每一种分离方法都是基于外泌体某一独特的性质,如尺寸、密度、可压缩率,表面蛋白等。但是,这些分离技术尚存在回收率低、纯度低、可能会受到污染等问题,严重影响下游结果的分析。总体来说,外泌体分离还没有形成一种高效的、大家共同认可的技术方法。
微流控技术在微观领域良好的性能在外泌体分离上得到了发挥,已有学者在微流控芯片上对外泌体进行分离、检测和量化,甚至对外泌体表面多种标志物进行检测。利用微流控技术分离方法和传统方法相比,分离和富集效率更高,对外泌体造成的物理损害大大减小,并且分离速度更快。虽然该方法还不是特别完善,尚未得到大家统一共识,但是其良好的性能已经在目前的研究中得到了验证。因此,还需要学者们对微流控技术分离外泌体方法的可靠性进行大量的验证。只有研究开发出高效可靠的外泌体分离和检测方法,外泌体在医疗诊断、检测上的独特性能才能得到有效的发挥。体外检测技术在疾病诊断中的应用也将因此达到新的高度。
[1]Pan BT,Johnstone RM.Fate of the transferrin receptor during matu⁃ration of sheep reticulocytes in vitro:selective externalization of the receptor[J].Cell,1983,33(3):967-978.
[2]Johnstone RM, Adam M, Hammond JR, et al.Vesicle formation during reticulocyte maturation association of plasma membrane activities with released vesicles(exosomes)[J].Biol Chem,1987,262(19):9412-9420.
[3]Cocucci E, Racchetti G, Meldolesi J.Shedding microvesicles: arte⁃facts no more [J].Trends Cell Biol,2009,19(2):43-51.
[4]Cocucci E, Meldolesi J.Ectosomes and exosomes: shedding the confusion between extracellular vesicles[J].Trends Cell Biol,2015,25(6):364-372.
[5]Lobb RJ, Becker M, Wen Wen S, et al.Optimized exosome isolation protocol for cell culture supernatant and human plasma [J].J Extra⁃cell Vesicles,2015,4(1):27031.
[6]Raposo G, Stoorvogel W.Extracellular vesicles: exosomes, mi⁃crovesicles, and friends [J].J Cell Biol,2013,200(4):373-383.
[7]Hosseini M, Khatamianfar S, Hassanian SM, et al.Exosome⁃encap⁃sulated microRNAs as potential circulating biomarkers in colon canc⁃er[J].Curr Pharm Des,2016,23(11):1705-1709.
[8]Madison MN, Roller RJ, Okeoma CM.Human semen contains exosomes with potent anti⁃HIV⁃1 activity [J].Retrovirology,2014,11:102.
[9]Wang D, Sun W.Urinary extracellular microvesicles: isolation meth⁃ods and prospects for urinary proteome [J].Proteomics,2014,14(16):1922-1932.
[10]Li J, Sherman⁃Baust CA, Tsai⁃Turton M, et al.Claudin⁃containing exosomes in the peripheral circulation of women with ovarian cancer[J].BMC Cancer,2009,9:244.
[11]王海龙,孙长斌,田进伟.外泌体在心肌梗死治疗中的新启示[J].转化医学电子杂志,2017,4(12):81-84.
[12]Tanaka Y, Kamohara H,Kinoshita K,et al.Clinical impact of serum exosomal microRNA⁃21 as a clinical biomarker in human esophageal squamous cell carcinoma[J].Cancer,2013,119(6):1159-1167.
[13]Silva J, Garcia V, Rodriguez M, et al.Analysis of exosome release and its prognostic value in human colorectal cancer[J].Genes Chro⁃mosomes Cancer,2012,51(4):409-418.
[14]Skog J, Würdinger T, van Rijn S, et al.Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers[J].Nat Cell Biol,2008,10(12):1470-1476.
[15]陈小平,寇玉彬,陆运松,等.外泌体在胰腺肿瘤中的研究进展[J].转化医学电子杂志,2017,4(9):66-69.
[16]Taylor DD, Gercel⁃Taylor C.MicroRNA signatures of tumor⁃derived exosomes as diagnostic biomarkers of ovarian cancer[J].Gynecol Oncol,2008,110(1):13-21.
[17]胡牧仁,陈 婷,杨长青,等.外泌体在肿瘤精准诊断与治疗中的研究进展[J].上海大学学报(自然科学版),2017,23(2):161-168.
[18]张 敏,张晨光,丁 卫.外泌体及其在肿瘤诊疗中的意义[J].生理科学进展,2014,45(5):372-378.
[19]李思迪,侯 信,亓洪昭,等.外泌体:为高效药物投递策略提供天然的内源性纳米载体[J].化学进展,2016,28(2):353-362.
[20]张 娟,史晋叔,李 剑.间充质干细胞源性外泌体——未来生物疗法的理想载体[J].中国实验血液学杂志,2015,23(4):1179-1183.
[21]Zarovni N, Corrado A, Guazzi P, et al.Integrated isolation and quantitative analysis of exosome shuttled proteins and nucleic acids using immunocapture approaches[J].Methods,2015, 87:46-58.
[22]翁叶靖,随志刚,张丽华,等.外泌体分离及其蛋白质组学分析的研究进展[J].色谱,2016,34(12):1131-1136.
[23]Yang C, Robbins PD.The roles of tumor⁃derived exosomes in cancer pathogenesis[J].Clin Dev Immunol,2011,2011:842849.
[24]黄依瑶,唐月汀,覃思华,等.血清中外泌体及外泌体 RNA提取方法的比较[J].中华检验医学杂志,2016,39(6):427-432.
[25]渠香云,程燚睿,高 鹏,等.一种新型血清外泌体分离方法的构建及其在乳腺癌微 RNA检测中的应用[J].肿瘤,2016,36(11):1225-1232.
[26]林韩翡,刘新宇,徐小蒙,等.健康成人24 h尿液细胞外囊泡定量及大小分布[J].南方医科大学学报,2015,35(11):1530-1534,1545.
[27]胡国文,李 青,牛 鑫,等.旋转超滤:一种提取细胞外泌体的新方法[J].第二军医大学学报,2014,35(6):598-602.
[28]董 宁.基于表面增强拉曼光谱标记和免疫磁分离的方法检测三聚氰胺和胰腺癌外泌体[D].广州:华南师范大学,2016.
[29]Batrakova EV, Kim MS.Using exosomes, naturally⁃equipped nanocar⁃riers, for drug delivery[J].J Control Release,2015,219:396-405.
[30]Kanwar SS, Dunlay CJ, Simeone DM, et al.Microfluidic device(Ex⁃ochip) for On⁃Chip isolation, quantification and characterization of circulating exosomes[J].Lab on a Chip,2014,14(11):1891-1900.
[31]Zhao Z, Yang Y, Zeng Y, et al.A microfluidic exosearch chip for multiplexed exosome detection towards blood⁃based ovarian cancer diagnosis[J].Lab Chip,2016,16(3):489-496.
[32]Wu M, Ouyang Y, Wang Z, et al.Isolation of exosomes from whole blood by integrating acoustics and microfluidics[J].Proc Natl Acad Sci USA,2017,114(40):10584-10589.
[33]Liu F, Vermesh O, Mani V, et al.The exosome total isolation chip[J].ACS Nano,2017,11 (11):10712-10723.
[34]Woo HK,Sunkara V, Park J, et al.Exodisc for rapid, size⁃selective,and efficient isolation and analysis of nanoscale extracellular vesicles from biological samples[J].ACS Nano,2017,11(2):1360-1370.
[35]Liu C, Guo J, Tian F, et al.Field⁃free isolation of exosomes from extracellular vesicles by microfluidic viscoelastic flows[J].ACS Nano,2017,11(7):6968-6976.
[36]Kong J, Luo Y, Jin D, et al.A novel microfluidic model can mimic organ⁃specific metastasis of circulating tumor cells[J].Oncotarget,2016,7(48):78421-78432.
[37]张 群.原子力显微镜[J].上海计量测试,2002,29(5):38-39.
